2019-2020学年新教材高中化学课后作业8钠的几种化合物焰色试验新人教版必修第一册
课后作业(八)
[基础巩固]
一、氧化钠和过氧化钠
1.下列关于Na2O和Na2O2的叙述正确的是( )
A.Na2O与Na2O2颜色相同
B.均可与CO2、H2O反应产生氧气
C.所含氧元素的化合价均为-2
D.阴阳离子的个数比均为1∶2
[解析] Na2O为白色固体,Na2O2为淡黄色固体,颜色不相同,A错误;Na2O与CO2、H2O反应不能生成氧气,B错误;Na2O2中氧元素的化合价均为-1,C错误;Na2O2中含有Na+、O,个数比为2∶1,Na2O中含有Na+、O2-,个数比为2∶1,D正确。
[答案] D
2.某溶液中含有Na+、SO、CO、HCO4种离子,若向其中加入一定量的Na2O2固体后,溶液中离子浓度基本保持不变的是( )
A.HCO B.Na+
C.CO D.SO
[解析] Na2O2加入溶液中与水反应生成NaOH和O2↑,OH-与HCO反应生成CO,所以会使Na+、CO浓度增大,HCO的浓度减小。
[答案] D
3.如图装置,试管中盛有水,气球a中盛有干燥的Na2O2颗粒。U形管中注有浅红色的水。将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
A.U形管内红水褪色
B.试管内溶液变红
C.气球a被吹大
D.U形管水位:d
c。
[答案] C
二、Na2CO3和NaHCO3
4.下列关于碳酸钠的叙述正确的是( )
A.碳酸钠俗称纯碱,因为碳酸钠是一种碱
B.碳酸钠溶液中滴入酚酞溶液,溶液呈浅红色
C.碳酸钠本身显碱性,所以不能与任何碱反应
D.用BaCl2溶液不能区分碳酸钠和碳酸氢钠溶液
[解析] 碳酸钠属于盐类,A项错误;碳酸钠可与氢氧化钙反应,C项错误;BaCl2溶液可与碳酸钠反应产生沉淀,而不与碳酸氢钠溶液反应,D项错误。
[答案] B
5.除去Na2CO3固体中少量的NaHCO3的最佳方法是( )
A.加入适量盐酸 B.加入NaOH溶液
C.加热分解 D.制成溶液后通入CO2
[解析] 根据NaHCO3的不稳定性,通过加热分解除去NaHCO3,并且又生成Na2CO3。
[答案] C
6.下列各组内的两种物质发生反应时,其产物不随反应物用量比的改变而发生变化的是( )
A.CO2和澄清石灰水 B.NaOH溶液和CO2
C.Na2CO3溶液和盐酸 D.NaHCO3溶液和盐酸
[解析] A项,CO2不足量,生成CaCO3,CO2过量,生成Ca(HCO3)2;B项,CO2不足,生成Na2CO3,CO2过量,生成NaHCO3;C项,盐酸不足,生成NaHCO3和NaCl,盐酸足量,生成NaCl、H2O和CO2。
[答案] D
7.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( )
A. B.
C. D.
[解析] 根据NaHCO3受热分解的化学方程式,结合反应前后固体的质量差可列式求解:
2NaHCO3Na2CO3+H2O↑+CO2↑ Δm
2×84 g 106 g 18 g 44 g 62 g
m(NaHCO3) (w1-w2) g
8
求出m(NaHCO3),即可得出样品的纯度。
[答案] A
三、焰色试验
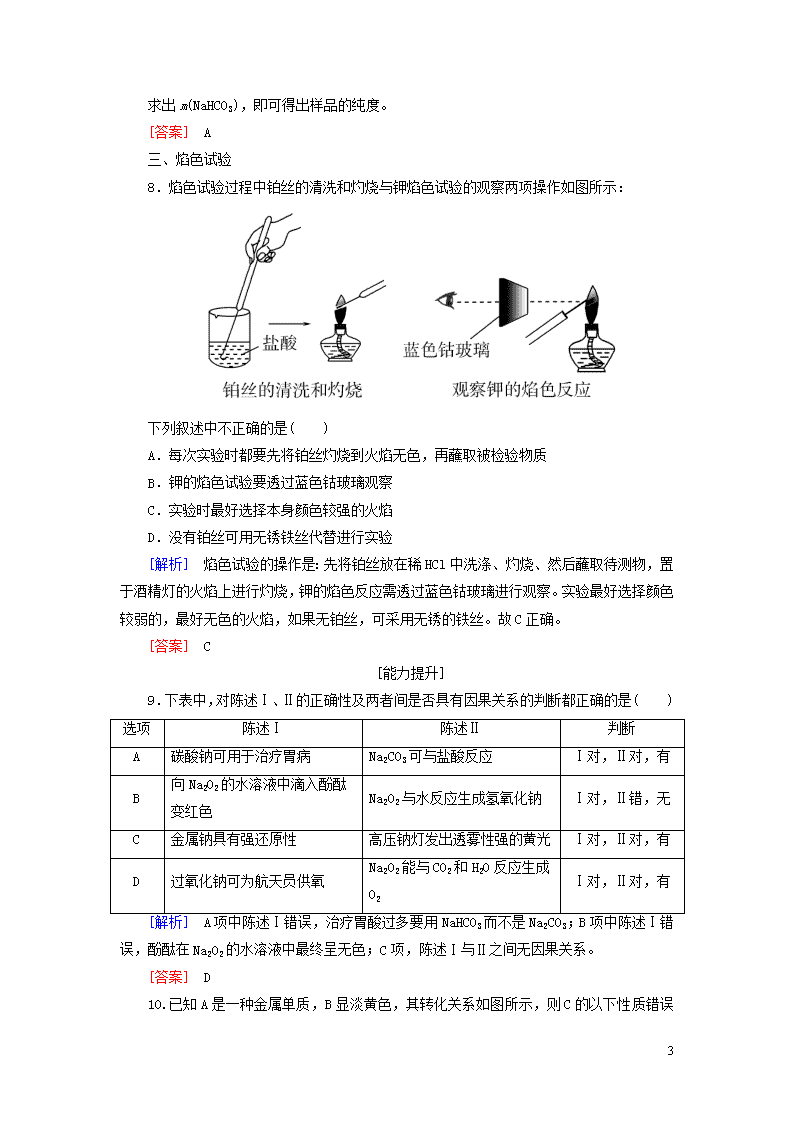
8.焰色试验过程中铂丝的清洗和灼烧与钾焰色试验的观察两项操作如图所示:
下列叙述中不正确的是( )
A.每次实验时都要先将铂丝灼烧到火焰无色,再蘸取被检验物质
B.钾的焰色试验要透过蓝色钴玻璃观察
C.实验时最好选择本身颜色较强的火焰
D.没有铂丝可用无锈铁丝代替进行实验
[解析] 焰色试验的操作是:先将铂丝放在稀HCl中洗涤、灼烧、然后蘸取待测物,置于酒精灯的火焰上进行灼烧,钾的焰色反应需透过蓝色钴玻璃进行观察。实验最好选择颜色较弱的,最好无色的火焰,如果无铂丝,可采用无锈的铁丝。故C正确。
[答案] C
[能力提升]
9.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项
陈述Ⅰ
陈述Ⅱ
判断
A
碳酸钠可用于治疗胃病
Na2CO3可与盐酸反应
Ⅰ对,Ⅱ对,有
B
向Na2O2的水溶液中滴入酚酞变红色
Na2O2与水反应生成氢氧化钠
Ⅰ对,Ⅱ错,无
C
金属钠具有强还原性
高压钠灯发出透雾性强的黄光
Ⅰ对,Ⅱ对,有
D
过氧化钠可为航天员供氧
Na2O2能与CO2和H2O反应生成O2
Ⅰ对,Ⅱ对,有
[解析] A项中陈述Ⅰ错误,治疗胃酸过多要用NaHCO3而不是Na2CO3;B项中陈述Ⅰ错误,酚酞在Na2O2的水溶液中最终呈无色;C项,陈述Ⅰ与Ⅱ之间无因果关系。
[答案] D
8
10.已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是( )
A.溶液呈碱性
B.受热易分解
C.与澄清石灰水反应产生白色沉淀
D.与足量盐酸反应放出气体
[解析] A是金属,B为淡黄色金属氧化物,则B为Na2O2,依次可推知A为Na,C为Na2CO3,D为NaOH。Na2CO3溶液呈碱性,A项正确;Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,C项正确;Na2CO3+2HCl===2NaCl+H2O+CO2↑,D项正确;Na2CO3性质稳定,受热不分解,B项错误。
[答案] B
11.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解 ②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在
该白色粉末可能为( )
A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3
C.Na2SO3、BaCO3 D.Na2CO3、CuSO4
[解析] A项,NaHCO3、Al(OH)3中加入足量稀硫酸有气泡产生,生成硫酸钠、硫酸铝、二氧化碳和水,最终无固体存在,错误;B项,AgCl不溶于酸,固体不能全部溶解,错误;C项,亚硫酸钠和碳酸钡加入水,碳酸钡不溶于水使部分固体不溶解,加入稀盐酸,碳酸钡与盐酸反应生成氯化钡、二氧化碳和水,固体全部溶解,再将样品加入足量稀硫酸,稀硫酸和碳酸钡反应生成硫酸钡沉淀、二氧化碳和水,正确;D项,Na2CO3、CuSO4中加入足量稀硫酸,振荡后无固体存在,错误。
[答案] C
12.下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色试验均为黄色。
8
回答下列问题:
(1)写出化学式:A________,B________,D________。
(2)以上反应中属于氧化还原反应的有________(填序号)。
(3)写出反应③的化学方程式: ____________。
氧化剂为________;氧化产物为________。
(4)写出反应②的化学方程式,并用单线桥法标出电子转移的方向和数目:_____________________。
(5)写出D溶液中通入CO2反应的化学方程式:
___________________________________________________。
[解析] A是一种常见单质,其焰色试验为黄色,则A是Na,B、C、D、E是含Na元素的常见化合物,Na在O2中燃烧生成B,B为Na2O2,Na和H2O反应生成NaOH和H2,Na2O2和水反应生成NaOH和O2,所以C是NaOH,NaOH和过量CO2反应生成NaHCO3,所以E是NaHCO3,Na2O2和CO2反应生成Na2CO3和O2,NaHCO3受热分解生成Na2CO3、CO2和水,所以D是Na2CO3。(1)通过以上分析知,A是Na,B是Na2O2,D是Na2CO3。(2)根据氧化还原反应的概念可知,以上反应中属于氧化还原反应的有①②③④。(3)反应③的化学方程式为2Na2O2+2H2O===4NaOH+O2↑,Na2O2中的氧元素一部分得电子作氧化剂,一部分失电子作还原剂,氧化剂是Na2O2,氧化产物是O2。(5)Na2CO3溶液中通入CO2的化学方程式为Na2CO3+CO2+H2O===2NaHCO3。
[答案] (1)Na Na2O2 Na2CO3
(2)①②③④
(3)2Na2O2+2H2O===4NaOH+O2↑ Na2O2 O2
(5)Na2CO3+CO2+H2O===2NaHCO3
8
13.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)________;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为_______________________________________________;
与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)________;
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到一套装置同时进行两个对比实验,而Ⅲ不能
(3)若用实验装置Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应,
①当澄清石灰水过量时,其离子方程式是_______________
_____________________________________________________;
②当NaHCO3过量时,其离子方程式是_________________
_______________________________________________________。
[解析] (1)Ⅰ装置反应现象相同;Ⅱ装置,向稀盐酸中分别加入等质量的Na2CO3、NaHCO3,NaHCO3与稀盐酸反应快且产生的CO2多,所以气球大的为NaHCO3。因此能够达到实验目的是Ⅱ;(2)碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳,发生反应为2NaHCO3Na2CO3+H2O+CO2↑,生成的二氧化碳与澄清石灰水反应生成碳酸钙,反应的方程式为CO2+Ca(OH)2===CaCO3↓+H2O,图Ⅳ不仅能鉴别碳酸钠和碳酸氢钠,同时又能验证碳酸钠和碳酸氢钠的稳定性,Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行;(3)Na2CO3直接加热不产生气体,而NaHCO3不直接加热就产生气体,就更说明NaHCO3
8
不稳定,所以试管B中装入的固体最好是NaHCO3;(4)①NaHCO3与Ca(OH)2发生复分解反应,①当澄清石灰水过量时,离子方程式为:HCO+OH-+Ca2+===CaCO3↓+H2O;②当NaHCO3过量时,反应方程式为:2HCO+2OH-+Ca2+===CaCO3↓+2H2O+CO。
[答案] (1)Ⅱ
(2)2NaHCO3Na2CO3+H2O+CO2↑ D
(3)碳酸氢钠
(4)①HCO+OH-+Ca2+===CaCO3↓+H2O
②2HCO+2OH-+Ca2+===CaCO3↓+2H2O+CO
14.在鲜活水产品的长途运输中,必须考虑以下几点:①水中需要保持适量的O2;②及时去除鱼类等排出的CO2;③防止细菌的大量繁殖。
(1)过氧化物具有杀菌消毒的性质,金属的过氧化物能与H2O反应产生O2,如:2Na2O2+2H2O===4NaOH+O2↑。现有两种在水中能起供氧灭菌作用的物质:Na2O2和CaO2,已知CaO2能缓慢与水反应。根据以上介绍,运输鲜活水产品时应选择________放入水中,理由是__________________________________________________
_______________________________________________________。
(2)写出过氧化钙与水反应的化学方程式
___________________________________________________。
(3)一养鱼爱好者欲测定过氧化钙样品中过氧化钙的质量分数,做如下实验:称取样品2.0 g,加入到足量的水中,生成氧气的质量为0.32 g。试计算所用样品中过氧化钙的质量分数。
[解析] (1)根据题给信息可知,选择的物质应该能持续吸收CO2并能不断提供O2,还要抑制细菌的大量繁殖,结合Na2O2的性质可知Na2O2不适合,因为Na2O2与水反应剧烈,且生成物NaOH为强碱,不利于鲜活水产品的存活。(2)过氧化钙与水的反应为2CaO2+2H2O===2Ca(OH)2+O2↑。
(3)2CaO2+2H2O===2Ca(OH)2+O2↑
2×72 32
m(CaO2) 0.32 g
=
m(CaO2)=1.44 g
样品中CaO2的质量分数为×100%=72%。
[答案] (1)CaO2 Na2O2与水反应剧烈,生成的NaOH溶液碱性太强,不利于鲜活水产品的存活(或CaO2
8
在水中溶解缓慢,供氧时间长,水溶液碱性弱,有利于鲜活产品的长途运输)。
(2)2CaO2+2H2O===2Ca(OH)2+O2↑
(3)72%
8