- 2021-08-24 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习小题仿真标准练(六)作业(全国通用)
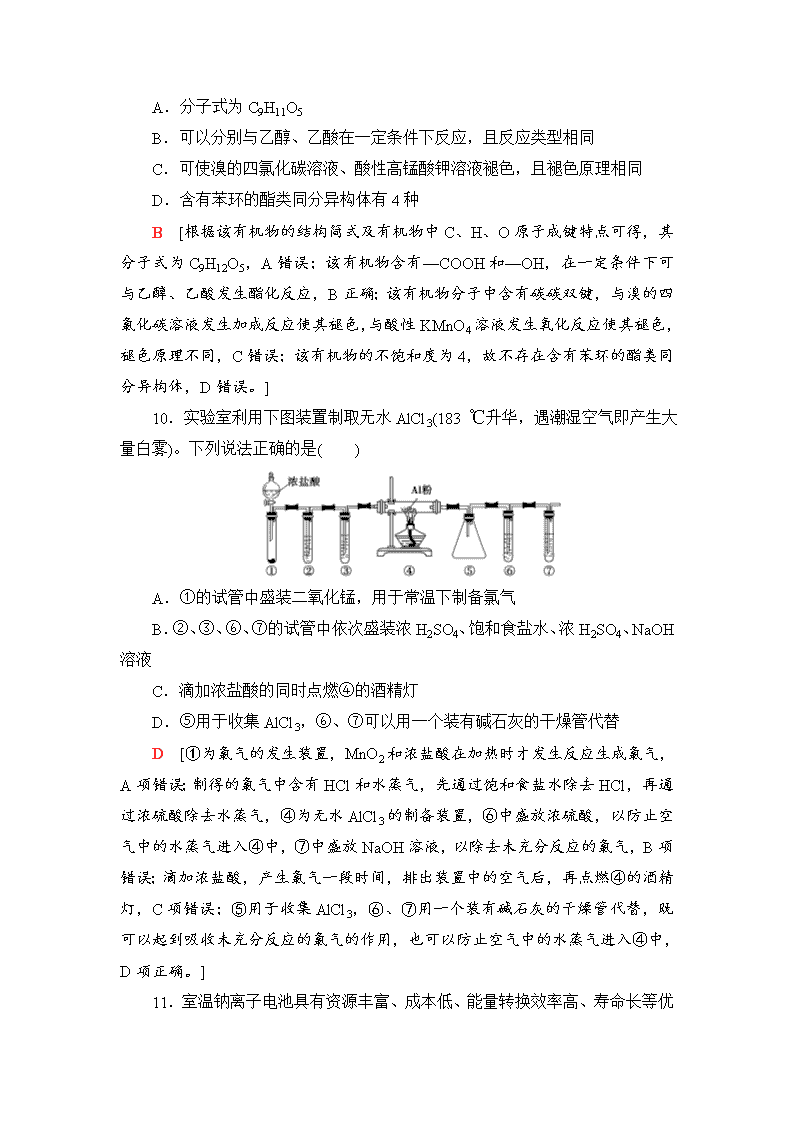
小题仿真标准练(六) (分值:42分,建议用时:15分钟) 选择题:本题7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与生活、生产、环境密不可分,下列说法正确的是( ) A.工程兵开山使用的炸药“TNT”是有机高分子化合物 B.PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 C.氯化铵溶液能除铁锈是利用了氯化铵的水解 D.纤维素能在人体中水解,转化成葡萄糖 C [选项A,TNT是三硝基甲苯,不是高分子化合物,错误;选项B,颗粒物直径大于10-7m,不能形成胶体,错误;选项C,氯化铵水解显酸性,与铁锈反应,可除铁锈,正确;选项D,纤维素不能在人体中水解,错误。] 8.设NA代表阿伏加德罗常数的值。下列说法中正确的是( ) A.常温常压下,18 g重水(D2O)中所含的中子数为10NA B.100 ℃时,1 L pH=1的硫酸溶液中,含有0.2NA个H+ C.71 g氯气发生氧化还原反应,一定失去2NA个电子 D.室温下,14 g N2和CO的混合气体中含有的原子数目为NA D [常温常压下,18 g重水(D2O)中所含中子物质的量为×10=9 mol,中子数为9NA,A项错误;1 L pH=1的硫酸溶液中,含有0.1NA个H+,B项错误;氯气发生氧化还原反应,不一定失去2NA个电子,例如与氢氧化钠溶液反应失去1 mol电子,C项错误;N2和CO均是双原子分子,相对分子质量均是28,因此室温下,14 g N2和CO的混合气体中含有的原子数目为NA,D项正确。] 9.某有机物的结构简式如图。下列关于该有机物的叙述正确的是( ) A.分子式为C9H11O5 B.可以分别与乙醇、乙酸在一定条件下反应,且反应类型相同 C.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同 D.含有苯环的酯类同分异构体有4种 B [根据该有机物的结构简式及有机物中C、H、O原子成键特点可得,其分子式为C9H12O5,A错误;该有机物含有—COOH和—OH,在一定条件下可与乙醇、乙酸发生酯化反应,B正确;该有机物分子中含有碳碳双键,与溴的四氯化碳溶液发生加成反应使其褪色,与酸性KMnO4溶液发生氧化反应使其褪色,褪色原理不同,C错误;该有机物的不饱和度为4,故不存在含有苯环的酯类同分异构体,D错误。] 10.实验室利用下图装置制取无水AlCl3(183 ℃升华,遇潮湿空气即产生大量白雾)。下列说法正确的是( ) A.①的试管中盛装二氧化锰,用于常温下制备氯气 B.②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液 C.滴加浓盐酸的同时点燃④的酒精灯 D.⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替 D [①为氯气的发生装置,MnO2和浓盐酸在加热时才发生反应生成氯气,A项错误;制得的氯气中含有HCl和水蒸气,先通过饱和食盐水除去HCl,再通过浓硫酸除去水蒸气,④为无水AlCl3的制备装置,⑥中盛放浓硫酸,以防止空气中的水蒸气进入④中,⑦中盛放NaOH溶液,以除去未充分反应的氯气,B项错误;滴加浓盐酸,产生氯气一段时间,排出装置中的空气后,再点燃④的酒精灯,C项错误;⑤用于收集AlCl3,⑥、⑦用一个装有碱石灰的干燥管代替,既可以起到吸收未充分反应的氯气的作用,也可以防止空气中的水蒸气进入④中,D项正确。] 11 .室温钠离子电池具有资源丰富、成本低、能量转换效率高、寿命长等优势,一种用碳基材料(NaxCn)作负极的可充电钠离子电池的反应原理如下:NaCoO2+CnNa1-xCoO2+NaxCn,其电池结构如图所示。下列说法中不正确的是( ) A.放电时,Na+向正极移动 B.放电时,负极的电极反应式为NaxCn-xe-===xNa++Cn C.充电时,阴极质量减小 D.充电时,阳极的电极反应式为NaCoO2-xe-===Na1-xCoO2+xNa+ C [原电池放电时,电解质溶液中的阳离子向正极移动,A选项正确;放电时,负极反应为碳基材料中的金属钠失电子的反应,B选项正确;充电时,阴极发生还原反应:xNa++xe-+Cn===NaxCn,阴极质量增加,C选项错误;充电时,阳极上NaCoO2失电子生成Na1-xCoO2和Na+,D选项正确。] 12.A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊均是由其中的两种或三种元素组成的常见化合物,庚是由其中的一种元素形成的单质,甲为淡黄色固体,已知:甲+乙===丁+庚,甲+丙===戊+庚;常温下0.1 mol·L-1丁溶液的pH为13,则下列说法不正确的是( ) A.元素C分别可以与元素A、B、D形成多种化合物 B.元素B、C、D的原子半径由大到小的顺序为r(D)>r(B)>r(C) C.1.0 L 0.1 mol·L-1戊溶液中含阴离子总的物质的量小于0.1 mol D.甲与戊都为离子化合物,其晶体中阳离子数与阴离子数之比相同 C [由丁的溶液可知丁为氢氧化钠,甲为过氧化钠,则可猜测单质庚为O2,由此推断乙为水,丙为二氧化碳,则A、B、C、D分别为H、C、O、Na。A项,氢、碳、钠和氧会形成多种化合物,如:H2O、H2O2,CO、CO2,Na2O、Na2O2等,故A项正确,B项,原子半径比较,先看周期数再看原子序数,故B项正确;C项,由于碳酸根离子会水解成碳酸氢根离子和氢氧根离子,故含0.1 mol Na2CO3的水溶液中阴离子的物质的量大于0.1 mol,C项错误;D 项,过氧化钠和碳酸钠中阳离子数和阴离子数之比都为2∶1,故D项正确。] 13.常温下,用0.100 0 mol·L-1的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是( ) A.a点溶液呈碱性的原因用离子方程式表示为CO+2H2O??H2CO3+2OH- B.c点处的溶液中:c(Na+)-c(Cl-)=c(HCO)+2c(CO) C.滴定过程中使用甲基橙作为指示剂比酚酞更准确 D.d点处溶液中水电离出的c(H+)大于b点处 B [a点溶液为Na2CO3溶液,由于CO水解,溶液呈碱性:CO+H2O??HCO+OH-、HCO+H2O??H2CO3+OH-,注意CO分步水解,A项错误;用酚酞作指示剂时滴定的总反应为Na2CO3+HCl===NaHCO3+NaCl,用甲基橙作指示剂时滴定的总反应为Na2CO3+2HCl===2NaCl+CO2↑+H2O,故两种指示剂准确度相同,C项错误;d点处是NaCl和碳酸的混合溶液,溶液呈酸性,水的电离受到抑制,b点处是NaHCO3和NaCl的混合溶液,由于HCO水解而呈碱性,水的电离得到促进,故d点处溶液中水电离出的c(H+)小于b点处,D项错误。]查看更多