四川省宜宾市南溪二中2019-2020学年高二上学期第一次月考化学试卷
化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,全卷共6页。满分100分,考试时间90分钟。
所有题目答案完成在答题卡上,考试结束后,交回答题卡。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Si 28 Fe 56 Cu 64
第Ⅰ卷(选择题 共40分)
一、本卷共20个小题,每题2分,共40分,每小题只有一个选项符合题意。
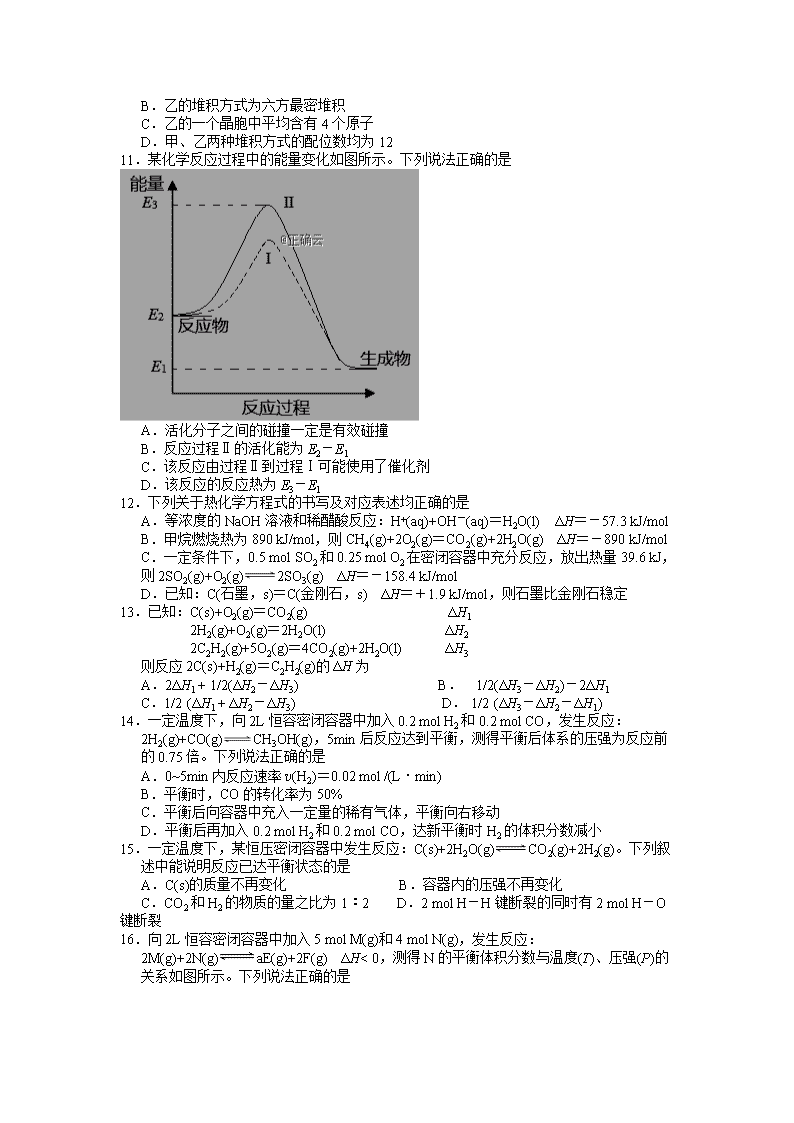
1.基态钾原子的核外电子占据最高能级的符号是
A.3s B.3d C.3p D.4s
2.下列说法正确的是
A.碳原子的电子排布图为 B.电子云表示电子在原子核外运动的轨迹
C.周期表中s区元素都是金属元素 D.Fe2+的最外层电子排布式为3s23p63d6
3.下列关于电离能的说法正确的是
A.Si原子的逐级电离能逐渐增大 B.Na、Mg、Al的第一电离能逐渐增大
C.同周期中卤族元素的第一电离能最大 D.同主族中金属性越强的元素第一电离能越大
4. 已知X、Y为同周期主族元素,且电负性X>Y,下列说法正确的是
A. 原子序数:X
CaO>KCl
B.KCl晶体中K+的配位数为8
C.MgO晶体中一个Mg2+周围和它最近且等距离的Mg2+有12个
D.CaO晶体中与每个Ca2+最近且等距离的O2-构成的空间构型为正八面体
10.甲、乙两种金属晶体的堆积方式如下图所示。下列说法正确的是
A.甲可为Cu或Ag
B.乙的堆积方式为六方最密堆积
C.乙的一个晶胞中平均含有4个原子
D.甲、乙两种堆积方式的配位数均为12
11.某化学反应过程中的能量变化如图所示。下列说法正确的是
A.活化分子之间的碰撞一定是有效碰撞
B.反应过程Ⅱ的活化能为E2-E1
C.该反应由过程Ⅱ到过程Ⅰ可能使用了催化剂
D.该反应的反应热为E3-E1
12.下列关于热化学方程式的书写及对应表述均正确的是
A.等浓度的NaOH溶液和稀醋酸反应:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
B.甲烷燃烧热为890 kJ/mol,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890 kJ/mol
C.一定条件下,0.5 mol SO2和0.25 mol O2在密闭容器中充分反应,放出热量39.6 kJ,则2SO2(g)+O2(g)2SO3(g) ΔH=-158.4 kJ/mol
D.已知:C(石墨,s)=C(金刚石,s) ΔH=+1.9 kJ/mol,则石墨比金刚石稳定
13.已知:C(s)+O2(g)=CO2(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3
则反应2C(s)+H2(g)=C2H2(g)的ΔH为
A.2ΔH1 + 1/2(ΔH2-ΔH3) B. 1/2(ΔH3-ΔH2)-2ΔH1
C.1/2 (ΔH1 + ΔH2-ΔH3) D. 1/2 (ΔH3-ΔH2-ΔH1)
14.一定温度下,向2L恒容密闭容器中加入0.2 mol H2和0.2 mol CO,发生反应:
2H2(g)+CO(g)CH3OH(g),5min后反应达到平衡,测得平衡后体系的压强为反应前的0.75倍。下列说法正确的是
A.0~5min内反应速率v(H2)=0.02 mol /(L·min)
B.平衡时,CO的转化率为50%
C.平衡后向容器中充入一定量的稀有气体,平衡向右移动
D.平衡后再加入0.2 mol H2和0.2 mol CO,达新平衡时H2的体积分数减小
15.一定温度下,某恒压密闭容器中发生反应:C(s)+2H2O(g)CO2(g)+2H2(g)。下列叙述中能说明反应已达平衡状态的是
A.C(s)的质量不再变化 B.容器内的压强不再变化
C.CO2和H2的物质的量之比为1︰2 D.2 mol H-H键断裂的同时有2 mol H-O键断裂
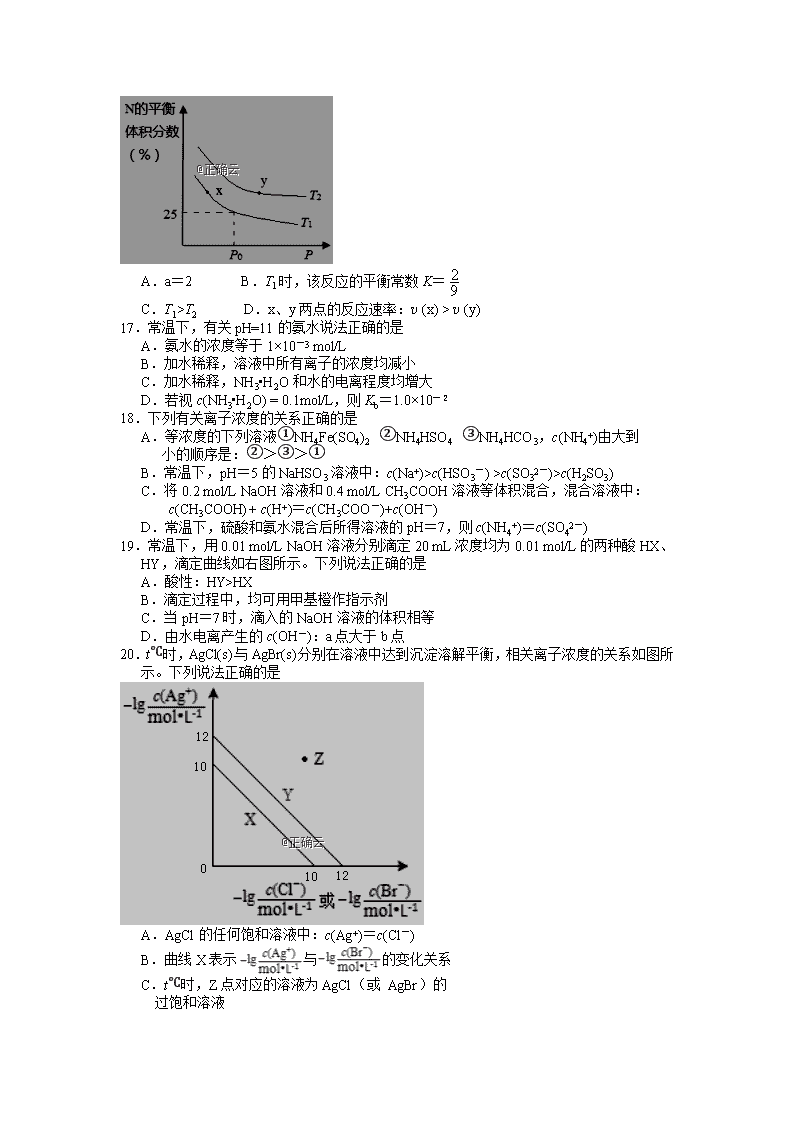
16.向2L恒容密闭容器中加入5 mol M(g)和4 mol N(g),发生反应:2M(g)+2N(g)aE(g)+2F(g) ΔH< 0,测得N的平衡体积分数与温度(T)、压强(P)的关系如图所示。下列说法正确的是
A.a=2 B.T1时,该反应的平衡常数K=
C.T1>T2 D.x、y两点的反应速率:v (x) > v (y)
17.常温下,有关pH=11的氨水说法正确的是
A.氨水的浓度等于1×10-3 mol/L
B.加水稀释,溶液中所有离子的浓度均减小
C.加水稀释,NH3•H2O和水的电离程度均增大
D.若视c(NH3•H2O) = 0.1mol/L,则Kb=1.0×10-2
18.下列有关离子浓度的关系正确的是
A.等浓度的下列溶液①NH4Fe(SO4)2 ②NH4HSO4 ③NH4HCO3,c(NH4+)由大到
小的顺序是:②>③>①
B.常温下,pH=5的NaHSO3溶液中:c(Na+)>c(HSO3-) >c(SO32-)>c(H2SO3)
C.将0.2 mol/L NaOH溶液和0.4 mol/L CH3COOH溶液等体积混合,混合溶液中:
c(CH3COOH)+ c(H+)=c(CH3COO-)+c(OH-)
D.常温下,硫酸和氨水混合后所得溶液的pH=7,则c(NH4+)=c(SO42-)
19.常温下,用0.01 mol/L NaOH溶液分别滴定20 mL浓度均为0.01 mol/L的两种酸HX、HY,滴定曲线如右图所示。下列说法正确的是
A.酸性:HY>HX
B.滴定过程中,均可用甲基橙作指示剂
C.当pH=7时,滴入的NaOH溶液的体积相等
D.由水电离产生的c(OH-):a点大于b点
20.t℃时,AgCl(s)与AgBr(s)分别在溶液中达到沉淀溶解平衡,相关离子浓度的关系如图所示。下列说法正确的是
A.AgCl的任何饱和溶液中:c(Ag+)=c(Cl-)
B.曲线X表示与的变化关系
C.t℃时,Z点对应的溶液为AgCl(或 AgBr)的
过饱和溶液
D. t℃时,AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)的
平衡常数K=100
第Ⅱ卷(非选择题 共60分)
本卷包括5个小题,共60分。
21.(15分)
铜及其化合物在科学研究和工业生产中都有重要的用途。请回答下列问题:
(1)基态Cu原子有_______个未成对电子,Cu2+的电子排布式为_______。
(2)Cu可作催化剂,乙醇(CH3CH2OH)在Cu催化作用下氧化得乙醛(CH3CHO),乙醛分子中C原子的杂化方式为_______,乙醛分子的O—C—H键角_______(填“>”或“<”)乙醇分子的O—C—H。
(3)CuSO4常用来配制电解液和农药。
①SO42﹣的立体构型为_______。
②CuSO4溶液还可与乙二胺(H2N—CH2—CH2—NH2)形成配离子(如下图所示)。
该配离子中提供孤电子对的原子是_______。配合物中C、N、O三种元素第一电离能从大到小的顺序是_______。
(4)Cu3N晶胞结构如右图所示,N3-的配位数为_______。若晶胞参数为a pm,阿伏加德罗常数值为NA,则该晶体的密度为_______g/cm3。(用含a、NA的式子表示)。
22.(10分)
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。部分化学键的键能如下表:
化学键
N-N
O=O
N≡N
N-H
键能(kJ/mol)
193
497
946
a
(1)N2和O2中,较稳定的是______,N2H4的电子式是_______。
(2)在一定条件下可用NH3与NaClO反应制取肼,该反应的化学方程式是_______,生成1 mol N2H4时转移电子的物质的量是_______。
(3)肼是一种高能燃料,其燃烧反应的能量变化如图所示。
①上表中,a = _______。
②已知:H2O(g)=H2O(l) ΔH=-44 kJ/mol,则N2H4(g)在氧气中燃烧生成N2(g)和H2O(l)时的热化学方程式是_______。
23.(13分)
含碳化合物可合成一系列重要的化工原料。以CO2和NH3为原料合成CO(NH2)2的反应为:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g) ΔH=-86.98 kJ/mol。
(1)上述反应分I、II两步进行:
反应I:2NH3(g)+CO2(g)NH2COONH4(s) ΔH=-159.47 kJ/mol
反应II:NH2COONH4(s)CO(NH2)2(s)+H2O(g) ΔH
反应I的ΔS_______0(填“>”、“<”或“=”),反应II一般在_______(填“高温”或“低温”)条件下有利于该反应的进行。
(2)在体积为1 L的恒容密闭容器中模拟以CO2和NH3为原料合成CO(NH2)2,其中CO2转化率随不同氨碳比[]和温度的变化曲线如右图所示。
①图中x_______4(填“>”、“<”或“=”)。
②190℃时,向该容器中加入4 mol NH3和1 mol CO2,平衡时NH3的转化率为_______,反应的平衡常数K的值为_______。
③当温度高于190℃后,CO2转化率出现如图所示的变化趋势,其原因是_______。
④若起始温度相同,改为在绝热(与外界没有热量交换)容器中进行该反应,平衡常数K将_______(填“增大”、“减小”或“不变”)。
24.(10分)
以工业废渣(主要成分为MgCO3、MgSO4,含有少量FeO、Al2O3、SiO2的氧化物)为原料制备MgCO3•3H2O的流程如下:
(1)为加快酸溶速率,可将废渣研细,还可采取的办法是_______(任答一点),滤渣1的主要成分是_______。
(2)萃取时用到的主要玻璃仪器是_______。检验萃取分液后的水溶液中是否残留有Fe3+的方法是_______。
(3)已知:25℃时,Al(OH)3的溶度积(Ksp)为1.0×10-33;pH=9.6时,Mg2+开始沉淀。
流程中加入氨水除去Al3+(使其浓度小于1×10-6 mol/L),需调节溶液pH的范围为_______。
(4)操作1包括过滤、_______、低温干燥。已知MgCO3•3H2O受热时要转化为
Mg1+x(OH)2 (CO3) x,发生的化学反应方程式为_______。
25.(12分)
催化剂对化学反应有重要意义。
(1)某化学兴趣小组通过实验探究催化剂FeCl3对H2O2分解反应的影响。
实验
操作
现象
实验1
取2mL 5%的H2O2溶液于试管中,加入1 mL
0.1 mol/L FeCl3溶液,将带火星的木条置于试管口
试管中产生大量气泡,木条复燃
实验2
取2 mL 5%的H2O2溶液于试管中,加入1 mL某浓度的NaCl溶液,将带火星的木条置于试管口
未见明显气泡,木条不复燃
实验3
取2 mL 5%的H2O2溶液于试管中,加入1 mL pH=1的溶液A,将带火星的木条置于试管口
未见明显气泡,木条不复燃
①根据实验1提出假设:FeCl3溶液中起催化作用的离子可能是_______、Cl-或H+。
②实验2中,选用NaCl溶液的浓度应为_______ mol/L。实验2的目的是_______。
实验3中,溶液A应选用_______。
③根据上述实验现象,得出的结论是_______。
(2)查阅资料:CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也常用作H2O2分解的催化剂,且具有较高的活性。
①该催化剂中铁元素的化合价为_______。
②右图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解5%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:
_______法制得的催化剂活性更高,Co2+、Ni2+两种离子中催化效果更好的是_______。