- 2021-08-24 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年普通高等学校招生全国统一考试适应性考试(二)理综-化学试题
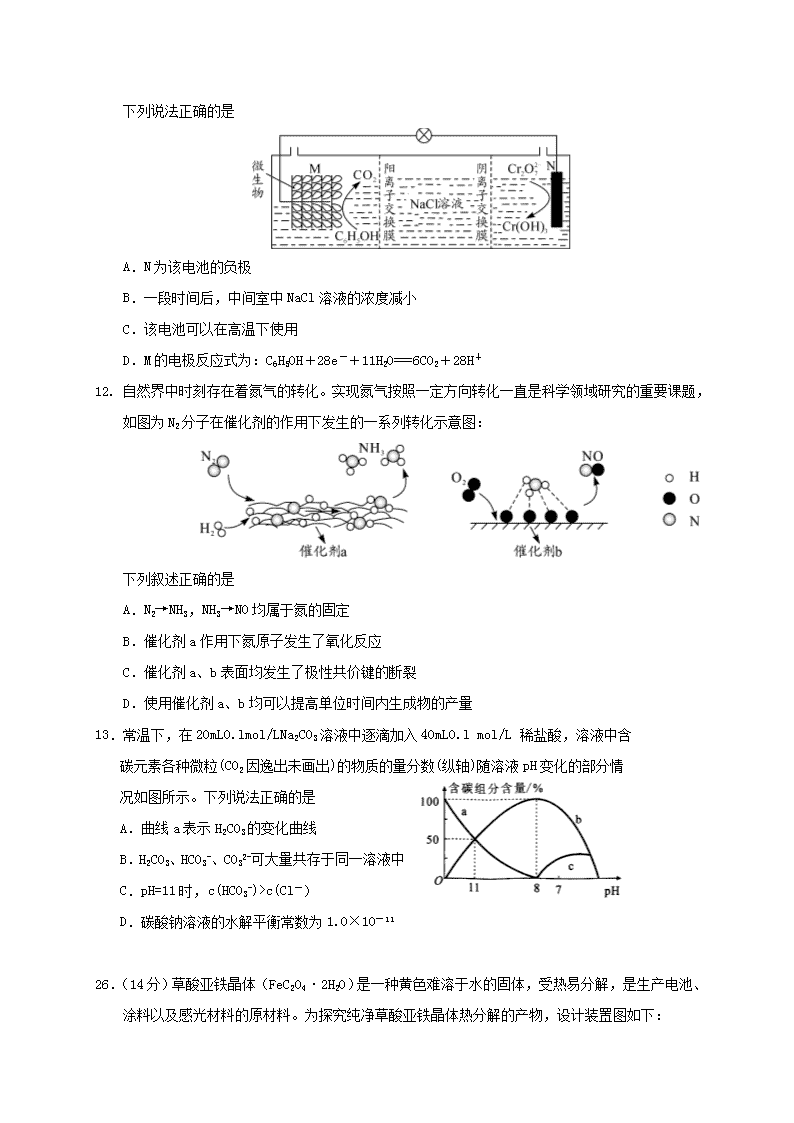
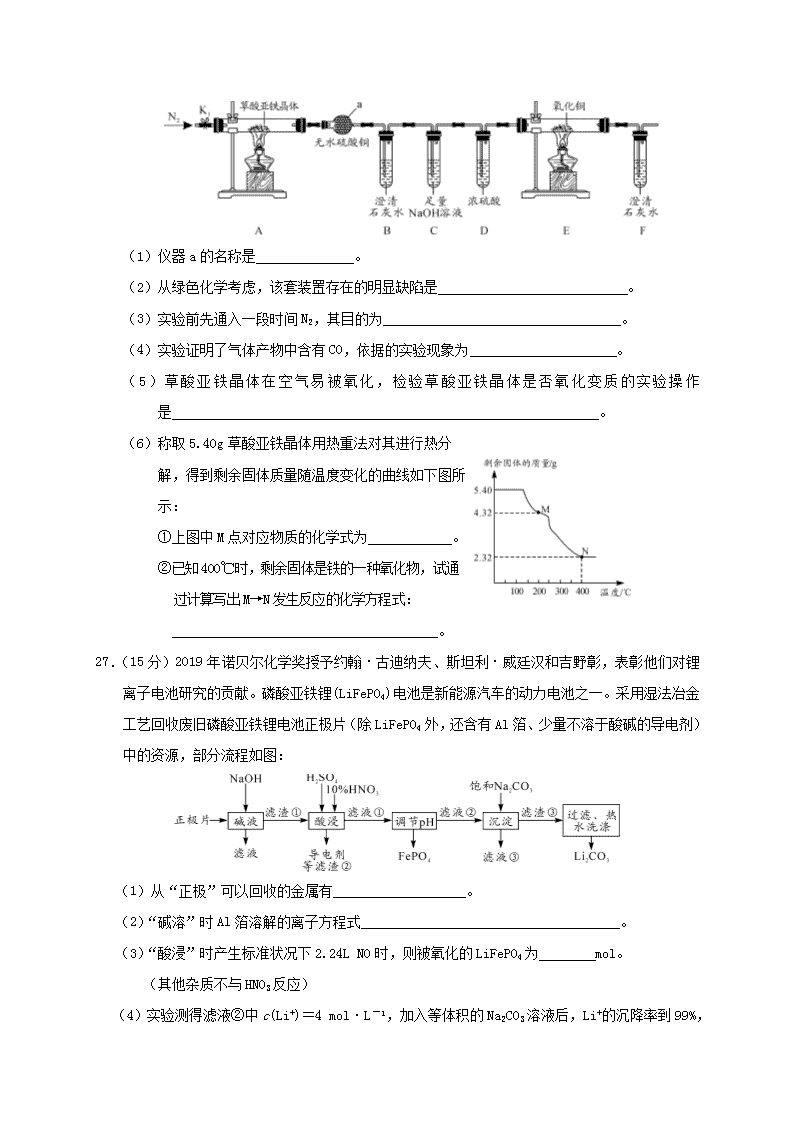
7.化学与生产、生活息息相关。下列有关说法不正确的是 A.墨子号量子卫星使用的太阳能电池,其主要成分为二氧化硅 A.小苏打可用于治疗胃酸过多 B.还原铁粉可用作食品袋内的抗氧化剂 D.用乙醚从青蒿中提取青蒿素的过程中包含萃取操作 8.激素类药物己烯雌酚的结构简式如图所示。下列叙述正确的是 A.己烯雌酚是芳香烃 B.1mol己烯雌酚可与6molH2发生加成反应 C.1mol己烯雌酚完全燃烧能生成18molCO2和12 molH2O D.己烯雌酚苯环上的一氯代物有两种(不包括立体异构) 9.W、X、Y、Z、R是原子序数依次增大的五种短周期元素,其中W、R同主族;X是形成化合物种类最多的元素;常温下,W与Z能形成两种常见的液态化合物。下列说法正确的是 A.X、Y的简单氢化物的沸点:X>Y B.Z、R的简单离子的半径大小:Z<R C.Y与W形成的最简单化合物可用作制冷剂 D.1mol R2Z2与足量W2Z反应,转移的电子数为2NA 10.为探究新制氯水的性质,某学生做了如下实验。 实验 装置 试剂a 现象 ① 紫色的石蕊试液 溶液先变红后褪色 ② NaHCO3溶液 产生气泡 ③ HNO3酸化的AgNO3溶液 产生白色沉淀 ④ FeCl2溶液、KSCN溶液 溶液变红 由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是 A.实验①说明新制氯水中含有H+、HClO B.实验②发生的反应为HCO3-+HClO===ClO-+CO2↑+H2O C.实验③说明新制氯水中有Cl-,Cl-+Ag+===AgCl↓ D.实验④说明氯气具有强氧化性,Cl2+2Fe2+===2Cl-+2Fe3+ 11.我国某科研机构研究表明,利用K2Cr2O7 可实现含苯酚废水的有效处理,其工作原理如下图所示。下列说法正确的是 A.N为该电池的负极 B.一段时间后,中间室中NaCl溶液的浓度减小 C.该电池可以在高温下使用 D.M的电极反应式为:C6H5OH+28e-+11H2O===6CO2+28H+ 12. 自然界中时刻存在着氮气的转化。实现氮气按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图: 下列叙述正确的是 A.N2→NH3,NH3→NO均属于氮的固定 B.催化剂a作用下氮原子发生了氧化反应 C.催化剂a、b表面均发生了极性共价键的断裂 D.使用催化剂a、b均可以提高单位时间内生成物的产量 13.常温下,在20mL0.lmol/LNa2CO3溶液中逐滴加入40mL0.l mol/L 稀盐酸,溶液中含 碳元素各种微粒(CO2因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情 况如图所示。下列说法正确的是 A.曲线a表示H2CO3的变化曲线 B.H2CO3、HCO3-、CO32-可大量共存于同一溶液中 C.pH=11时,c(HCO3-)>c(Cl-) D.碳酸钠溶液的水解平衡常数为1.0×10-11 26.(14分)草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下: (1)仪器a的名称是 。 (2)从绿色化学考虑,该套装置存在的明显缺陷是 。 (3)实验前先通入一段时间N2,其目的为 。 (4)实验证明了气体产物中含有CO,依据的实验现象为 。 (5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是 。 (6)称取5.40g草酸亚铁晶体用热重法对其进行热分 解,得到剩余固体质量随温度变化的曲线如下图所 示: ①上图中M点对应物质的化学式为 。 ②已知400℃时,剩余固体是铁的一种氧化物,试通 过计算写出M→N发生反应的化学方程式: 。 27.(15分)2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图: (1)从“正极”可以回收的金属有 。 (2)“碱溶”时Al箔溶解的离子方程式 。 (3)“酸浸”时产生标准状况下2.24L NO时,则被氧化的LiFePO4为 mol。 (其他杂质不与HNO3反应) (4)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99% ,则滤液③中c(CO32-)=_______ mol·L-1。 [Ksp(Li2CO3)=1.6×10-3] (5)磷酸亚铁锂电池总反应为:LiFePO4+6C Li1-xFePO4+LixC6,电池中的 固体电解质可传导Li+。充电时,Li+移向 (填“阳极”或“阴极”); 放电时,正极反应式为 。 (6)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.40g试样用盐酸溶解, 在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作 指示剂,用0.030 mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消 耗重铬酸钾溶液40.00mL。 已知:2Fe3++Sn2++6Cl-===SnCl62-+2Fe2+ 4Cl-+Sn2++2HgCl2===SnCl62-+Hg2Cl2 6Fe2++Cr2O72-+14H+===6Fe3++2Cr3++7H2O ① 实验中加入HgCl2饱和溶液的目的是 。 ② 磷酸亚铁锂电池中铁的含量为 。 28.(14分)SO2是空气中主要的大气污染物,国家规定在排放前必须经过处理。 Ⅰ.碱液吸收法:工业上常用NaOH溶液做吸收液。 (1)向0.5L1 mol·L-1的NaOH溶液中通入标准状态下11.2L的SO2。 ①写出反应的离子方程式 ; ②已知:Ka1=1.54×10-2,Ka2=1.02×10-7,则所得溶液呈 (填“酸 性”、“碱性”或“中性”),下列有关吸收液中粒子浓度大小关系正确的 是 。 A.c(H2SO3)>c(SO32-) B.c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) C.c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-) D.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) (2)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收SO2后所得溶液以 实现吸收液的回收再利用,装置如下图所示: ①工作一段时间后,阴极区溶液的pH (填“增大”、“减小”或“不变”)。 ②写出阳极的电极反应式 。 Ⅱ.SO2的回收利用: (3)SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g)+Cl2(g)SO2Cl2(g)。 按投料比1:1把SO2与Cl2充入一恒压的密闭容器中发生上述反应,SO2的转化 率与温度T的关系如下图所示: 化学参考答案及评分标准 一、 选择题(42分,每题6分) 题号 7 8 9 10 11 12 13 答案 A D C B B D C 二、非选择题(58分) 26.(14分) (1)球形干燥管(干燥管)(2分) (2)缺少处理CO尾气装置(2分) (3)排尽装置内空气,防止空气中H2O和CO2的干扰(2分) (4)E中黑色粉末变红色,F出现白色沉淀(2分) (5)取少量草酸亚铁晶体于试管中,加入稀硫酸溶解后并滴加KSCN溶液,若溶液变红色,则草酸亚铁晶体已氧化变质;若不变红色,则草酸亚铁晶体未氧化变质 (2分,若未加非氧化性酸溶解不给分) (6)①FeC2O4(2分) ②3FeC2O4 Fe3O4+2CO2↑+4CO↑(2分) 27.(15分) (1)Li、Fe、Al(2分)(答对3个给2分,2个给1分,1个不给分) (2)2Al+2OH-+2H2O===2AlO2-+3H2↑(2分) (3)0.3(2分) (4)4(2分) (5)阴极(1分) Li1-xFePO4+xLi++xe-===LiFePO4(2分) (6)①将溶液中过量Sn2+转化为稳定的SnCl62-,防止其干扰Fe2+的测定(2分) ②28.8%(2分) 28. (14分) (1)①OH-+SO2===HSO3-(2分) ②酸性(2分) BC(2分) (2)①增大(2分) ②HSO3--2e-+2H2O===3H++SO42-(2分) (3)①<(2分) ②3/p(2分) 35. (15分) (1)4s24p4(1分) 分子(1分) (2)SiH4 (1分) >(1分) (3)3(2分) (4)配位(1分) sp3(1分) H3O+(2分) (5)12(2分) (3分) 36. (15分) (1)C6H11Br(2分) (2)醛基、羰基(酮基)(2分) (3)消去反应(1分) 氧化反应(1分) (4)(2分) (5)12(2分) 或 (2分) (6)(3分)查看更多