- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高考考前45天大冲刺卷理综化学部分十二(全国1卷)
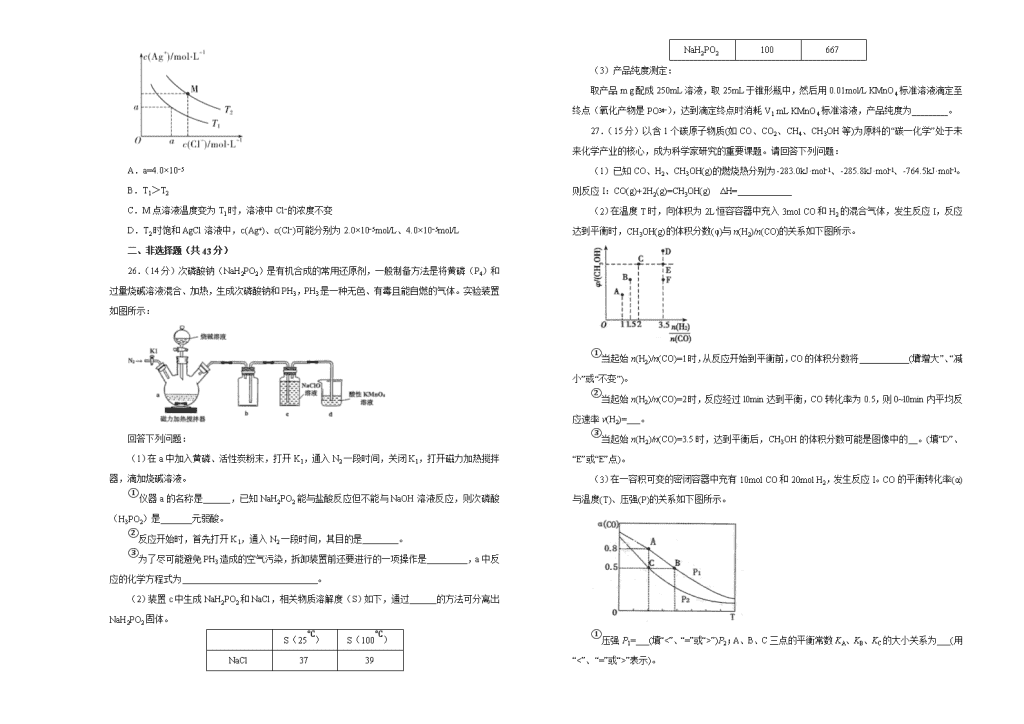
2020年高考考前45天大冲刺卷 理综综合(化学部分)(十二) 注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。 2.考试结束后,请将本试题卷和答题卡一并上交。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 一、选择题(每题6分,共42分。) 7.2019年9月25日,北京大兴国际机场正式投入运营。在这一形似“凤凰展翅”的宏伟建筑中,使用了大量种类各异的材料。下列关于所使用材料的分类不正确的是 选项 A B C D 材料 含钒钢筋 安检塑料筐 有机玻璃标牌 玻璃钢内筒垃圾桶 分类 合金材料 高分子材料 无机硅酸盐材料 复合材料 8.设NA表示阿伏加德罗常数的数值,下列叙述正确的是 A.将1mol NH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH的数目为NA B.1.7g H2O2中含有的电子数为0.7NA C.标准状况下,2.24L戊烷所含分子数为0.1NA D.1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去2NA个电子 9.我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。 下列说法不正确的是 A.异戊二烯所有碳原子可能共平面 B.可用溴水鉴别M和对二甲苯 C.对二甲苯的一氯代物有2种 D.M的某种同分异构体含有苯环且能与钠反应放出氢气 10.下列离子方程式正确且符合题意的是 A.向Ba(NO3)2溶液中通入SO2,产生白色沉淀,发生的离子反应为Ba2++SO2+H2O=BaSO3↓+2H+ B.向K3[Fe(CN)6]溶液中加入少量铁粉,产生蓝色沉淀,发生的离子反应为Fe+2[Fe(CN)6]3−=Fe2++ 2[Fe(CN)6]4−,3Fe2++2[Fe(CN)6]3−=Fe3[Fe(CN)6]2↓ C.向酸化的KMnO4溶液中加入少量Na2S,再滴加BaCl2溶液,产生白色沉淀,证明一定发生离子反应:8MnO+5S2−+24H+=8Mn2++5SO+12H2O D.向FeI2溶液中滴加少量氯水,溶液变黄色:2Fe2++Cl2=2Fe3++2Cl− 11.主族元素Q、X、Y、Z、W的原子序数依次增大,且均不大于20,X与Y相邻,Y、W的最外层电子数之和等于Z的族序数,Z的最高正价和最低负价代数和为4,化合物Y2Q4可作为火箭推进剂,普遍用在卫星和导弹的姿态控制上。下列说法错误的是 A.X和Z的单质均存在多种同素异形体 B.Q、Y和Z三种元素只能形成共价化合物 C.Q和W形成的化合物的水溶液呈碱性 D.WZXY溶液常用于Fe3+的检验 12.一种微生物燃料电池如图所示,下列关于该电池的说法正确的是 A.a电极发生还原反应 B.H+由右室通过质子交换膜进入左室 C.b电极反应式为2NO+10e−+12H+=N2↑+6H2O D.电池工作时,电流由a电极沿导线流向b电极 13.己知AgCl在水中的溶解是吸热过程。不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示。己知T1温度下Ksp(AgCl)=1.6×10−9,下列说法正确的是 A.a=4.0×10−5 B.T1>T2 C.M点溶液温度变为T1时,溶液中Cl−的浓度不变 D.T2时饱和AgCl溶液中,c(Ag+)、c(Cl−)可能分别为2.0×10−5mol/L、4.0×10−5mol/L 二、非选择题(共43分) 26.(14分)次磷酸钠(NaH2PO2)是有机合成的常用还原剂,一般制备方法是将黄磷(P4)和过量烧碱溶液混合、加热,生成次磷酸钠和PH3,PH3是一种无色、有毒且能自燃的气体。实验装置如图所示: 回答下列问题: (1)在a中加入黄磷、活性炭粉末,打开K1,通入N2一段时间,关闭K1,打开磁力加热搅拌器,滴加烧碱溶液。 ①仪器a的名称是______,已知NaH2PO2能与盐酸反应但不能与NaOH溶液反应,则次磷酸(H3PO2)是_______元弱酸。 ②反应开始时,首先打开K1,通入N2一段时间,其目的是________。 ③为了尽可能避免PH3造成的空气污染,拆卸装置前还要进行的一项操作是_________,a中反应的化学方程式为 。 (2)装置c中生成NaH2PO2和NaCl,相关物质溶解度(S)如下,通过______的方法可分离出NaH2PO2固体。 S(25℃) S(100℃) NaCl 37 39 NaH2PO2 100 667 (3)产品纯度测定: 取产品m g配成250mL溶液,取25mL于锥形瓶中,然后用0.01mol/L KMnO4标准溶液滴定至终点(氧化产物是PO),达到滴定终点时消耗V1 mL KMnO4标准溶液,产品纯度为________。 27.(15分)以含1个碳原子物质(如CO、CO2、CH4、CH3OH等)为原料的“碳一化学”处于未来化学产业的核心,成为科学家研究的重要课题。请回答下列问题: (1)已知CO、H2、CH3OH(g)的燃烧热分别为-283.0kJ·mol−1、-285.8kJ·mol−l、-764.5kJ·mol−l。则反应I:CO(g)+2H2(g)=CH3OH(g) ΔH= (2)在温度T时,向体积为2L恒容容器中充入3mol CO和H2的混合气体,发生反应I,反应达到平衡时,CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。 ①当起始n(H2)/n(CO)=1时,从反应开始到平衡前,CO的体积分数将___________(填“增大”、“减小”或“不变”)。 ②当起始n(H2)/n(CO)=2时,反应经过l0min达到平衡,CO转化率为0.5,则0~l0min内平均反应速率v(H2)=___。 ③当起始n(H2)/n(CO)=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的__。(填“D”、“E”或“E”点)。 (3)在一容积可变的密闭容器中充有10mol CO和20mol H2,发生反应I。CO的平衡转化率(α)与温度(T)、压强(P)的关系如下图所示。 ①压强P1=___(填“<”、“=”或“>”)P2;A、B、C三点的平衡常数KA、KB、KC的大小关系为___(用“<”、“=”或“>”表示)。 ②若达到平衡状态C时,容器体积为10L,则在平衡状态A时容器体积为____L。 28.(14分)三氯化铁在印刷、医药、颜料、污水处理以及有机合成催化剂方面有重要的应用。工业上常以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料制备氯化铁。其生产流程如图: 已知:氢氧化物的Ksp如下表: 氢氧化物 Fe(OH)3 Fe(OH)2 Al(OH)3 Mg(OH)2 Ksp 1.0×10−36 1.6×10−14 2.0×10−33 1.2×10−11 请回答下列问题: (1)物质X可以选用下列物质中的____(选填序号) A.NaCl B.FeCl3 C.H2O2 D.H2SO4 (2)滤液Ⅰ加入NaOH固体的目的是调节溶液的pH(忽略加入NaOH固体以后溶液体积的变化)。已知滤液Ⅰ中c(Fe3+)为1.0mol·L−1,c(Al3+)为0.03mol·L−1,c(Mg2+)为0.01mol·L−1,当Fe3+恰好沉淀完全时[c(Fe3+)=1×10−5mol·L−1],Al3+是否已经开始沉淀______(填“是”或“否”)。 (3)写出滤渣1加NaOH溶液发生反应的离子方程式_____________________。 (4)生产流程中最后“从FeCl3溶液得到无水FeCl3固体”的操作分为两步:第一步,先冷却结晶得到FeCl3·6H2O晶体;第二步,制无水FeCl3固体。第二步的正确操作是_____。 (5)FeCl3具有净水作用,但易腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。 ①FeCl3净水的原理是____________________(用离子方程式表示) ②通过控制条件生成聚合氯化铁,离子方程式为xFe3++yH2OFex(OH)y(3x-y)++yH+,欲增加聚合氯化铁的产率可采取的方法是_____(填字母)。 a.降温 b.加氨水 c.加入NH4Cl d.加入NaHCO3 三、选考题(共15分,请考生从以下题中任选一题作答,如果多做,则按所做的第一题计分。) 35.【化学——选修3:物质结构与性质】(15分) 有原子序数依次增大的A、B、C、D、E五种前四周期元素,B元素原子有三个能级,且每个能级上的电子数相等;C原子的p轨道处于半充满状态,D的单质是空气的主要成分之一,其质子数为A与C之和;E在周期表中位于ds区,且与D可形成化学式为E2D或ED的二元化合物。请回答下列问题: (1)E元素基态原子的M能层中具有_____个能级,该元素的常见化合价有多种,其中E+的简化电子排布式为__________。 A.[Ar]3d104s1 B.[Ar]3d10 C.[Ar]3d94s1 D.[Ar]3d84s2 (2)元素C和D的原子的第一电离能较大的为__________(填元素符号),其原因是____________________;C与A可形成一种常见的气态化合物,该化合物的空间构型为____________________,其中C原子的杂化轨道类型为____________________。 (3)C2在日常生活及工农业生产等领域用途非常广泛,其分子结构中σ键和π键数目之比是_______;C2D与BD2互为__________(填“等电子体”或“非等电子体”),其理由是____________________。 (4)在E催化下,分子式为BA4D的化合物可被氧化为分子式为BA2D的化合物,则BA2D分子中键角约为__________;BA4D和BA2D两化合物均易溶于水,是由于与水分子间形成了__________键的缘故。 (5)元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为__________;元素B的单质晶体结构有多种,其中一种硬度很大,结构如下图,则该单质晶体的熔点_______E单质晶体的熔点(填“高于”或“低于”);若B单质的原子(如图中A、B两原子)在体对角线上外切,晶胞参数为a,则该晶体的空间利用率约为__________。(百分数表示,取两位有效数字)(已知=1.732) 36. 【化学——选修5:有机化学基础】(15分) 乙苯是重要的化工原料,利用乙苯为初始原料合成高分子化合物J的流程如图所示(部分产物及反应条件已略去): 已知:①R1CHO+R2CH2CHO+H2O ② 请回答下列问题: (1)物质B的名称为 ;F的结构简式为 ; (2)②、③的反应类型分别为 、 ; (3)物质H中官能团的名称是 ; (4)反应④的化学方程式为 ; (5)与G互为同分异构体,符合下列条件的芳香族化合物共有____种; ⅰ.遇FeCl3显紫色 ⅱ.含碳碳叁键 (6)参照上述合成路线和信息,设计、乙醛、苯甲醇为原料合成的路线(无机试剂任选)____。 参考答案 7. 【答案】C 8. 【答案】A 9. 【答案】D 10. 【答案】B 11. 【答案】B 12. 【答案】C 13. 【答案】A 26. 【答案】(1)三颈烧瓶 一 排尽装置中的空气,防止反应生成的PH3自燃引起爆炸 打开K1,继续通入一段时间N2 P4+3NaOH+3H2O3NaH2PO2+PH3↑ (2) 蒸发浓缩、冷却结晶 (3) (1.1V1/m)% 27. 【答案】(1)-90.1kJ/mol (2)不变 0.05mol·L−1·min−1 F (3)> KA=KC>KB 2 28. 【答案】(1)C (2) 是 (3) Al(OH)3+OH−=AlO+2H2O (4) 在HCl气流中加热 (5) Fe3++3H2O3Fe(OH)3+3H+ b、d 35. 【答案】(1)3 B (2) N N原子的2p轨道为半充满的稳定结构,较难失电子,故其第一电离能较大 三角锥形 sp3杂化 (3) 1∶2 等电子体 二者的价电子总数和原子总数相等 (4) 120° 氢 (5) 2∶1 高于 34% 36. 【答案】(1)苯乙烯 HCHO (2) 加成反应 取代反应(或水解反应) (3) 醛基、碳碳双键 (4) 2+O22+2H2O (5) 16 (6)查看更多