- 2021-08-24 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习“7+1”小卷练6(全国通用)
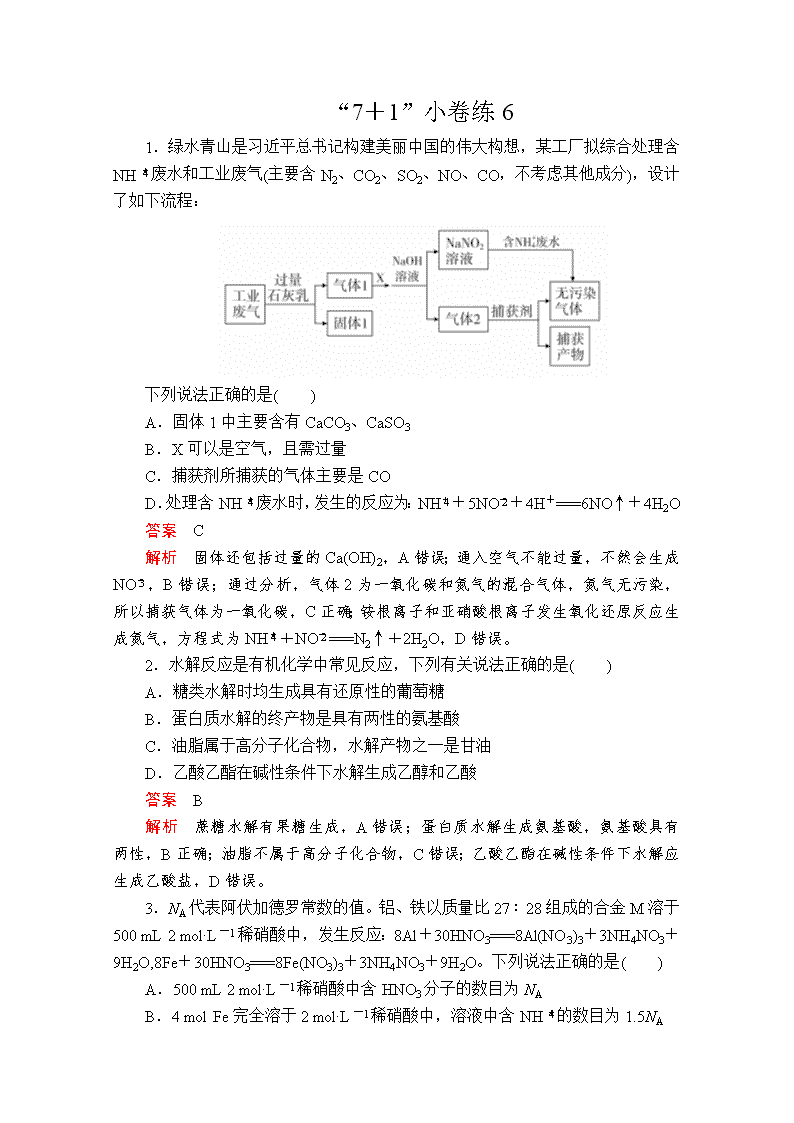
“7+1”小卷练6 1.绿水青山是习近平总书记构建美丽中国的伟大构想,某工厂拟综合处理含NH废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程: 下列说法正确的是( ) A.固体1中主要含有CaCO3、CaSO3 B.X可以是空气,且需过量 C.捕获剂所捕获的气体主要是CO D.处理含NH废水时,发生的反应为:NH+5NO+4H+===6NO↑+4H2O 答案 C 解析 固体还包括过量的Ca(OH)2,A错误;通入空气不能过量,不然会生成NO,B错误;通过分析,气体2为一氧化碳和氮气的混合气体,氮气无污染,所以捕获气体为一氧化碳,C正确;铵根离子和亚硝酸根离子发生氧化还原反应生成氮气,方程式为NH+NO===N2↑+2H2O,D错误。 2.水解反应是有机化学中常见反应,下列有关说法正确的是( ) A.糖类水解时均生成具有还原性的葡萄糖 B.蛋白质水解的终产物是具有两性的氨基酸 C.油脂属于高分子化合物,水解产物之一是甘油 D.乙酸乙酯在碱性条件下水解生成乙醇和乙酸 答案 B 解析 蔗糖水解有果糖生成,A错误;蛋白质水解生成氨基酸,氨基酸具有两性,B正确;油脂不属于高分子化合物,C错误;乙酸乙酯在碱性条件下水解应生成乙酸盐,D错误。 3.NA代表阿伏加德罗常数的值。铝、铁以质量比27∶28组成的合金M溶于500 mL 2 mol·L-1稀硝酸中,发生反应:8Al+30HNO3===8Al(NO3)3+3NH4NO3+9H2O,8Fe+30HNO3===8Fe(NO3)3+3NH4NO3+9H2O。下列说法正确的是( ) A.500 mL 2 mol·L-1稀硝酸中含HNO3分子的数目为NA B.4 mol Fe完全溶于2 mol·L-1稀硝酸中,溶液中含NH的数目为1.5NA C.若反应中有1 mol HNO3作氧化剂,则生成H2O的分子数为3NA D.5.5 g M完全溶于2 mol·L-1稀硝酸中,转移的电子数为0.6NA 答案 C 解析 选项A,HNO3是强电解质,在水中完全电离,稀硝酸中不存在HNO3分子,错误;选项B,铵根离子会发生水解,铵根离子的数目小于1.5NA,错误;选项C,观察反应的化学方程式知,3 mol HNO3作氧化剂时,生成9 mol 水,故1 mol HNO3作氧化剂时,生成H2O的分子数为3NA,正确;选项D,5.5 g M含2.7 g铝、2.8 g铁,即0.1 mol Al、0.05 mol Fe,完全反应时,共失去0.45 mol电子,故转移的电子数为0.45NA,错误。 4.实验室利用CuCl2·2H2O热分解制备CuCl(在空气中易被氧化)并对分解产物的性质进行探究的装置(夹持仪器略)如图所示。下列有关叙述不正确的是( ) A.干燥的HCl的作用是防止生成的CuCl被氧化,可用干燥的N2代替 B.干燥管中无水CuSO4的作用是检验生成物水蒸气 C.湿润蓝色石蕊试纸先变红后褪色,可用品红溶液代替 D.NaOH溶液的作用是吸收尾气,但该装置容易导致倒吸 答案 A 解析 干燥的HCl不仅可防止CuCl被氧化,还可抑制CuCl2·2H2O在脱水过程中发生水解,故不能用干燥的N2代替,A错误;CuCl2·2H2O受热分解生成水蒸气,白色的固体无水CuSO4遇水蒸气变为蓝色,B正确;湿润的蓝色石蕊试纸的作用是检验生成的Cl2,可用品红溶液代替,C正确;HCl极易溶解于NaOH溶液,玻璃管直接插入NaOH溶液中容易导致倒吸,D正确。 5.X、Y、Z、W、Q是原子序数依次增大的短周期元素,X与Q同主族,X的最外层电子数是次外层电子数的2倍,W的最外层电子数等于其电子层数,Y与Z的核外电子数之和等于X与Q的核外电子数之和,下列说法正确的是( ) A.Z、W、Q、X、Y原子半径依次减小 B.W的最高价氧化物对应的水化物一定能溶于Z的最高价氧化物对应的水化物中 C.Y与Q形成的化合物在常温下一定为气态 D.Z、Q元素的单质都可以将X元素的单质从其氧化物中置换出来 答案 A 解析 X、Y、Z、W、Q是原子序数依次增大的短周期元素,X与Q同主族,X的最外层电子数是次外层电子数的2倍,则X为C、Q为Si,W的最外层电子数等于其电子层数,则W为Al,Y与Z的核外电子数之和等于X与Q的核外电子数之和,若Y为O,则Z为Mg,若Y为F,则Z为Na。综上所述,原子半径按照Z、W、Q、X、Y顺序依次减小,A正确;若Z为Na,Al(OH)3能溶于氢氧化钠,若Z为Mg,Al(OH)3不能溶于氢氧化镁,B错误;若Y为O,则Y与Q形成的化合物为SiO2,SiO2常温下为固体,C错误;Si不能和碳的氧化物反应,不能从其氧化物中置换出碳,D错误。 6.已知25 ℃时有关弱酸的电离平衡常数: 弱酸化学式 H2A HB 电离平衡常数(25 ℃) Ka1=4.3×10-7 Ka2=5.6×10-11 4.9×10-10 下列有关说法不正确的是( ) A.若0.1 mol·L-1 NaHA溶液呈碱性,则HA-的电离能力小于其水解能力 B.a mol·L-1 HB溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(B-),则不一定满足apH(NaB)>pH(NaHA) 答案 C 解析 NaHA溶液中HA-存在电离平衡和水解平衡,若0.1 mol·L-1 NaHA溶液呈碱性,则HA-的水解能力大于其电离能力,故A正确;HB溶液与NaOH溶液等体积混合,若a=b,HB与NaOH恰好完全反应生成NaB,NaB是强碱弱酸盐,B-水解使溶液呈碱性,c(Na+)>c(B-),所以不一定满足a查看更多