- 2021-08-24 发布 |
- 37.5 KB |
- 22页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
吉林省双辽市第二中学2020届高三上学期期末考试化学试题
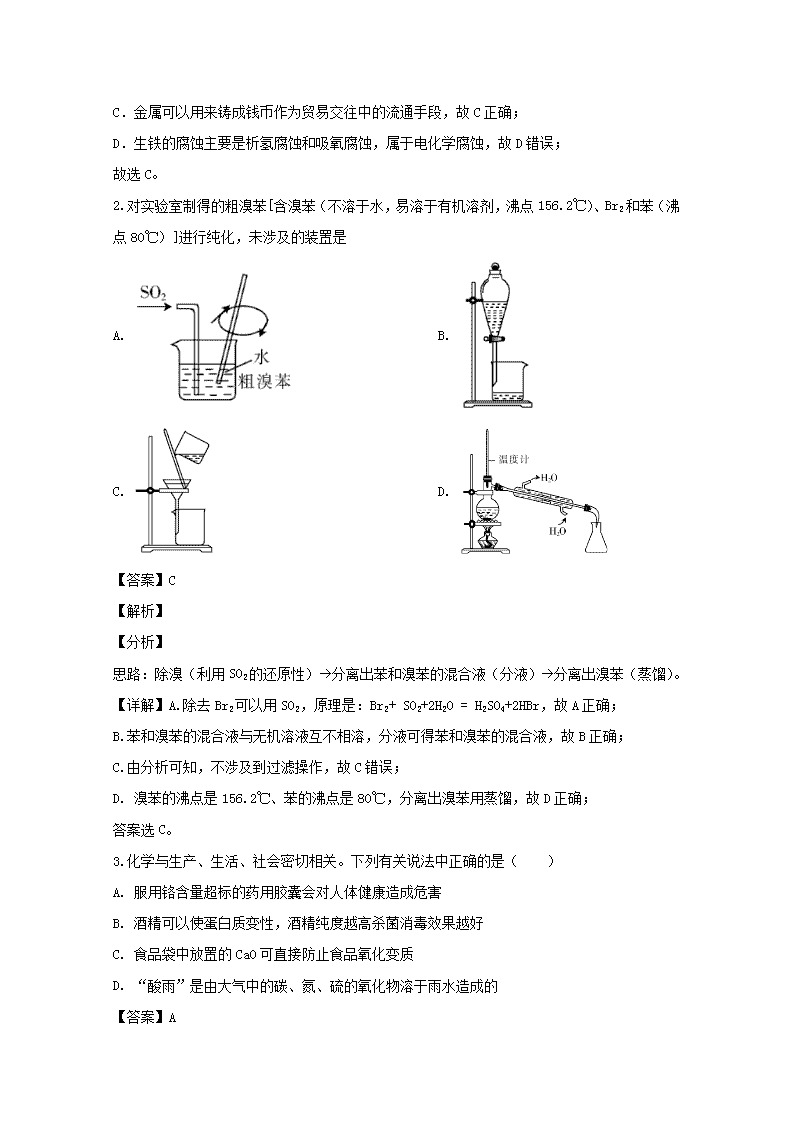
2019-2020学年上学期高三期末考试 化学 注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。 2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。 3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。 4.考试结束后,请将本试题卷和答题卡一并上交。 相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 K 39 Fe 56 Mn 55 一、选择题(每小题3分,共48分) 1.明末科学家宋应星出版的《天工开物》中记载了有关“五金”的内容:“∙∙∙∙∙∙黄金美者,其值去黑铁(生铁)一万六千倍,然使釜、鬵(xín,一种炊具)、斤(这里指菜刀、镰刀、锄头等)、斧不呈效于日用之间∙∙∙∙∙∙ ∙∙∙∙∙∙贸迁有无,∙∙∙∙∙∙”,下列解释正确的是 A. 明代使用的釜、鬵一类的炊具都属于青铜合金 B. 添加了铬、镍的不锈钢菜刀和农具使用后即使不保养,也不会生锈 C. 金属的另一个用途就是铸成钱币作为贸易交往中的流通手段 D. 黑铁在空气中发生的腐蚀主要是化学腐蚀 【答案】C 【解析】 【分析】 “黄金美者,其值去黑铁(生铁)一万六千倍,然使釜、鬵(xín,一种炊具)、斤(这里指菜刀、镰刀、锄头等)、斧不呈效于日用之间∙∙∙∙∙∙ ∙∙∙∙∙∙贸迁有无”的意思是,“最好的黄金,价值要比黑铁高一万六千倍,然而,如果没有铁制的锅、刀、斧之类供人们日常生活之用,∙∙∙∙∙∙,金属的另一种作用是铸成钱币,作为贸易交往中的流通手段”,据此分析解答。 【详解】A.明代使用的釜、鬵一类的炊具都属于铁合金,故A错误; B.不锈钢制作就是在普通钢中添加铬、镍等元素改变了钢铁内部结构,不锈钢不容易生锈;家里用的农具是铁合金,如果没及时冼干净后晾干,铁能与氧气、水分同时接触,容易发生电化学腐蚀,容易生锈,故B错误; C.金属可以用来铸成钱币作为贸易交往中的流通手段,故C正确; D.生铁的腐蚀主要是析氢腐蚀和吸氧腐蚀,属于电化学腐蚀,故D错误; 故选C。 2.对实验室制得的粗溴苯[含溴苯(不溶于水,易溶于有机溶剂,沸点156.2℃)、Br2和苯(沸点80℃)]进行纯化,未涉及的装置是 A. B. C. D. 【答案】C 【解析】 【分析】 思路:除溴(利用SO2的还原性)à分离出苯和溴苯的混合液(分液)à分离出溴苯(蒸馏)。 【详解】A.除去Br2可以用SO2,原理是:Br2+ SO2+2H2O = H2SO4+2HBr,故A正确; B.苯和溴苯的混合液与无机溶液互不相溶,分液可得苯和溴苯的混合液,故B正确; C.由分析可知,不涉及到过滤操作,故C错误; D. 溴苯的沸点是156.2℃、苯的沸点是80℃,分离出溴苯用蒸馏,故D正确; 答案选C。 3.化学与生产、生活、社会密切相关。下列有关说法中正确的是( ) A. 服用铬含量超标的药用胶囊会对人体健康造成危害 B. 酒精可以使蛋白质变性,酒精纯度越高杀菌消毒效果越好 C. 食品袋中放置的CaO可直接防止食品氧化变质 D. “酸雨”是由大气中的碳、氮、硫的氧化物溶于雨水造成的 【答案】A 【解析】 【详解】A、铬为重金属元素,摄入过多导致重金属中毒,A正确; B、酒精可以使蛋白质变性,杀菌消毒效果最佳的浓度为75%,并不是越高越好,B错误; C、CaO作为干燥剂,不能防止食品氧化变质,C错误; D、“酸雨”是由大气中的氮、硫的氧化物溶于雨水造成的,D错误; 故选A。 4.设NA为阿伏加德罗常数值,下列叙述不正确的是 A. 1L0.2mol/L亚硫酸钠溶液中H2SO3、HSO3−、SO32−的总数为0.2NA B. 常温常压下,1mol C2H4和1mol CH4所含的氢原子数均为4NA C. 向含1 mol FeI2的溶液中通入等物质的量的Cl2,转移的电子数为2NA D. 1mol白磷(P4)分子中所含化学键的数目为4NA 【答案】D 【解析】 【详解】A.根据物料守恒,1 L0.2mol/L亚硫酸钠溶液中H2SO3、HSO3—、SO32—的总物质的量为1L×0.2mol/L=0.2mol,其含硫微粒总数为0.2NA,A正确; B.等物质的量的C2H4和CH4所含的氢原子数相等,两者总物质的量1mol时,氢原子数一定为4NA,B正确; C.向含1 mol FeI2的溶液中通入等物质的量的Cl2,1molCl2全部被还原为Cl-,则转移的电子数为2NA,C正确; D.白磷是正四面体结构,4个P处于顶点,1mol白磷分子中含有化学键物质的量为6mol,D错误; 答案为D。 【点睛】白磷是正四面体结构,4个P处于顶点,相邻P原子间存在P-P键,1mol白磷含有6molP-P键。 5.下列离子方程式错误的是( ) A. 将少量的硝酸银溶液滴入氨水中 Ag++2NH3·H2O= [Ag(NH3)2]+ +2H2O B. 碳酸钠水解:CO32-+2H2O=H2CO3+2OH- C. 向3%的双氧水中通入少量SO2:H2O2+SO2=2H++SO42- D. 向NaHCO3溶液中加入过量石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O 【答案】B 【解析】 【详解】A. 由于氨水是过量的,则生成了稳定的[Ag(NH3)2]+,正确的离子方程式为:Ag++2NH3·H2O= [Ag(NH3)2]+ +2H2O,A项正确; B. 碳酸钠分步水解,主要为第一步水解,且为可逆反应,正确的离子方程式为:CO32-+H2O⇌HCO3--+OH-,B项错误; C. 向3%的双氧水中通入少量SO2,H2O2氧化SO2生成硫酸,正确的离子方程式为:H2O2+SO2=2H++SO42-,C项正确; D. 向NaHCO3溶液中加入过量石灰水,碳酸氢根离子全部参与反应,假设碳酸氢根离子为1mol,则正确的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,D项正确; 答案选B。 【点睛】碳酸氢钠溶液与澄清石灰水反应的离子方程式的书写是学生们学习的难点, 碳酸氢钠溶液与足量的澄清石灰水反应,离子方程式为:HCO3- +Ca2+ + OH- = CaCO3↓+ H2O, 碳酸氢钠溶液与少量的澄清石灰水反应,离子方程式为:2HCO3- +Ca2+ + 2OH- = CaCO3↓+ CO32-+ 2H2O。以“少量者定为1mol”配平过量反应物的系数。 6.在给定条件下,下列选项所示的物质间转化均能实现的是( ) A. SO2CaSO3CaSO4 B. FeFe2O3FeCl3 C. HCl(aq) Cl2Ca(ClO)2 D. Cu2(OH)2CO3CuO CuCl2(aq) 【答案】D 【解析】 【分析】 A. 二氧化硫与氯化钙不反应; B. 铁与氧气反应会生成三氧化四铁; C. 二氧化锰和浓盐酸共热反应生成氯气; D. 碱式碳酸铜受热会生成相应的金属氧化物,继续和酸反应生成盐和水; 【详解】A. 二氧化硫溶于水生成弱酸亚硫酸,不能与氯化钙反应,则不能一步直接生成亚硫酸钙,故A项错误; B. 铁在氧气中燃烧生成的是四氧化三铁而不是三氧化二铁,该物质之间的转化不能实现,故B项错误; C. 二氧化锰和浓盐酸在加热的条件下反应生成氯气,题设中未说明是否为浓盐酸,没有加热条件,故C项错误; D. Cu2(OH)2CO3受热会分解生成氧化铜,氧化铜与盐酸会反应生成氯化铜与水,则各物质可实现相互转化,故D项正确。 答案选D。 7.下列实验过程可以达到实验目的的是( ) 编号 实验过程 实验目的 A 称取2 g CuSO4•5H2O溶于98g水中,充分搅拌溶解,然后装入试剂瓶中 配制2%的CuSO4溶液 B 将活性炭放入盛有NO2的锥形瓶中,观察气体颜色 探究碳的还原性 C 将ZnSO4溶液滴入盛有2mLNa2S溶液的试管中至不再产生沉淀,然后滴入相同浓度的CuSO4溶液,观察现象 比较ZnS(白色)和CuS(黑色)的溶度积 D 向两支试管中分别加入2mL5%H2O2溶液然后只向其中一支试管中加入绿豆大小的FeI2固体,观察比较现象 探究I-对H2O2分解是否具有催化作用 A. A B. B C. C D. D 【答案】C 【解析】 【详解】A.溶于98g水中,溶液质量为100g,但硫酸铜质量小于2g,则溶液的质量分数小于2%,故A错误; B.活性炭具有吸附性,不能探究还原性,故B错误; C.发生沉淀的转化,由现象可比较ZnS(白色)和CuS(黑色)的溶度积,故C正确; D.碘离子与过氧化氢可发生氧化还原反应,不能探究催化剂对分解反应速率的影响,故D错误; 答案选C。 8.一种制备高效漂白剂NaC1O2的实验流程如图所示,反应I的化学方程式为: 3NaC1O3+4SO2+3H2O=2C1O2+Na2SO4+3H2SO4+NaCl,下列说法正确的是 A. NaClO2的漂白原理与SO2相同 B. 反应I中氧化产物和还原产物物质的量比为4:3 C. 反应II中H2O2做氧化剂 D. 实验室进行蒸发操作通常在坩埚中进行 【答案】B 【解析】 【详解】A. NaClO2中Cl元素化合价为+3价,该物质具有强的氧化性,因而具有漂白性,NaClO2的漂白是氧化漂白;而SO2能与某些有色物质结合,产生不稳定的无色物质,因此二者的漂白原理不相同,A错误; B. 反应I中发生的反应为3NaClO3+4SO2+3H2O=2ClO2+Na2SO4+3H2SO4+NaCl,氧化产物是Na2SO4和H2SO4,还原产物是ClO2和NaCl,氧化产物和还原产物物质的量比为4:3,故B正确; C. 反应I中发生的反应为3NaClO3+4SO2+3H2O=2ClO2+Na2SO4+3H2SO4+NaCl,反应产生的ClO2气体进入反应II装置,发生反应:2ClO2+2H2O2+2NaOH=2NaClO2+O2+2H2O,H2O2中氧元素的化合价由反应前的-1变为反应后中O2中的0价,化合价升高,失去电子,H2O2作还原剂,故C错误; D. 实验室进行结晶操作通常在蒸发皿中进行,坩埚是灼烧使用的仪器,故D错误; 正确答案是B。 【点睛】本题以高效漂白剂NaClO2制备为线索,考查了物质的作用、混合物的引入、仪器的使用等知识。掌握化学反应原理、化学实验基本操作及氧化还原反应的知识是本题解答的关键。 9.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法正确的是 A. 原子半径:Y>Z>X>W B. 简单氢化物的热稳定性:W>X>Z C. Y、Z形成的化合物溶于水会促进水的电离 D. 上述刺激性气体通入紫色石蕊溶液,溶液先变红后褪色 【答案】C 【解析】 【分析】 氨可作制冷剂,所以W是氮;钠是短周期元素中原子半径最大的,所以Y是钠;硫代硫酸钠与稀盐酸反应生成黄色沉淀硫单质和刺激性气味的气体二氧化硫,所以X、Z分别是氧、硫。 【详解】A. 由分析可知,Y钠、X是氧、Z是硫、W是氮,N、O同周期,Na、S同周期,自左而右原子半径减小,故原子半径:N>O,Na>S,S电子层多,原子半径较大,S>N;故原子半径Na>S>N>O,故选A错误; B. 非金属性O>N,故氢化物稳定性H2O>NH3,即W查看更多
相关文章
- 当前文档收益归属上传用户