- 2021-08-24 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学鲁科版一轮复习同步练习:第2章 元素与物质世界 章末 化学素材与命题架构
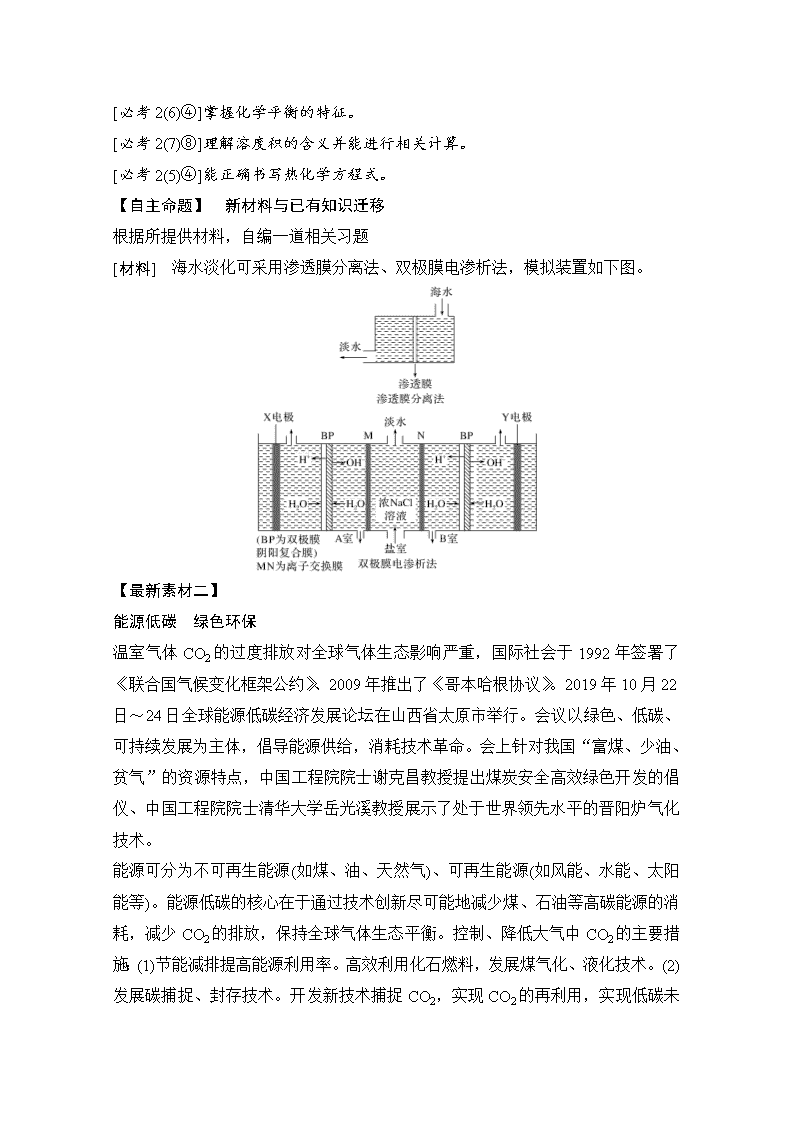
www.ks5u.com 【最新素材一】 水污染及其治理 我国人均水资源占有量居世界121位,被列为世界13个贫水国家之一,而水污染(如2019年1月广西河池市龙江镉污染。2019年9月云南曲靖市南盘江铬污染)进一步使局面恶化,严重影响我们的日常生活及工业生产。 污水治理总体方法: 1.减少和消除污染源。杜绝工业废水、城市污水的任意排放。 2.全面规划、合理布局。将同行业废水或相关废水集中处理,减少污染源。 3.废水资源化再循环利用。 污水处理具体方法: (1)物理方法如混凝法。 (2)化学方法如氧化法、沉淀法。 (3)物理化学法如吸附法、离子交换法、膜分离法。 (4)微生物法。 【命题架构】 1.(沉淀法:离子反应方向) 2019年1月广西河池市龙江镉污染是某冶金厂排污导致的。该厂废水经测pH=4.5,含Cd2+浓度超标10倍,为使废水达到排放标准,可加入熟石灰调节pH至11.0使Cd2+沉淀。写出相关反应的离子方程式_________________________________________________________________。 答案 Ca(OH)2+Cd2+===Ca2++Cd(OH)2↓ 2.(氧化法:化学平衡方向、沉淀溶解平衡方向) 2019年9月云南曲靖市南盘江铬污染工业废水中含有Cr2O、CrO严重超出排放标准,可用还原沉淀法处理 CrOCr2OCr3+Cr(OH)3↓,其中第①步存在平衡:2CrO(黄色)+2H+Cr2O(橙色)+H2O (1)能说明①转化反应达到平衡状态是________。 a.Cr2O、CrO浓度相同 b.溶液颜色不变 c.2v(Cr2O)=v(CrO) d.pH不变 (2)已知Ksp[Cr(OH)3]=10-32,要使Cr3+完全沉淀,溶液的pH应调至________。 答案 (1)bd (2)≥5 3.(混凝法:胶体方向) 明矾可用于净水,去除水中的悬浮物、色素。 (1)其净水原理为______________________________________________________ (用离子方程式表示)。 (2)明矾净水的适宜pH范围为5~8,如pH过高或pH过低去污效果较差,理由是______________________________________________________________。 答案 (1)Al3++3H2OAl(OH)3+3H+ (2)Al(OH)3为两性氢氧化物,溶于酸或碱 4.(微生物法:热效应方向) 水体中N、P含量过高会导致水华,严重破坏水质。水体中的NH可在微生物的条件下经两步反应转化为NO然后除去。两步反应的能量变化如图: 1 mol NH(aq)全部氧化成NO(aq)的热化学方程式为 __________________________________________________________________。 答案 NH(aq)+2O2(g)===NO(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1 测试方向: [必考2(2)⑥]能正确书写离子方程式。 [必考2(6)④]掌握化学平衡的特征。 [必考2(7)⑧]理解溶度积的含义并能进行相关计算。 [必考2(5)④]能正确书写热化学方程式。 【自主命题】 新材料与已有知识迁移 根据所提供材料,自编一道相关习题 [材料] 海水淡化可采用渗透膜分离法、双极膜电渗析法,模拟装置如下图。 【最新素材二】 能源低碳 绿色环保 温室气体CO2的过度排放对全球气体生态影响严重,国际社会于1992年签署了《联合国气候变化框架公约》、2009年推出了《哥本哈根协议》。2019年10月22日~24日全球能源低碳经济发展论坛在山西省太原市举行。会议以绿色、低碳、可持续发展为主体,倡导能源供给,消耗技术革命。会上针对我国“富煤、少油、贫气”的资源特点,中国工程院院士谢克昌教授提出煤炭安全高效绿色开发的倡仪、中国工程院院士清华大学岳光溪教授展示了处于世界领先水平的晋阳炉气化技术。 能源可分为不可再生能源(如煤、油、天然气)、可再生能源(如风能、水能、太阳能等)。能源低碳的核心在于通过技术创新尽可能地减少煤、石油等高碳能源的消耗,减少CO2的排放,保持全球气体生态平衡。控制、降低大气中CO2的主要措施:(1)节能减排提高能源利用率。高效利用化石燃料,发展煤气化、液化技术。(2)发展碳捕捉、封存技术。开发新技术捕捉CO2,实现CO2 的再利用,实现低碳未来。(3)发展清洁能源。大力推广可再生能源(如风能、太阳能发电、开发氢能等)替代化石能源。 【命题架构】 1.(煤的气化、液化、热化学方向) 煤的液化可以合成甲醇。已知①气化:C(s)+2H2O(g)===CO2(g)+2H2(g) ΔH1=+90.1 kJ·mol-1 ②催化液化:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1,则C(s)+H2O(g)+H2(g)===CH3OH(g) ΔH=________kJ·mol-1。 答案 41.1 2.(碳捕捉:离子反应方向、电化学方向) (1)科学家利用NaOH溶液“捕捉”空气中的CO2,反应过程如图所示:写出“捕捉室”、沉淀池中的离子方程式________________________________________ ___________________________________________________________________。 (2)如图为“固定CO2”的电化学装置,放电时可将CO2转化为C和Li2CO3,充电时释放出CO2和O2。放电时的正极反应式为_________________________, 每生成1 mol C理论上消耗Li________ g。 答案 (1)CO2+2OH-===CO+H2O CO+CaO+H2O===CaCO3↓+2OH- (2)3CO2+4e-+4Li+===C+2Li2CO3 28 3.再利用(化学反应速率、化学平衡方向) CH4—CO2催化重整对CO2的减排具有重要意义。反应为CH4(g)+CO2(g)2CO(g)+2H2(g)。 科学家对上述反应提出如下反应历程(X代表一种或多种中间产物): 第一步:CH4+CO2===X 慢反应 第二步:X===2CO+2H2 快反应 (1)X的化学式为________。 (2)总反应的反应速率取决于第________步反应。 (3)按一定体积比加入CH4和CO2,在恒压条件下发生上述反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900 ℃的原因是___________________________________________________________________ __________________________________________________________________。 答案 (1)C2H4O2 (2)一 (3)900 ℃时CO、H2的产率已较高,高于900 ℃时,升高温度对产率影响较小,900 ℃催化剂催化效果好。 测试方向: [必考2(2)⑥]能正确书写离子方程式。 [必考2(8)]理解原电池工作原理,能书写电极反应式。 [必考2(5)⑦]理解盖斯定律,并运用盖斯定律计算ΔH。 [必考2(6)⑤]理解外界条件对速率、平衡的影响 【自主命题】 新材料与已有知识迁移 根据所给材料,自编一道相关习题。 [材料] 燃煤废气中含有的CO2任意排放会造成环境污染。现拟用燃煤废气为原料合成甲醚,反应原理为2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),已知压强为a MPa时,在不同温度、不同投料比时,反应中CO2的转化率如图:查看更多