- 2021-08-24 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高三4月教育教学质量监测考试(全国Ⅰ卷) 化学
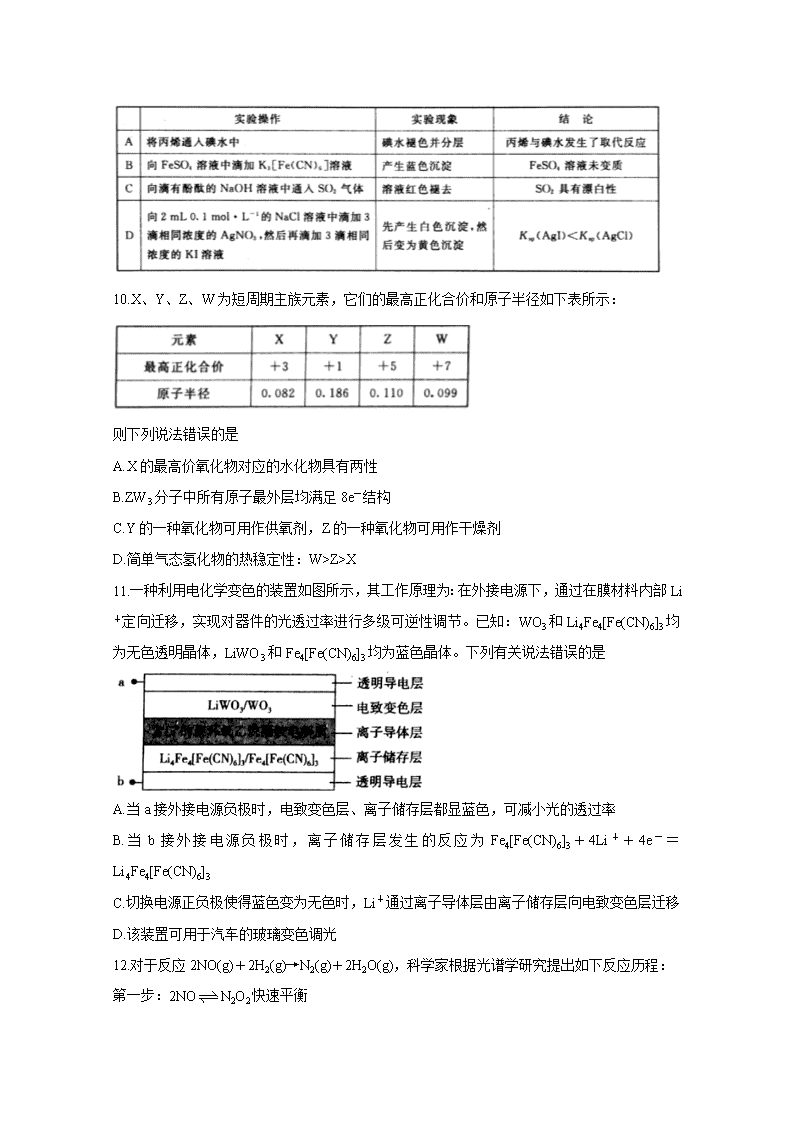
百校联盟2020届普通高中教育教学质量监测考试 全国I卷 化学试卷 注意事项: 1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分。 2.答题前,考生务必将自己的姓名、准考证号填写在本试卷相应的位置。 3.全部答案写在答题卡上,写在本试卷上无效。 4.本试卷满分300分,测试时间150分钟。 5.考试范围:高考全部内容。 可能用到的相对原子质量:H1 C12 O16 Ca40 Ti48 Zn65 第I卷 一、选择题:本题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与生活紧密相关,下列描述正确的是 A.流感疫苗一般应冷藏存放,以避免蛋白质变性 B.乳酸()通过加聚反应可制得可降解的聚乳酸塑料 C.“客从南溟来,遗我泉客珠。”“珍珠”的主要成分属于有机高分子化合物 D.水泥是由石灰石、石英砂、纯碱为原料烧制而成的 8.有机物G的结构简式为,下列关于有机物G的说法错误的是 A.分子式为C10H12O5 B.1 mol G与足量的金属钠反应,生成H2的体积为33.6 L C.在一定条件下,1 mol G与足量的H2反应,最多消耗3 mol H2 D.可发生取代反应、加成反应和氧化反应 9.通过下列实验操作和实验现象,得出的结论正确的是 10.X、Y、Z、W为短周期主族元素,它们的最高正化合价和原子半径如下表所示: 则下列说法错误的是 A.X的最高价氧化物对应的水化物具有两性 B.ZW3分子中所有原子最外层均满足8e-结构 C.Y的一种氧化物可用作供氧剂,Z的一种氧化物可用作干燥剂 D.简单气态氢化物的热稳定性:W>Z>X 11.一种利用电化学变色的装置如图所示,其工作原理为:在外接电源下,通过在膜材料内部Li+定向迁移,实现对器件的光透过率进行多级可逆性调节。已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明晶体,LiWO3和Fe4[Fe(CN)6]3均为蓝色晶体。下列有关说法错误的是 A.当a接外接电源负极时,电致变色层、离子储存层都显蓝色,可减小光的透过率 B.当b接外接电源负极时,离子储存层发生的反应为Fe4[Fe(CN)6]3+4Li++4e-=Li4Fe4[Fe(CN)6]3 C.切换电源正负极使得蓝色变为无色时,Li+通过离子导体层由离子储存层向电致变色层迁移 D.该装置可用于汽车的玻璃变色调光 12.对于反应2NO(g)+2H2(g)→N2(g)+2H2O(g),科学家根据光谱学研究提出如下反应历程: 第一步:2NON2O2快速平衡 第二步:N2O2+H2→N2O+H2O慢反应 第三步:N2O+H2→N2+H2O快反应 其中可近似认为第二步反应不影响第一步的平衡。下列叙述正确的是 A.若第一步反应△H<0,则升高温度,v正减小,v逆增大 B.第二步反应的活化能大于第三步的活化能 C.第三步反应中N2O与H2的每一次碰撞都是有效碰撞 D.反应的中间产物只有N2O2 13.常温下,向20 mL 0.1 mol·L-1一元酸HA中滴加相同浓度的KOH溶液,溶液中由水电离的氢离子浓度随加入KOH溶液体积的变化如图所示。则下列说法错误的是 A.HA的电离常数约为10-5 B.b点溶液中存在:c(A-)=c(K+) C.c点对应的KOH溶液的体积V=20 mL,c水(H+)约为7×10-6 mol·L-1 D.导电能力:c>a>b 第II卷 三、非选择题:包括必考题和选考题两部分。第22题~第32题为必考题,每个试题考生都必须作答。第33题~第38题为选考题,考生根据要求作答。 (一)必考题(共129分) 26.(15分)葡萄糖酸锌{M[Zn(C6H11O7)2]=455g·mol-1)是一种重要的补锌试剂,其在医药、食品、饲料、化妆品等领城中具有广泛的应用。纯净的葡葡糖酸锌为白色晶体,可溶于水,极易溶于热水,不溶于乙醇,化学兴趣小组欲在实验室制备葡萄糖酸锌并测定产率。实验操作分以下两步: I.葡萄糖酸(C6H12O7)的制备 量取50 mL蒸馏水于100 mL烧杯中,搅拌下绶慢加入2.7 mL(0.05 mol)浓H2SO4,分批加入21.5 g葡萄糖酸钙{M[Ca(C6H11O7)2]=430g·mol-1,易溶于热水},在90℃条件下,不断搅拌,反应40min后,趁热过滤。滤液转移至小烧杯,冷却后,缓慢通过强酸性阳离子交换树脂, 交换液收集在烧杯中,得到无色的葡葡糖酸溶液。 II.葡萄糖酸锌的制备 向上述制得的葡萄糖酸溶液中分批加入足量的ZnO,在60℃条件下,不断搅拌,反应1h,此时溶液pH≈6。 趁热减压过滤,冷却结晶,同时加入10 mL 95%乙醇,经过一系列操作,得到白色晶体,经干燥后称量晶体的质量为18.2 g。 回答下列问题: (1)制备葡萄糖酸的化学方程式为 。 (2)通过强酸性阳离子交换树脂的目的是 。 (3)检验葡萄糖酸溶液中是否存在SOF的操作为 。 (4)制备葡萄糖酸时选用的最佳加热方式为 。 (5)制备葡萄糖酸锌时加入乙醇的目的是 ,“一系列操作”具体是指 。 (6)葡萄糖酸锌的产率为 (用百分数表示),若pH≈5时就进行后续操作,产率将 (填“增大”“减小”或“不变”)。: 27.(14分)对废银合金触电材料进行分离回收既节约矿物资源,又可以减少环境污染。某废银合金触电材料含Ag、Cu、Sn等,现欲利用以下工艺流程回收其中的金属资源。 回答下列问题: (1)“加热溶解”时Cu发生的离子方程式为 。 (2)“加热溶解”时温度常控制在50℃左右,温度不宜过高也不宜过低的原因为 。 (3)“酸溶解”过程中会产生少量遇空气变为红棕色的无色气体,则“酸溶解”过程主要的化学方程式为 。 (4)常温下,Cu2+/Sn4+混合液中c(Cu3+)=0.022 mol·L-1,将混合液“加热搅拌”后冷却至室温,再加“尿素”调节溶液的pH范围为 。(当溶液中的离子浓度小于10-5 mol·L-1时,沉淀完全,已知:Ksp[Sn(OH)4]=1×10-55;Ksp[Cu(OH)2]=2.2×10-20) (5)检验Sn(OH)4沉淀是否洗涤干净的方法是 。 (6)用惰性电极电解CuCl2溶液,阴极反应式是 ,若想由CuCl2溶液得到无水CuCl2固体,则需进行的实验操作为 。 28.(14分)煤燃烧排放的烟气含有SO2和NOx,大量排放烟气形成酸雨、污染大气,因此对烟气进行脱硫、脱硝,对环境保护有重要意义。回答下列问题: I.利用CO脱硫 (1)工业生产可利用CO气体从燃煤烟气中脱硫,则25℃时CO从燃煤烟气中脱硫的热化学方程式2CO(g)+SO2(g)2CO2(g)+S(s)的焓变△H= 。 25℃,100kPa时,由元素最稳定的单质生成1 mol纯化合物时的反应热称为标准摩尔生成焓,已知一些物质的“标准摩尔生成焓”如下表所示: (2)在模拟脱硫的实验中,向多个相同的体积恒为2L的密闭容器中分别通入2.2 mol CO和1 mol SO2气体,在不同条件下进行反应,体系总压强随时间的变化如图所示。 ①在实验b中,40 min达到平衡,则0~40 min用SO2表示的平均反应速率v(SO2)= 。 ②与实验a相比,实验b可能改变的条件为 ,实验c可能改变的条件为 。 II.利用NH3脱硝 (3)在一定条件下,用NH3消除NO污染的反应原理为:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H=-1807.98 kJ·mol-1。在刚性容器中,NH3与NO的物质的量之比分别为X、Y、Z(其中X查看更多
相关文章
- 当前文档收益归属上传用户