福建省泉州市泉港区第一中学2020届高三上学期期中考试 化学
泉港一中2020届高三(上)期中考试化学试卷
可能用到的相对原子质量:H-1 C-12 N-14 Na-23 0-16 Fe-56 V-51
一、选择题(每小题只有一个正确选项,每小题3分,共48分)
1.化学与生活、生产、科技密切相关。下列说法错误的是
A.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
B.中国天眼传输信息用的光纤材料是硅
C.研发新能源汽车,减少化石燃料的使用,与“绿水青山就是金山银山”的绿色发展理念一致
D.港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
2.室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中不变
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下,0.5 mol•L-1 Fe2(SO4)3溶液中含Fe3+数目小于NA
B.常温常压下,4.6 gNO2和N2O4的混合气体中含有的氮原子数为0.1 NA
C.氢氧燃料电池正极消耗标准状况下22.4 L气体时,溶液中通过的电子数目为4NA
D.将0.1molCH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目等于0.1 NA
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.由水电离出的c(OH-)=1×10-13mol·L-1的溶液中:Na+、ClO-、SO42-、I-
B.能使酚酞试剂变红的溶液中:CO32-、SO42-、K+、AlO2-
C.pH=7的溶液中:Fe3+、K+、Cl-、SO42-
D.与铝粉反应放出H2的无色溶液中:NO3-、Fe2+、Na+、SO42-
5.有甲、乙、丙3瓶等体积、等物质的量浓度的硫酸。若将甲用水稀释,在乙中加入少量的BaCl2溶液,丙保持原状,然后用等浓度的NaOH溶液滴定,至恰好完全反应时,所需NaOH溶液的体积关系是
A. 丙>甲>乙 B.乙>丙>甲 C. 甲=乙=丙 D. 丙=甲>乙
6. 已知:①2H2(g)+O2(g)==2H2O(g) ΔH=-483.6 kJ·mol-1 ②H2S(g)H2(g)+S(g) ΔH=+20.1 kJ·mol-1
下列判断正确的是
A. 氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B. 由①②知,水的热稳定性小于硫化氢
C. 相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)
放热多20.1 kJ
D. ②中若生成固态硫,ΔH将增大
7.下列电解质溶液中微粒的物质的量浓度关系一定正确的是( )
A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO)>c(CO)>c(H2CO3)
B.在0.1 mol·L-1NaClO溶液中:c(OH-)=c(H+)+c(HClO)
C.某温度下,CH3COOH溶液中滴入NaOH溶液,使溶液pH=7时:
c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D.已知酸性:HCOOH>CH3COOH,相同浓度的HCOOK与CH3COONa溶液中
c(K+)-c(HCOO-)>c(Na+)-c(CH3COO-)
8.已知X、Y、Z、W、M 均为短周期元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01 mol·L-1)溶液的pH和原子半径的关系如图所示。下列说法不正确的是
A.X、M 简单离子半径大小顺序:X>M
B.X、Y、Z、W、M 五种元素中只有一种是金属元素
C.Z 的最高价氧化物的化学式为ZO3
D.X、Z的最简单气态氢化物反应有白烟生成
9.次磷酸(H3PO2)是一元中强酸,具有较强还原性,下列有关说法正确的是
A.次磷酸的电离方程式为:H3PO2=H++H2PO2-
B.NaH2PO2是次磷酸的正盐,其水溶液呈中性
C.白磷与足量氢氧化钠溶液反应可得次磷酸盐,反应的化学方程式为:P4+9NaOH=3Na3PO2+PH3↑+3H2O
D.利用(H3PO2)进行化学镀银反应中,1mol H3PO2最多还原4mol Ag+离子
10.反应N2O4(g)2NO2(g) △H=+57 kJ·mol-1,在温度T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深,c浅
C.a、b两点气体的平均相对分子质量:a>b
D.b、c两点化学平衡常数:b
f
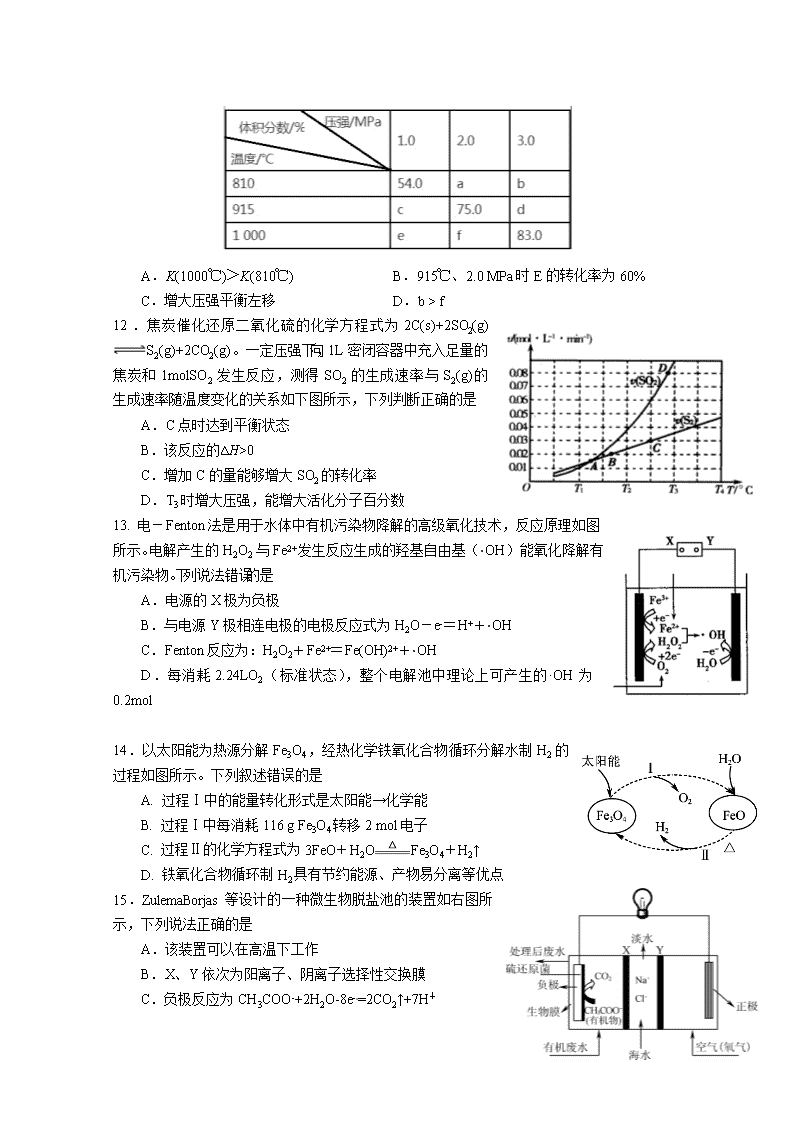
12.焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g)S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如下图所示,下列判断正确的是
A.C点时达到平衡状态
B.该反应的∆H>0
C.增加C的量能够增大SO2的转化率
D.T3时增大压强,能增大活化分子百分数
13. 电-Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法错误的是
A.电源的X极为负极
B.与电源Y极相连电极的电极反应式为H2O-e-=H++·OH
C.Fenton反应为:H2O2+Fe2+=Fe(OH)2++·OH
D.每消耗2.24LO2(标准状态),整个电解池中理论上可产生的·OH为0.2mol
14.以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述错误的是
A. 过程Ⅰ中的能量转化形式是太阳能→化学能
B. 过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子
C. 过程Ⅱ的化学方程式为3FeO+H2OFe3O4+H2↑
D. 铁氧化合物循环制H2具有节约能源、产物易分离等优点
15.ZulemaBorjas等设计的一种微生物脱盐池的装置如右图所示,下列说法正确的是
A.该装置可以在高温下工作
B.X、Y依次为阳离子、阴离子选择性交换膜
C.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D.该装置工作时,电能转化为化学能
16.常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是
A.a点时,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1
B.电离平衡常数:Ka(HA)< Ka(HB)
C.b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D.向HB溶液中滴加NaOH溶液至pH=7时:c(B-)>c(HB)
二、填空题(共52分)
17. (14分)科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。
(1)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中发生2NO(g)+2CO(g)N2(g)+2CO2(g) 反应,容器中NO物质的量随时间变化如图所示。
①T℃时,该化学反应的平衡常数K=___________。
②下列事实无法判断汽车尾气转化反应达到到化学平衡状态的是______。
A.NO消耗速率等于N2消耗速率的2倍 B.混合气体平均相对分子质量不再变化
C.体系中NO的转化率和CO的转化率相等 D.气体的密度不再变化
③已知2NO(g)+2CO(g)N2(g)+2CO2(g) △H<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系正确的是___________。(填序号)
(2)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如图一所示。
图一 图二
①当起始n(H2)/n(CO)=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)= 。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4mol,达到新平衡时H2的转化率将 (填”增大“”减小“或”不变“)。
②当n(H2)/n(CO) =3.5时,达到平衡后,CH3OH的体积分数可能是图像中的 (填“D”“E”或“F”)点。
(3)在一容积可变的密闭容器中充有10mol CO和20mol H2。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图二所示。
①A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
②若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 ______ L。
18.(10分)研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
SO2(g)+NH3·H2O(aq)NH4HSO3(aq) ΔH1=a kJ·mol−1;
NH3·H2O(aq)+ NH4HSO3(aq)(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ·mol−1;
2(NH4)2SO3(aq)+O2(g)2(NH4)2SO4(aq) ΔH3=c kJ·mol−1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) 2(NH4)2SO4(aq)+2H2O(l)的ΔH =____________kJ·mol−1。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=υ(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/s
0
1
2
3
4
5
n(NO)/mol
1
0.6
0.4
0.2
0.2
0.2
n(O2)/mol
0.6
0.4
0.3
0.2
0.2
0.2
①T1温度时k正/k逆=__________ L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__________T1(填“>”、“<”或“=")。
(4)已知:N2(g)+O2(g)2NO(g) △H=+181.5 kJ·mol-1 ,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用、、和分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是_________ (填字母序号)。
(5)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-。
①阴极的电极反应式为______________________。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是阴极发生副反应______________。
19.(15分)过碳酸钠俗称固体双氧水,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,它的制备原理和路线如下:
已知:2Na2CO3 + 3H2O2 ==2Na2CO3·3H2O2 △H<0,请回答下列问题:
(1)下列物质可使过碳酸钠较快失效的是_________________。
a.MnO2 b.H2S c.稀硫酸 d.NaHCO3
(2)加入NaCl的作用是_____________________________________________________________。
(3)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与Fe3+生成稳定的配合物,Fe3+对反应的不良影响是_________________。
(4)反应的最佳温度控制在15℃~20℃,温度过高时会造成产率________。(填“偏大、偏小、无影响”)
(5)以上流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是_________________。进行该操作的方法是:_________________。
(6)为测定产品的纯度,准确称取ag产品配成250mL溶液,移取25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释成100mL,作被测试样;用高锰酸钾标准溶液滴定被测试样,MnO4-的还原产物是Mn2+。
①用cmol/L KMnO4标准溶液滴定待测液,滴定到达终点的现象是_____________________________;
②重复滴定三次,平均消耗cmol/L KMnO4标准溶液VmL,则产品中过碳酸钠的质量分数为__________;
③配制cmol/L KMnO4标准溶液时,移液时有少量液体溅出,则产品的纯度将_________(变大、变小或不变)。
20. (13分)钒(23V)是我国的丰产元素,广泛应用于催化及钢铁工业,有“化学面包”、金属“维生素”之称。(1)钒原子的核外电子排布式为 ,在元素周期表中的位置为 。
(2)V2O5常用作SO2转化为SO3的催化剂。基态硫原子电子占据最高能级的电子云形状为 形;气态SO3以单分子形式存在,其分子的立体构型为 形;固体SO3的三聚体环状结构如图1所示,该结构中S—O键长有a、b两类,b的键长大于a的键长的原因为 。
(3)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子中V的杂化轨道类型为 ;也可得到偏钒酸钠,其阴离子呈如图2所示的无限链状结构,则偏钒酸钠的化学式为 。
(4)钒的某种氧化物晶胞结构如图3所示。该氧化物的化学式为 ,若它的晶胞参数为x nm,则晶胞的密度为 g·cm-3。
参考答案:
1-16: BCDBC CBCDD DADBC B
17.(14分)
(1) ①2.5(mol/l)-1(2分) ② CD (2分) ③ BC(2分)
(2)①0.12mol•L-1•min-1 (1分) 增大(2分) ②F (2分)
(3)①KA=KB>KC (1分) ②2 (2分)
18.(10分)
(1)2a+2b+c (1分)
(2)①160 (2分) ②> (2分)
(3)C (1分)
(4)①2NO+4e-=N2+2O2- (2分) ②阴极发生副反应O2+4e-=2O2- (2分)
19. (15分)
(1)abc (2分)
(2)使2Na2CO3·3H2O2在水中的溶解降低,析出更多晶体(1分)
催化双氧水的分解(1分) 温度高时双氧水易分解 (2分)
(5)晶体洗涤(1分),向置于过滤器上的沉淀加水至刚好浸没沉淀,静置,待水流完后,重复操作两到三次(2分)
(6)①酸性高锰酸钾溶液滴入最后一滴时,溶液有无色变为浅红色(或浅紫色或粉红色),且30s不恢复原色(2分);
②785cV3a% (2分) ;③变大(2分)
20.(13分)
(1)1s22s22p63s23p63d34s2或[Ar]3d34s2 (1分) 第四周期第ⅤB族 (1分)
(2)哑铃(纺锤) (1分); 平面三角(1分) ; 形成b键的氧原子与两个S原子结合,作用力较小 (2分,其他合理解释也给分,如a为S=O,b为S-O,键能越大,键长越短)
(3)sp3 (1分) NaVO3 (2分)
(4)VO2 (2分) (2分)