- 2021-08-24 发布 |
- 37.5 KB |
- 7页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020鲁科版高考化学复习规范练 (20)
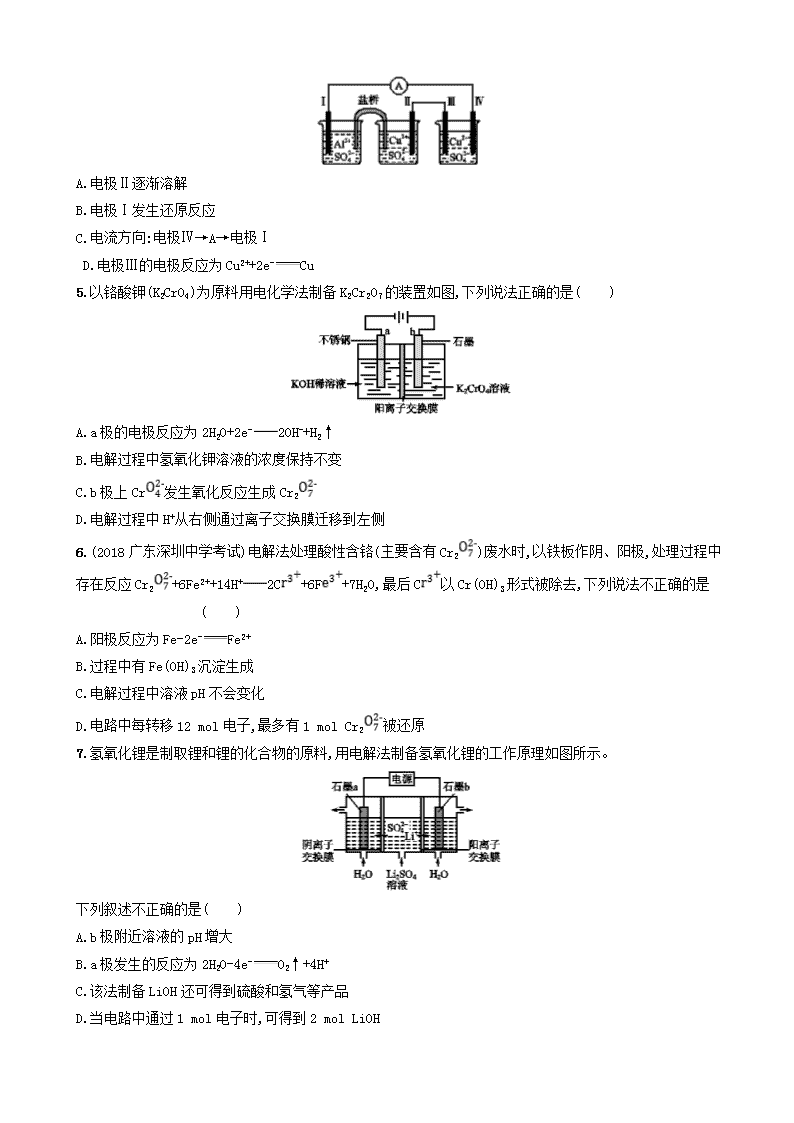
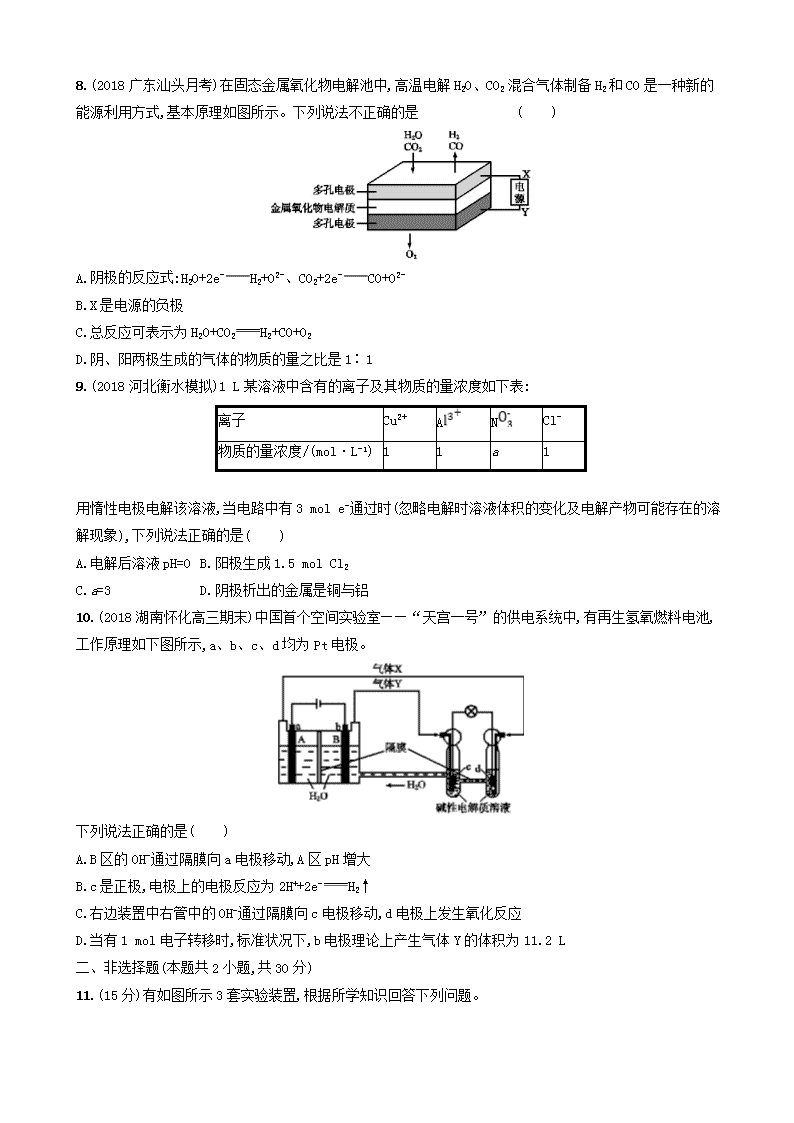
课时规范练20 电能转化为化学能——电解 一、选择题(本题共10小题,每小题7分,共70分。每小题只有一个选项符合题目要求) 1.以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( ) A.若通电前上述镀锌装置构成原电池,则电镀过程是该原电池的充电过程 B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 C.电镀时保持电流恒定,升高温度不改变电解反应速率 D.镀锌层破损后即对铁制品失去保护作用 2.(2018四川绵阳模拟)下列表述不正确的是( ) A B 盐桥中的Cl-移向ZnSO4溶液 a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 C D 粗铜的电极反应式为Cu2++2e-Cu 正极反应式为O2+4e-+2H2O4OH- 3.(2018河南天一大联考阶段检测)普通电解精炼铜的方法所制备的铜中仍含有杂质,利用下面的双膜(阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是( ) A.电极a为粗铜,电极b为精铜 B.甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区 C.乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区 D.当电路中通过1 mol电子时,可生成32 g精铜 4.某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则( ) A.电极Ⅱ逐渐溶解 B.电极Ⅰ发生还原反应 C.电流方向:电极Ⅳ→A→电极Ⅰ D.电极Ⅲ的电极反应为Cu2++2e-Cu 5.以铬酸钾(K2CrO4)为原料用电化学法制备K2Cr2O7的装置如图,下列说法正确的是( ) A.a极的电极反应为2H2O+2e-2OH-+H2↑ B.电解过程中氢氧化钾溶液的浓度保持不变 C.b极上Cr发生氧化反应生成Cr2 D.电解过程中H+从右侧通过离子交换膜迁移到左侧 6.(2018广东深圳中学考试)电解法处理酸性含铬(主要含有Cr2)废水时,以铁板作阴、阳极,处理过程中存在反应Cr2+6Fe2++14H+2C+6F+7H2O,最后C以Cr(OH)3形式被除去,下列说法不正确的是 ( ) A.阳极反应为Fe-2e-Fe2+ B.过程中有Fe(OH)3沉淀生成 C.电解过程中溶液pH不会变化 D.电路中每转移12 mol电子,最多有1 mol Cr2被还原 7.氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示。 下列叙述不正确的是( ) A.b极附近溶液的pH增大 B.a极发生的反应为2H2O-4e-O2↑+4H+ C.该法制备LiOH还可得到硫酸和氢气等产品 D.当电路中通过1 mol电子时,可得到2 mol LiOH 8.(2018广东汕头月考)在固态金属氧化物电解池中,高温电解H2O、CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是 ( ) A.阴极的反应式:H2O+2e-H2+O2-、CO2+2e-CO+O2- B.X是电源的负极 C.总反应可表示为H2O+CO2H2+CO+O2 D.阴、阳两极生成的气体的物质的量之比是1∶1 9.(2018河北衡水模拟)1 L某溶液中含有的离子及其物质的量浓度如下表: 离子 Cu2+ A N Cl- 物质的量浓度/(mol·L-1) 1 1 a 1 用惰性电极电解该溶液,当电路中有3 mol e-通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是( ) A.电解后溶液pH=0 B.阳极生成1.5 mol Cl2 C.a=3 D.阴极析出的金属是铜与铝 10.(2018湖南怀化高三期末)中国首个空间实验室——“天宫一号”的供电系统中,有再生氢氧燃料电池,工作原理如下图所示,a、b、c、d均为Pt电极。 下列说法正确的是( ) A.B区的OH-通过隔膜向a电极移动,A区pH增大 B.c是正极,电极上的电极反应为2H++2e-H2↑ C.右边装置中右管中的OH-通过隔膜向c电极移动,d电极上发生氧化反应 D.当有1 mol电子转移时,标准状况下,b电极理论上产生气体Y的体积为11.2 L 二、非选择题(本题共2小题,共30分) 11.(15分)有如图所示3套实验装置,根据所学知识回答下列问题。 (1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,即可观察到铁钉附近的溶液出现蓝色沉淀,表明铁被 (填“氧化”或“还原”);向插入石墨的玻璃筒内滴入酚酞溶液,可观察到石墨附近的溶液变红,该电极反应式为 。 (2)装置2中的石墨作 (填“正”或“负”)极,该装置发生的总反应的离子方程式为 。 (3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨附近溶液首先变红。 ①电源的M端为 极;甲烧杯中铁极的电极反应式为 。 ②乙烧杯中电解反应的离子方程式为 。 ③停止通电后,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,甲烧杯中产生的气体在标准状况下的体积为 mL。 12.(2018课标全国Ⅲ,27)(15分)KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题: (1)KIO3的化学名称是 。 (2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示: “酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是 。“滤液”中的溶质主要是 。“调pH”中发生反应的化学方程式为 。 (3)KIO3也可采用“电解法”制备,装置如图所示。 ①写出电解时阴极的电极反应式 。 ②电解过程中通过阳离子交换膜的离子主要为 ,其迁移方向是 。 ③与“电解法”相比,“KClO3氧化法”的主要不足之处有 (写出一点)。 课时规范练20 电能转化为化学能——电解 1.C 电镀前,Zn与Fe构成原电池,Zn为负极,Fe为正极;电镀时,Fe为阴极,Zn为阳极;原电池充电时,原电池负极为阴极、正极为阳极,故电镀过程不属于原电池的充电过程,A项错误;根据电子守恒,通过电子的电量与析出Zn的量成正比,B项错误;电流恒定,单位时间通过的电子的物质的量恒定,即电解速率恒定,C项正确;镀层破损后,Zn与Fe仍能构成原电池,其中Zn为负极被腐蚀,Fe为正极被保护,D项错误。 2.C 根据原电池的工作原理,锌为负极,铜为正极,阴离子向负极移动,A正确;根据电解原理,a为阳极,其电极反应式为2Cl--2e-Cl2↑,b为阴极,电极反应式为Cu2++2e-Cu,因此a极产生的气体能使湿润的淀粉碘化钾试纸变蓝,B正确;粗铜作阳极,Cu-2e-Cu2+,C错误;发生吸氧腐蚀时,正极得电子,电极反应式为O2+2H2O+4e-4OH-,D正确。 3.D 由题意结合电解原理可知,电极a是阴极,为精铜;电极b是阳极,为粗铜,A项错误;甲膜为阴离子交换膜,可阻止杂质阳离子进入阴极区,B项错误;乙膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区,C项错误;当电路中通过1 mol电子时,可生成0.5 mol精铜,其质量为32 g,D项正确。 4.C 当多池串联时,两电极材料活动性相差大的作原电池,由此可知图示中左边两池组成原电池,右边组成电解池。原电池正极为得电子一极,铜离子在电极Ⅱ上得电子,生成铜单质,该电极质量逐渐增大,A项错误;原电池负极在工作中失电子,被氧化,发生氧化反应,B项错误;电子移动方向:电极Ⅰ→A→电极Ⅳ,电流方向与电子移动方向相反,C项正确;电解池中阳极为铜电极时,电极本身失电子,形成离子进入溶液中,由于电极Ⅱ为正极,故电极Ⅲ为电解池的阳极,其电极反应为Cu-2e-Cu2+,D项错误。 5.A 由题意知,以铬酸钾为原料用电化学法制备重铬酸钾的过程中,铬酸钾中3种元素的化合价都没有发生变化,阳极材料石墨为惰性电极,所以被电解的物质一定是水,阳极电极反应为2H2O-4e-O2↑+4H+,一段时间后阳极区溶液酸性明显增强,发生反应2Cr+2H+Cr2+H2O;阴极电极反应为4H2O+4e-2H2↑+4OH-。a极为阴极,H+放电生成氢气,A项正确;电解过程中,被电解的物质是水,a极区溶液中c(OH-)增大,K+由阳极区移向阴极区,所以阴极区氢氧化钾溶液的浓度变大,B项错误;铬元素的化合价不变,C项错误;电解过程中主要是K+从右侧通过离子交换膜迁移到左侧,H+在右侧参与了反应2Cr+2H+Cr2+H2O,D项错误。 6.C Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成Fe2+,阳极反应式为Fe-2e-Fe2+,A项正确;阴极发生还原反应,溶液中的H+得到电子生成氢气,H+浓度减小,铁离子水解生成Fe(OH)3沉淀,B项正确;由反应Cr2+6Fe2++14H+2C+6F+7H2O可知,处理过程中消耗H+,溶液的酸性减弱,溶液pH增大,C项错误;Fe-2e-Fe2+,则电路中每转移12 mol电子需要消耗6 mol Fe,再根据处理过程的反应方程式,得6Fe~12e-~6Fe2+~Cr2,故被还原的Cr2的物质的量为1 mol,D项正确。 7.D 由图可知,Li+向b极移动,则b极为阴极,电极反应式为2H2O+2e-2OH-+H2↑,由于b极生成OH-,故b极附近溶液的pH增大,A正确;a极为阳极,电极反应式为2H2O-4e-O2↑+4H+,B正确;S向a极移动,与a极产生的H+形成H2SO4,在b极上产生H2和LiOH,C正确;根据阴极反应式可知,电路中通过1 mol电子时,生成1 mol OH-,可得到1 mol LiOH,D错误。 8.D 电解池阴极发生还原反应,电解H2O、CO2混合气体制备H2和CO,阴极发生的反应有:H2O+2e-H2+O2-、CO2+2e-CO+O2-,A项正确;根据图示知,与X相连的电极发生还原反应产生CO和H2,故X为电源的负极,B项正确;根据图示可知,阴极产生H2、CO,阳极产生O2,总反应可表示为H2O+CO2H2+CO+O2,C项正确;根据总反应可知,阴、阳两极生成的气体的物质的量之比是2∶1,D项错误。 9.A 当电路中有3 mol e-通过时,阳极首先发生反应2Cl--2e-Cl2↑,有0.5 mol Cl2生成,后发生反应4OH--4e-O2↑+2H2O,生成2 mol H+,阴极首先发生Cu2++2e-Cu,析出1 mol Cu,后发生2H++2e-H2↑,此时溶液中生成1 mol OH-,最终溶液里得到1 mol H+,则c(H+)=1 mol·L-1,pH=0,故A正确,B错误;由溶液中电荷守恒可知:2c(Cu2+)+3c(A)=c(N)+c(Cl-),可求得c(N)=4 mol·L-1,即a=4,故C错误;根据阳离子放电顺序Cu2+>H+>A,可知没有Al生成,故D错误。 10.D 依据图示知左边装置是电解池,右边装置是原电池,a、b电极是电解池的电极,由电源判断a为阳极产生的气体是氧气,b为阴极产生的气体是氢气;c、d电极是原电池的正负极,c是负极,d是正极;电解池中的电极反应为:a电极为阳极失电子发生氧化反应:4OH--4e-2H2O+O2↑;b电极为阴极得到电子发生还原反应:4H++4e-2H2↑;原电池中是碱性溶液,电极反应为:c为负极失电子发生氧化反应:2H2-4e-+4OH-4H2O;d电极为正极得到电子发生还原反应:O2+2H2O+4e-4OH-。a为阳极,电解时阴离子向阳极移动,发生反应4OH--4e-2H2O+O2↑,促进水的电离生成H+,pH减小,故A项错误;根据上述分析,c是负极,故B项错误;右边装置中右管中的OH-通过隔膜向负极移动,即向c电极移动,d为正极,发生还原反应,故C项错误;b为阴极,当有1 mol电子转移时生成0.5 mol氢气,标准状况下的体积为11.2 L,故D项正确。 11.答案 (1)氧化 O2+4e-+2H2O4OH- (2)正 Cu+2FCu2++2Fe2+ (3)①正 Fe-2e-Fe2+ ②2Cu2++2H2O2Cu+O2↑+4H+ ③224 解析 (1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,正极发生还原反应,氧气得到电子被还原生成OH-,电极反应式为O2+4e-+2H2O4OH-。(2)铜可被F氧化,发生反应Cu+2FCu2++2Fe2+,形成原电池时,铜为负极,发生氧化反应,石墨为正极。(3)由题意知,甲池中石墨极为阴极,则铁极为阳极,乙池中铜作阴极,石墨作阳极。①铁极为阳极,电极反应式为Fe-2e-Fe2+,则M端为正极;②乙烧杯中用铜作阴极、石墨作阳极来电解硫酸铜溶液,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电析出铜,电解方程式为2Cu2++2H2O2Cu+O2↑+4H+;③取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则生成Cu的物质的量为=0.01 mol,转移电子的物质的量为0.01 mol×2=0.02 mol,甲烧杯中,阳极铁被氧化,阴极产生氢气, 2H2O+2e-2OH-+H2↑ 2 mol 22.4 L 0.02 mol V V==0.224 L,即224 mL。 12.答案 (1)碘酸钾 (2)加热 KCl KH(IO3)2+KOH2KIO3+H2O(或HIO3+KOHKIO3+H2O) (3)①2H2O+2e-2OH-+H2↑ ②K+ 由a到b ③产生Cl2易污染环境等 解析 (2)温度升高气体溶解度减小;Cl2被逐出,KH(IO3)2结晶析出,“滤液”中溶质主要是KCl;“调pH”目的是生成KIO3,所以选用KOH溶液,发生反应的化学方程式为KH(IO3)2+KOH2KIO3+H2O(或HIO3+KOHKIO3+H2O)。 (3)①阴极区电解质是KOH,被电解的是H2O:2H2O+2e-2OH-+H2↑; ②电解时,阳离子向阴极区移动,故K+由a向b迁移; ③“KClO3氧化法”中产生有毒气体Cl2,易污染环境。查看更多