- 2021-08-24 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习核心素养测评二十一电解池及其工作原理含解析新人教版
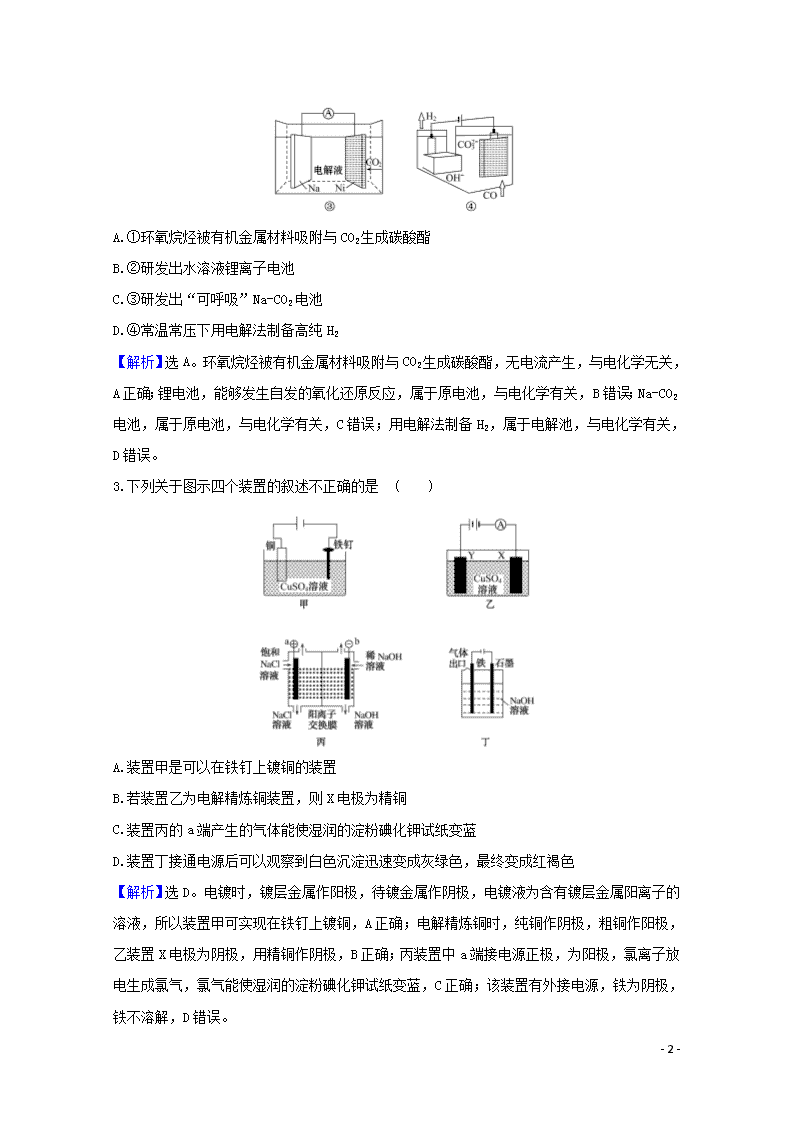
电解池及其工作原理 一、选择题(本题包括4小题,每题6分,共24分) 1.(双选)(2020·牡丹江模拟改编)我国青年学者孙旭平及其领衔团队,近日成功利用Mo2N纳米催化剂在0.1 mol·L-1盐酸溶液中进行电催化固氮,装置如图所示,在一定电压下具有较高的产氨速率。下列判断错误的是 ( ) A.Mo2N/GCE电极为阴极 B.溶液中H+通过隔膜向石墨电极区迁移 C.Mo2N/GCE电极区反应式为N2+6H++6e-2NH3 D.为提高溶液的导电性,可在石墨电极区加入适量的盐酸 【解析】选B、D。根据装置图,该装置具有外加电源,装置为电解池装置,左侧电极N2→NH3,N的化合价降低,根据电解原理,Mo2N/GCE为阴极,石墨为阳极,阴极反应式为N2+6H++6e-2NH3,阳极反应式为2H2O-4e-O2↑+4H+。根据上述分析,A说法正确;阳极反应式为2H2O-4e-O2↑+4H+,H+通过隔膜向Mo2N/GCE电极区迁移,B说法错误;根据图象,Mo2N/GCE电极上N2→NH3,该电极反应式为N2+6H++6e-2NH3,C说法正确;石墨电极区加入适量盐酸,Cl-在石墨电极上放电,产生Cl2,污染环境,D说法错误。 2.我国科技创新成果斐然,下列成果与电化学无关的是 ( ) - 9 - A.①环氧烷烃被有机金属材料吸附与CO2生成碳酸酯 B.②研发出水溶液锂离子电池 C.③研发出“可呼吸”Na-CO2电池 D.④常温常压下用电解法制备高纯H2 【解析】选A。环氧烷烃被有机金属材料吸附与CO2生成碳酸酯,无电流产生,与电化学无关,A正确;锂电池,能够发生自发的氧化还原反应,属于原电池,与电化学有关,B错误;Na-CO2电池,属于原电池,与电化学有关,C错误;用电解法制备H2,属于电解池,与电化学有关,D错误。 3.下列关于图示四个装置的叙述不正确的是 ( ) A.装置甲是可以在铁钉上镀铜的装置 B.若装置乙为电解精炼铜装置,则X电极为精铜 C.装置丙的a端产生的气体能使湿润的淀粉碘化钾试纸变蓝 D.装置丁接通电源后可以观察到白色沉淀迅速变成灰绿色,最终变成红褐色 【解析】选D。电镀时,镀层金属作阳极,待镀金属作阴极,电镀液为含有镀层金属阳离子的溶液,所以装置甲可实现在铁钉上镀铜,A正确;电解精炼铜时,纯铜作阴极,粗铜作阳极,乙装置X电极为阴极,用精铜作阴极,B正确;丙装置中a端接电源正极,为阳极,氯离子放电生成氯气,氯气能使湿润的淀粉碘化钾试纸变蓝,C正确;该装置有外接电源,铁为阴极,铁不溶解,D错误。 - 9 - 4.(2020年山东等级考模拟)工业上电解NaHSO4溶液制备Na2S2O8。电解时,阴极材料为Pb;阳极(铂电极)电极反应式为2HS-2e-S2+2H+。下列说法正确的是 ( ) A.阴极电极反应式为Pb+HS-2e-PbSO4+H+ B.阳极反应中S的化合价升高 C.S2中既存在非极性键又存在极性键 D.可以用铜电极作阳极 【解析】选C。Na2S2O8的结构为,由此结构可以判断出以下信息:S2中含硫氧极性键和氧氧非极性键;S的化合价仍为+6价,中间的两个O均为-1价,其他的O均为-2价;电解时阳极的HS中O失去电子,S未变价;阴极电极反应式为2H++2e-H2↑;若用铜作阳极,则阳极反应为Cu-2e-Cu2+,综上所述,答案为C。 二、非选择题(本题包括2小题,共26分) 5.(12分)电解原理在化学工业中有广泛的应用。如图所示为一电解池装置,U形管内装有电解液c,A、B是两块电极板,通过导线与直流电源相连。 (1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试剂,试判断: ①a电极是______极(填“正”或“负”),B电极是______极(填“阴”或“阳”); ②A电极上的电极反应式为__________________,B电极上的电极反应式为____________________; ③检验A电极上产物的方法是____________。 (2)若图示装置为用惰性电极电解CuSO4溶液的装置,其中阴极上析出Cu的质量为3.2 g,则阳极上产生的气体在标准状况下的体积为__________________; 常温下,若将电解后的溶液稀释至1 L,则溶液的pH约为______________。 - 9 - 【解析】(1)根据电流的方向可知,a电极为电源的正极,b电极为电源的负极。A电极为阳极,发生氧化反应2Cl--2e-Cl2↑,B电极为阴极,发生还原反应2H2O+2e-H2↑+2OH-。氯气可用湿润的淀粉碘化钾试纸检验。(2)用惰性电极电解CuSO4溶液时,阳极反应式为2H2O-4e-O2↑+4H+,阴极反应式为Cu2++2e-Cu,根据电子守恒可知,n(O2)=n(Cu)=×=0.025 mol,即标准状况下V(O2)=0.025 mol×22.4 L·mol-1=0.56 L;根据反应2CuSO4+2H2O2Cu+O2↑+2H2SO4可知,电解后溶液中n(H+)=4n(O2)=0.1 mol,所以c(H+)=0.1 mol·L-1,pH=1。 答案:(1)①正 阴 ②2Cl--2e-Cl2↑ 2H2O+2e-H2↑+2OH- ③把湿润的淀粉碘化钾试纸放在A电极附近,试纸变蓝,则证明A电极上的产物为氯气 (2)0.56 L 1 6.(14分)已知铅蓄电池的工作原理为Pb+PbO2+2H2SO42PbSO4+2H2O,现用如图装置进行电解(电解质溶液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。 (1)A是铅蓄电池的________极,Cu电极是________极。 (2)Ag电极的电极反应式是______________________,该电极的电极产物共________ g。 (3)Cu电极的电极反应式是____________, CuSO4溶液的浓度________ (填“减小”“增大”或“不变”)。 (4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示________。 a.各U形管中产生的气体的体积 b.各U形管中阳极质量的减少量 - 9 - c.各U形管中阴极质量的增加量 【解析】(1)当铅蓄电池中转移0.4 mol电子时铁电极的质量减小11.2 g,说明铁作阳极,银作阴极,阴极连接原电池负极,所以A是负极,B是正极,Cu是阳极,Zn是阴极。(2)银作阴极,电解稀硫酸时,阴极上H+放电生成H2,电极反应式为2H++2e-H2↑,生成氢气的质量= mol×2 g·mol-1=0.4 g。(3)Cu电极的电极反应式是Cu-2e-Cu2+,Zn电极上的反应式是Cu2++2e-Cu,Cu电极溶解的铜和Zn电极析出的铜相等,CuSO4溶液的浓度不变。(4)a.右边U形管不析出气体,左边U形管析出气体,故错误;b.当转移相等电子时,溶解金属的物质的量相等,铜的摩尔质量大于铁,所以右边U形管阳极减少的质量大于左边U形管阳极减少的质量,故正确;c.当转移相等电子时,析出物质的物质的量相等,但左边U形管析出氢气,阴极质量不变,故错误。 答案:(1)负 阳 (2)2H++2e-H2↑ 0.4 (3)Cu-2e-Cu2+ 不变 (4)b 一、选择题(本题包括3小题,每题6分,共18分) 1.(双选)乙醛酸 (HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法正确的是 ( ) A.M极与直流电源的正极相连 B.每得到1 mol乙醛酸将有2 mol H+从右室迁移到左室 C.N电极上的电极反应式:HOOC—COOH-2e-+2H+HOOC—CHO+H2O D.每消耗0.1 mol乙二醛在M电极生成2.24 L气体(标准状况) 【解析】选A、D。根据质子的移动方向,确定M电极是阳极,M极与直流电源的正极相连,故A正确;2 mol H+通过质子交换膜,则电池中转移2 mol电子,根据电极反应式 - 9 - HOOC—COOH+2e-+2H+HOOC—CHO+H2O,可知N极生成1 mol乙醛酸,由左极室发生反应:2Cl--2e-Cl2↑、Cl2+OHC—CHO+H2O2Cl-+ OHC—COOH+2H+可知,每消耗0.1 mol乙二醛转移电子0.2 mol,M电极上所得氯气的物质的量为0.1 mol,体积为2.24 L(标准状况),故D正确;由于两极均有乙醛酸生成,所以生成的乙醛酸为2 mol,故B、C错误。 2.现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。下列错误的是 ( ) A.M室发生的电极反应式:2H2O-4e-O2↑+4H+ B.N室:a查看更多
相关文章
- 当前文档收益归属上传用户