- 2021-08-24 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高一下学期化学人教版必修2教案 第二章第3节1
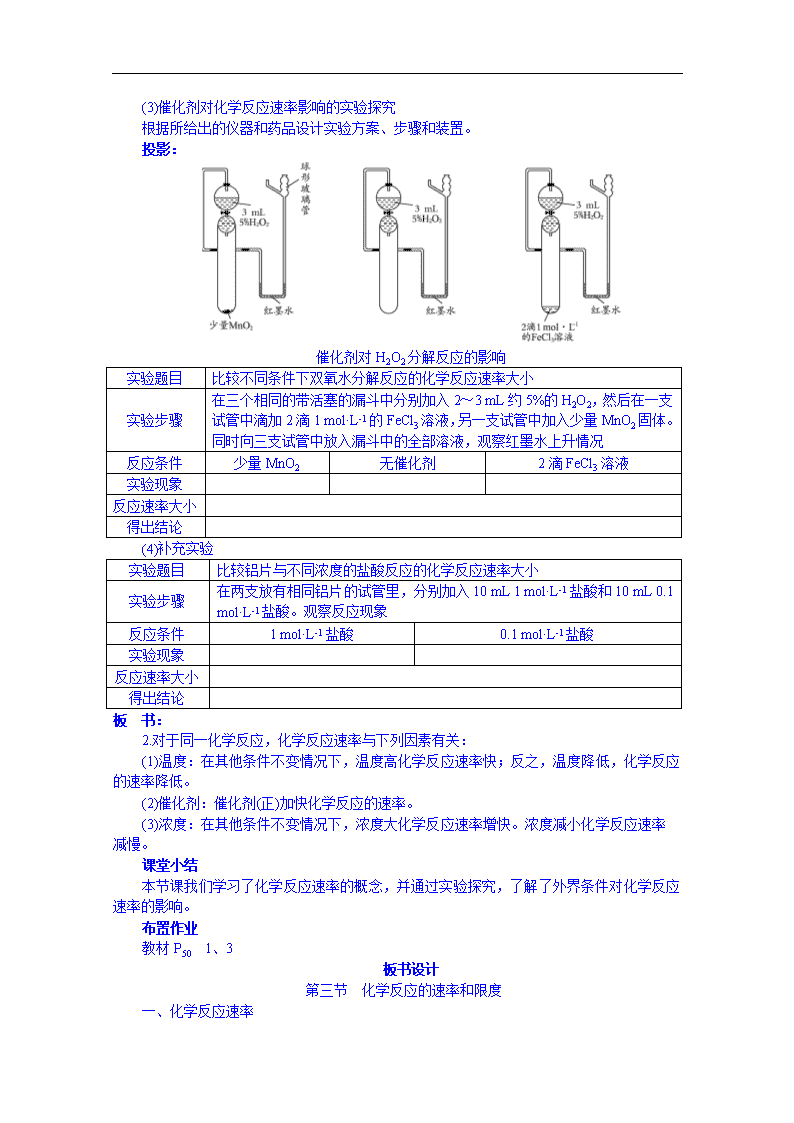
www.ks5u.com 第二章 化学反应与能量 第三节 化学反应的速率和限度 第一课时 教学过程 导入新课 播放投影片: 云龙陛石 北京的故宫是世界著名的古建筑群,是祖国珍贵的文化遗产。在保和殿后,有一块巨大的“云龙陛石”,上面雕有精美的蟠龙图案(如右图)。但是,近些年浮雕已开始受损,一些细小的花纹已变得模糊不清。在太和殿周围的玉石护栏的蟠龙柱以及吐水龙头上的花纹也不同程度地受到腐蚀。据统计,世界上的古建筑在本世纪所遭受的腐蚀比过去几百年甚至几千年所遭受的腐蚀还要严重,有的已面目全非。这真是一场大的灾难。造成这场灾难的元凶是什么呢?它就是我们在前面介绍过的酸雨。为什么以前几百年腐蚀很慢,而近几十年腐蚀却变快了呢?这就会涉及化学反应速率的问题。 师 同学们回忆在初中化学学习中有关化学反应速率的例子(或日常生活中有关的例子)。 生1 化石燃料的形成。 生2 钢铁生锈。 生3 煤窑的瓦斯爆炸。 生4 冰箱中的食物变质。 生5 森林火灾、岩石风化。 …… 师 很好。 不同的化学反应进行的快慢不一样,有的反应进行得很快,瞬间就能完成,例如,氢气和氧气混合气体遇火发生爆炸,酸、碱溶液的中和反应等;有的反应则进行得很慢,例如,有些塑料的分解要几百年,而石油的形成要经过亿万年等。这些都说明了不同的化学反应具有不同的反应速率。 板 书: 第三节 化学反应的速率和限度 推进新课 师 在初中物理课本上是怎样定义宏观物体的运动速度的呢?同学们想一想化学反应速率应该怎样衡量呢? 板 书: 一、化学反应速率 [学生自学] 阅读课本P43~P44 板 书: 1.化学反应速率是用来衡量化学反应进行的快慢程度的,通常用单位时间内反应 物浓度的减少或生成物浓度的增加来表示。浓度的单位常用 mol·L-1表示,化学反应速率的单位常用 mol·(L·min)-1或mol·(L·s)-1表示。 师 请举例说明化学反应速率的意义。 生 某反应物的浓度在1 min内减少了1 mol·L-1,则其化学反应速率为1 mol·(L· min)-1。又如,在某化学反应中,某一反应物B的初始浓度是2.0 mol·L-1。经过2 min后,B的浓度变成了1.6 mol·L-1,则在这2 min内B的化学反应速率为0.2 mol·(L· min)-1。 师 很好。 【演示实验25】 生 观察并完成下表 师 正确引导学生完成实验探究 投影: (1)反应原理探究 实验题目 双氧水分解反应 实验步骤 在一支试管中加入2~3 mL约5%的H2O2,然后滴加1~2滴1 mol·L-1的FeCl3溶液 待试管中产生大量气泡时,用带火星的火柴梗检验产生的气体 实验现象 用化学方程式 解释实验现象 思考问题 寻找答案 1.通过观察什么现象来判断该反应进行的快慢? 2.还有哪些其他办法观察该化学反应速率? 列出你对 问题的想法 (2)温度对化学反应速率影响的实验探究 根据所给出的仪器和药品设计实验方案、步骤和装置。如下图 温度对H2O2分解反应的影响 实验题目 比较不同温度下双氧水分解反应的化学反应速率大小 实验步骤 在三支相同的试管中分别加入2~3 mL约5%的H2O2,然后在每一支试管中滴加2滴1 mol·L-1的FeCl3溶液后立即套上气球(大小相同)。等三支试管上的气球大小差不多相同时,同时置于三个烧杯中观察现象 反应条件 热水 常温 冷水 实验现象 反应速率大小 得出结论 生 观察并完成上表格。 师 正确引导学生完成实验探究。 【演示实验26】 (3)催化剂对化学反应速率影响的实验探究 根据所给出的仪器和药品设计实验方案、步骤和装置。 投影: 催化剂对H2O2分解反应的影响 实验题目 比较不同条件下双氧水分解反应的化学反应速率大小 实验步骤 在三个相同的带活塞的漏斗中分别加入2~3 mL约5%的H2O2,然后在一支试管中滴加2滴1 mol·L-1的FeCl3溶液,另一支试管中加入少量MnO2固体。同时向三支试管中放入漏斗中的全部溶液,观察红墨水上升情况 反应条件 少量MnO2 无催化剂 2滴FeCl3溶液 实验现象 反应速率大小 得出结论 (4)补充实验 实验题目 比较铝片与不同浓度的盐酸反应的化学反应速率大小 实验步骤 在两支放有相同铝片的试管里,分别加入10 mL 1 mol·L-1盐酸和10 mL 0.1 mol·L-1盐酸。观察反应现象 反应条件 1 mol·L-1盐酸 0.1 mol·L-1盐酸 实验现象 反应速率大小 得出结论 板 书: 2.对于同一化学反应,化学反应速率与下列因素有关: (1)温度:在其他条件不变情况下,温度高化学反应速率快;反之,温度降低,化学反应的速率降低。 (2)催化剂:催化剂(正)加快化学反应的速率。 (3)浓度:在其他条件不变情况下,浓度大化学反应速率增快。浓度减小化学反应速率减慢。 课堂小结 本节课我们学习了化学反应速率的概念,并通过实验探究,了解了外界条件对化学反应速率的影响。 布置作业 教材P50 1、3 板书设计 第三节 化学反应的速率和限度 一、化学反应速率 1.化学反应速率是用来衡量化学反应进行的快慢程度的,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。浓度的单位常用mol·L-1表示,化学反应速率的单位常用mol·(L·min)-1或mol·(L·s)-1表示。 2.对于同一化学反应,化学反应速率与下列因素有关: (1)温度:在其他条件不变情况下,温度高化学反应速率快;温度降低,化学反应的速率降低。 (2)催化剂:催化剂(正)加快化学反应的速率。 (3)浓度:在其他条件不变情况下,浓度大化学反应速率增快。浓度减小化学反应速率减慢。 活动与探究 1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家。大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。近来由于大气中污染物(如冰箱制冷剂氟利昂CF2Cl2和汽车尾气中的氮氧化物等)不断增加使得臭氧层遭到破坏,从而造成对环境和生物的严重影响。产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应为 CF2Cl2CF2Cl+Cl NO2NO + O 因此 Cl原子或NO2分子能消耗大量的O3 Cl+O3ClO+O2 NO+O3NO2+ O2 ClO+OCl+O2 NO2+ONO + O2 总反应O3+O====2O2 总反应O3+O====2O2 在上述臭氧变成氧气的反应过程中,Cl和NO2起什么作用?应如何保护臭氧层? 第二课时 教学过程 根据化学方程式进行计算时,你是否考虑过这样的问题:一个化学反应在实际进行时,所有反应物能否完全(按照方程式中相应物质的量关系)转变成生成物,如果能,反应条件是什么?如果不能,原因是什么?解决这些问题的重要性是不言而喻的。例如在预知理论产率极低的情况下,就不必再耗费人力、物力和时间去进行探索性实验等。 第三节 化学反应的速率和限度 师:请同学阅读课本P44实验2-7,回答有关问题。 生:探究实验2-7:把1mol/l的 Na2SO4溶液逐滴加到3ml-4ml 的CaCl2溶液中,直到不再有沉淀产生为止。 反应现象是:白色沉淀产生。 离子反应方程式: Ca2+ + SO42+ = CaSO4↓ 生2:继续演示实验2-7:过滤,取澄清溶液与小试管中,加入适量的1mol/l的 Na2CO3溶液,可能的现象是:有白色的沉淀 CaCO3产生,或者没有沉淀产生。 [板书]二、化学反应限度 [学生自学]阅读课本P45页 可逆反应:在同一条件下,既能向正反应方向又能向逆反应方向进行的反应称可逆反应。 化学平衡 不同的平衡体系到达平衡状态时,反应限度不同。 例如 平衡体系1,Ca2+ + SO42- ==== CaSO4↓ 平衡体系2,Ca2+ +CO32- ==== CaCO3↓ [合作探究]炼铁高炉尾气之谜 三、化学反应的条件控制 在生产生活中,促进有利的化学反应发生,抑制有害的化学反应发生,这就要讨反应条件的控制。 阅读课本P46页 师:带领学生探究 A.建筑物定向爆破问题; B煤的燃烧条件问题。 ●原煤含S量:要求< 2%,否则SO2排放浓度会偏高; ●原煤粒度:要求≤ 40mm,且越均匀越好,但不能使用粉煤; ●炉膛 :耐高温; ●烟囱抽力要求有大于20%的富余能力,氧气要适当充足,等。 必要时查阅资料。 i通过实验探究,同学们了解:可逆反应、化学平衡、化学平衡状态、化学反应限度。 ii.控制反应条件可以使化学反应向有益的方向尽可能多、快地进行。 1.教材P48 T5、T6. 活动与探究 1.利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程 (1)按图2-7所示将实验装置连接好。 (2)向其中一个烧杯的水中投入一定量的CaO固体,CaO与水反应放热,此烧杯中的NO2平衡混合气体的红棕色变深。 查找资料:NO2平衡气体遇热颜色加深,遇冷颜色变浅的反应原理。查看更多