【化学】天津市河西区2020届高三总复习质量调查(一)
天津市河西区2020届高三总复习质量调查(一)
可能用到的相对原子质量:H 1 C 12 N 14 O 16
第Ⅰ卷
注意事项:
1.每题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
2.本卷共12题,每题3分,共36分。在每题给出的四个选项中,只有一项是最符合题目要求的。
1.下列关于化学与生产、生活的说法不正确的是( )
A.NH3可用作消毒剂 B.明矾可用作净水剂
C.Na2CO3可用于洗涤油污 D.铁粉可作为食品的抗氧化剂
2.下列说法正确的是( )
A.植物油氢化产物属于烃类
B.制作集成电路板的酚醛树脂可导电
C.石油经催化裂化与裂解可获得较多的气态烯烃等产品
D.鸡蛋清中滴加1%醋酸铅溶液产生的沉淀能重新溶于水
3.下列事实不能说明氯元素的非金属性比硫元素的非金属性强的是( )
A.还原性:S2- > Cl- B.水溶性:HCl > H2S
C.稳定性:HCl > H2S D.酸 性:HClO4 > H2SO4
4.下列有关84消毒液(主要成分是NaClO)的说法正确是( )
A.用石蕊试液可检验其溶液具有漂白性
B.敞口放置不会与空气中的CO2反应
C.该溶液呈中性,对皮肤没有刺激作用
D.可与洁厕灵(含盐酸)混合使用更安全有效
5.下列离子方程式或化学方程式正确的是( )
A.用CuSO4溶液除去乙炔中的H2S:S2-+ Cu2+ = CuS ↓
B.某种火箭发射逸出的N2O4变红棕色:N2O4 2NO2
C.Na2O2用于呼吸面具供氧:Na2O2+H2O = 2NaOH+O2↑
D.CuSO4溶液中加入过量氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
6.某元素原子价电子排布式为3d54s2,下列说法正确的是( )
A.该元素位于周期表ds区
B.该元素的最高化合价为 +5价
C.该元素位于第四周期第VB族
D.该元素的某些氧化物可用作催化剂
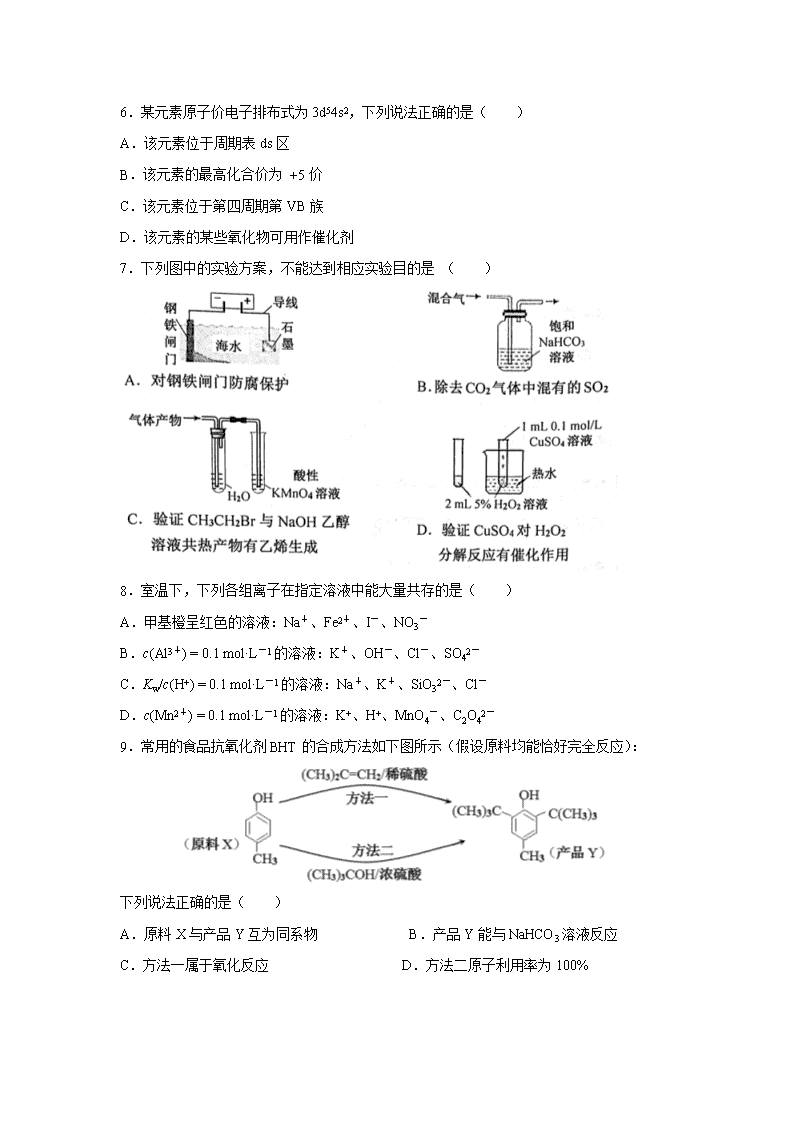
7.下列图中的实验方案,不能达到相应实验目的是 ( )
8.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.甲基橙呈红色的溶液:Na+、Fe2+、I-、NO3-
B.c(Al3+) = 0.1 mol·L-1的溶液:K+、OH-、Cl-、SO42-
C.Kw/c(H+) = 0.1 mol·L-1的溶液:Na+、K+、SiO32-、Cl-
D.c(Mn2+) = 0.1 mol·L-1的溶液:K+、H+、MnO4-、C2O42-
9.常用的食品抗氧化剂BHT的合成方法如下图所示(假设原料均能恰好完全反应):
下列说法正确的是( )
A.原料X与产品Y互为同系物 B.产品Y能与NaHCO3溶液反应
C.方法一属于氧化反应 D.方法二原子利用率为100%
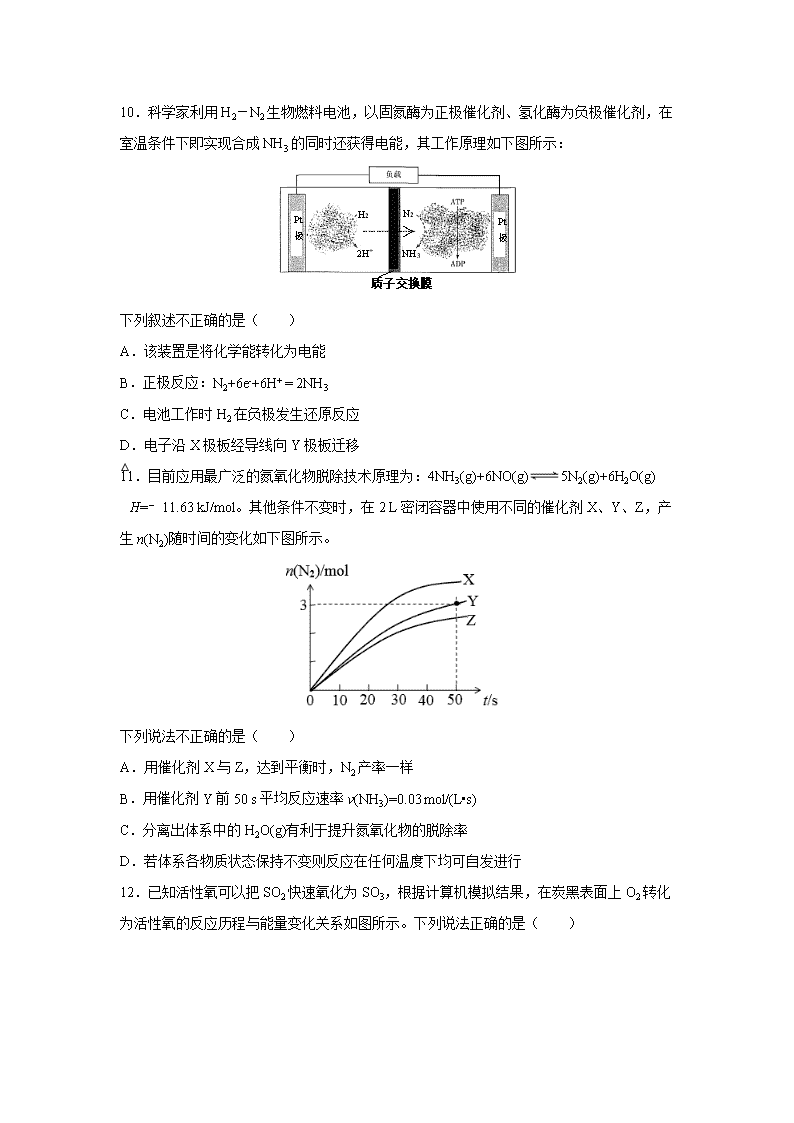
10.科学家利用H2-N2生物燃料电池,以固氮酶为正极催化剂、氢化酶为负极催化剂,在室温条件下即实现合成NH3的同时还获得电能,其工作原理如下图所示:
质子交换膜
Pt
极
X
Pt
极
Y
H2
2H+
N2
NH3
下列叙述不正确的是( )
A.该装置是将化学能转化为电能
B.正极反应:N2+6e-+6H+ = 2NH3
C.电池工作时H2在负极发生还原反应
D.电子沿X极板经导线向Y极板迁移
11.目前应用最广泛的氮氧化物脱除技术原理为:4NH3(g)+6NO(g)5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol。其他条件不变时,在2 L密闭容器中使用不同的催化剂X、Y、Z,产生n(N2)随时间的变化如下图所示。
下列说法不正确的是( )
A.用催化剂X与Z,达到平衡时,N2产率一样
B.用催化剂Y前50 s平均反应速率v(NH3)=0.03 mol/(L•s)
C.分离出体系中的H2O(g)有利于提升氮氧化物的脱除率
D.若体系各物质状态保持不变则反应在任何温度下均可自发进行
12.已知活性氧可以把SO2快速氧化为SO3,根据计算机模拟结果,在炭黑表面上O2转化为活性氧的反应历程与能量变化关系如图所示。下列说法正确的是( )
A.O2转化为活性氧与碳氧键生成无关
B.每活化1个O2分子最终吸收0.29 eV能量
C.该过程的最大能垒(活化能)E正 = 0.73 eV
D.炭黑可加快SO2转化为SO3的反应速率
第Ⅱ卷
注意事项:
1. 用黑色墨水的钢笔或签字笔将答案写在答题卡上。
2. 本卷共4题,共64分。
13.(14分)铁及铁的化合物在生活、生产中具有广泛应用,如亚铁氰化钾即K4[Fe(CN)6]是食盐中常用的抗结剂、铁基(氟掺杂镨氧铁砷化合物)是高温超导材料、“愚人金”是制备硫酸的主要矿物原料。请按要求回答下列问题。
(1)K4[Fe(CN)6]配合物中存在的作用力类型有__________________________(从“金属键”、“离子键”、“共价键”、“配位键”、“氢键”、“范德华力”中选填);其中CN-中各原子最外层均满足8电子稳定结构,其电子式为___________________,其中C原子的杂化形式是_____________。
(2)铁基化合物中氟、氧、砷三种元素中电负性值由大到小的顺序是_____________(填元素符号)。其中氢化物(RH3)的某种性能(M)随R的核电荷数的变化趋势如右图所示,则纵轴M可能表示为_____________________(从“沸点”、“稳定性”、“分子间作用力”、“R—H键能”中选填)。
M
核电荷数
NH3
PH3
AsH3
(3)FeCl3晶体熔点为306 ℃,而FeF3晶体熔点高于1000 ℃,试解释两种化合物熔点差异较大的原因:____________________________________________。
(4)结合下表数据,所得结论:I1(Cu)
I2(Fe)。请用所学理论解释:___________________________________________________________________________。
元素
Fe
Cu
第一电离能(I1) /kJ·mol-1
759
746
第二电离能(I2) /kJ·mol-1
1561
1958
(5)“愚人金”是铁硫化合物,其晶体的晶胞如上右图所示。该晶体的化学式为______________。
14.(18分)药物阿佐昔芬F主要用于防治骨质疏松症等。其合成路线如下:
请按要求回答下列问题:
(1)A中最多共平面的原子数目:________;C中所含官能团名称:_________;
C→D的反应类型______________。
(2)已知卤原子直接与苯环相连时碳卤键非常牢固,很难断键。写出D与NaOH水溶液加热条件下反应的化学方程式:________________________________________。
(3)试剂X的分子式为C7H8OS,写出X的结构简式:___________________。
(4)C的一种同分异构体M同时满足下列条件的所有可能的结构有(考虑顺反异构现象)_________种。
a.苯环上有两个取代基
b.能与FeCl3溶液发生显色反应
c.能使溴的四氯化碳溶液褪色
写出其中有4种不同化学环境氢原子的结构简式:_______________________。
(5)请写出以1-丙醇和氯苯为原料经四步制备的合成路线(其他试剂任选,合成路线示例见题干,有机物均写结构简式)。
_______________________________________________________________________。
15.(15分)制备水合肼(N2H4·H2O)的反应原理是CO(NH2)2+ 2NaOH + NaClO=== Na2CO3+N2H4·H2O+NaCl。已知CO(NH2)2沸点:133 ℃;水合肼是重要化工原料,沸点:118 ℃,易被氧化。请按要求回答下列制备水合肼实验的有关问题。
(1)制备 NaClO 溶液(实验装置如右图所示)
锥形瓶中发生反应离子方程式是__________________________。
(2)制取水合肼(实验装置如右图所示,夹持装置已略)
控制反应温度,再将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应后,加热蒸馏三颈烧瓶内的溶液,收集产品。
①分液漏斗中盛装的药品是NaOH溶液和_______________。 这样盛放的理由是防止___________________________________。
②本实验收集产品馏分时的关键条件是控制_______________________________。
(3)测定馏分中肼的含量。
①已知水合肼在一定条件下与I2反应生成N2,完成该反应原理的化学方程式:
②测定实验的步骤如下:
a.称取馏分 5.000 g,加水配制成1000 mL待测液溶液。
b.移取10.00 mL于锥形瓶中,加入10 mL水、稀硫酸、适量 NaHCO3固体(保证滴定过程中溶液的 pH 保持在 6.5左右)、2滴淀粉溶液,摇匀。
c.用0.2000 mol/L I2溶液滴定,至溶液呈现___________________________,记录消耗I2标准液的体积。
d._______________________________;然后处理数据。
③经数据处理,滴定消耗I2的标准溶液为 8.20 mL,馏分中水合肼(N2H4·H2O)的质量分数为____________。
16.(17分)随着化工产业的迅猛发展,氯化氢转化为氯气的技术成为科学研究的热点。请按要求回答下列问题:
(1)HCl直接氧化法制Cl2可按下列催化过程进行:
CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1 = +83 kJ·mol-1
CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2 = -20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3 = -121 kJ·mol-1
写出HCl直接氧化法制Cl2的热化学方程式:
___________________________________________________________________________。
(2)在恒定容器中用上述HCl直接氧化法制Cl2,进料c(HCl) ∶c(O2)分别为1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如下图所示:
①判断图中c(HCl) /c(O2) = 1:1的曲线为________。
②按化学计量系数比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料时c(HCl)/c(O2)过低、过高的不利影响分别是__________________________________、
__________________________________。
③综合上述信息,写出在一定温度的条件下进一步提高HCl的转化率的方法:
________________________________________。
④观察上图,以任何一条曲线为例,平衡常数K(200℃)________K(300℃)(填“大于”、“小于”或“等于”)。
⑤设O2初始浓度为c,计算L2对应K(300℃) =____________(列出含c的计算式)。
(3)科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
①电源b极为____________极。
②写出阳极区域反应方程式:________________________________________。
③电路中转移1 mol电子时,阳极产生气体体积为__________________L(标准状况)。
【参考答案】
第I卷(选择题 共36分)
本卷包括12小题,1—12每小题3分,共36分。
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
A
C
B
A
B
D
D
C
A
C
B
D
第II卷(非选择题 共64分)
13.(14分)
(1)离子键、共价键、配位键(3分) (1分) sp杂化(1分)
(2) F>O>As(1分) 稳定性、R—H键能(2分)
(3)F比Cl的电负性大,FeF3为离子晶体,FeCl3为分子晶体(合理即可得分,2分)
(4)主要原因是Cu电子排布式为[Ar]3d104s1,失去一个电子变为[Ar]3d10,此时3d能级全满,能量较低,此时再失去第二个电子即3d10中的1个电子所需能量较大(或Fe电子排布式为[Ar]3d64s2,失去一个电子变为[Ar]3d64s1,此时再失去第二个电子即4s1中的电子所需能量较小)(合理即可给分,2分)
(5)FeS2(2分)
14.(18分)
(1)6(2分) 溴原子、羰基(2分) 取代反应(2分)
(2)(2分)
(3)(2分)
(4)9 (2分) (2分)
(5)
15.(15分)
(1)Cl2 + 2OH―= ClO― + Cl― + H2O(2分)
(2)①NaClO溶液(2分)
生成的水合肼会被未反应的次氯酸钠氧化(2分)
②温度计A为118 ℃(2分)
(3)① 1 2 1 4 (2分)
②蓝色且半分钟不消失(1分,合理即可给分)
重复上述b、c步骤实验操作2~3次(2分,合理即可给分)
③82.00%(2分)
16.(17 分)
(1)4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH = −116 kJ·mol-1(3分)
(2)①L1(1分)
②O2和Cl2分离能耗较高(1分,合理即可给分)
HCl转化率较低(1分)
③增加反应体系压强或及时分离出产物(1分,合理即可给分)
④大于(2分)
⑤ (2×0.88)4/[44(1−0.88)4(1−0.88)c] (其他合理答案均可给分,2分)
(3)①正(2分)
②2HCl−2e−=Cl2↑+2H+(2分)
③11.2 (2分)