- 2021-08-24 发布 |
- 37.5 KB |
- 15页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
安徽省六安市毛坦厂中学2020届高三下学期假期化学作业2
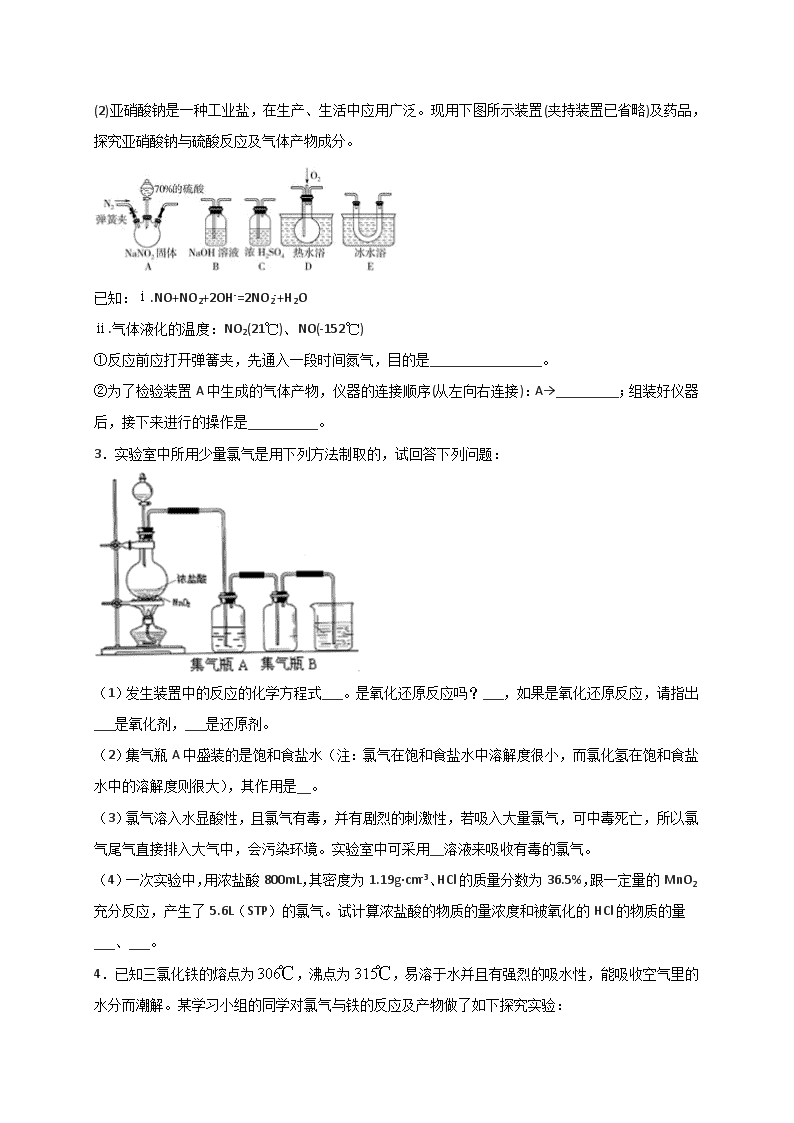
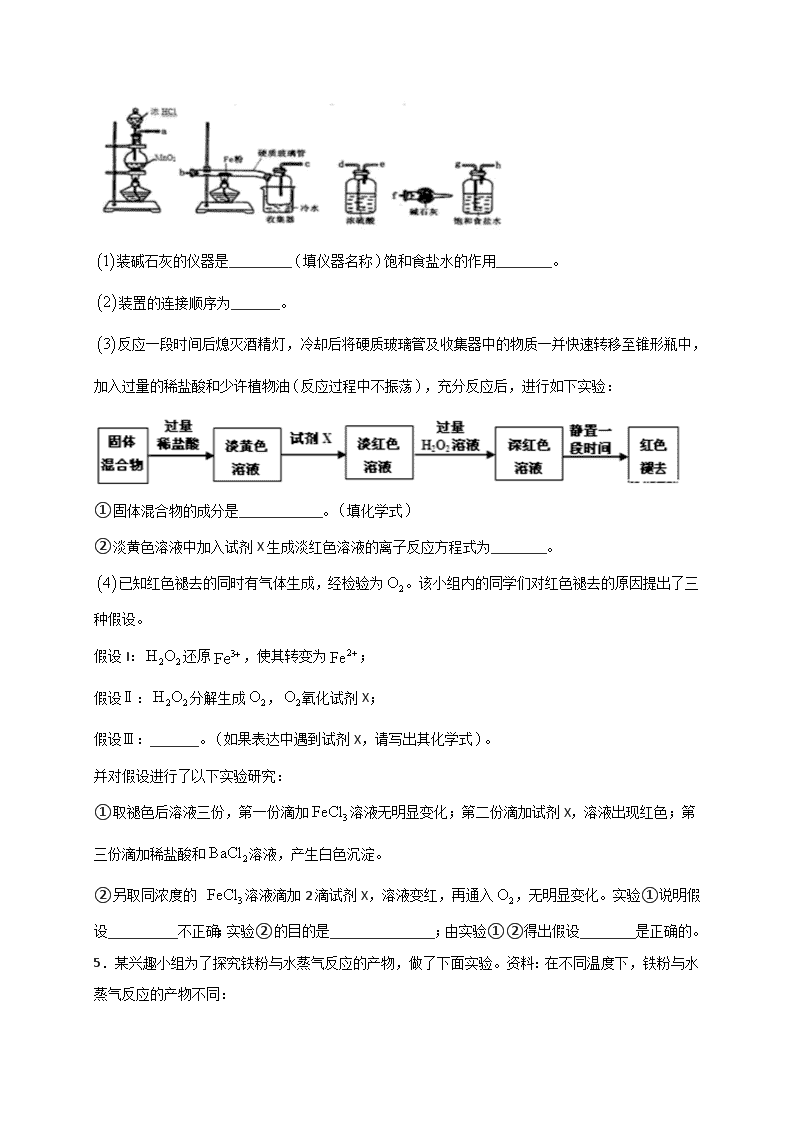
一、实验题 1.铁及其化合物在生产和生活中有着广泛的应用。 (1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题: ①操作Ⅰ、Ⅱ的名称分别是____、____。 ②写出在空气中煅烧FeCO3的化学方程式__________________; ③煅烧如果不充分,产品中将有Fe2+存在,试设计实验检验产品中有无Fe2+______。 (2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;量取25.00mL待测溶液于锥形瓶中;用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。 ①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式_________________________ ②计算上述样品中FeSO4·7H2O的质量分数为__________________[已知M(FeSO4·7H2O)=278g/mol] ③滴定达到终点时锥形瓶中溶液颜色变化为______________________________ ④下列操作会导致样品中FeSO4·7H2O的质量分数的测定结果偏高的有_____________。 a.未干燥锥形瓶 b.盛装标准液的滴定管没有用标准液润洗 c. 滴定终点时滴定管尖嘴中产生气泡 d.量取待测液,视线注视刻度时开始平视、结束俯视 2.(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。 ①仪器a的名称为_________,仪器b中装入的试剂可以是___________。 ②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。 (2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。 已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃) ①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。 ②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。 3.实验室中所用少量氯气是用下列方法制取的,试回答下列问题: (1)发生装置中的反应的化学方程式___。是氧化还原反应吗?___,如果是氧化还原反应,请指出___是氧化剂,___是还原剂。 (2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是__。 (3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用__溶液来吸收有毒的氯气。 (4)一次实验中,用浓盐酸800mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,跟一定量的MnO2充分反应,产生了5.6L(STP)的氯气。试计算浓盐酸的物质的量浓度和被氧化的HCl的物质的量___、___。 4.已知三氯化铁的熔点为,沸点为,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验: 装碱石灰的仪器是_________填仪器名称饱和食盐水的作用________。 装置的连接顺序为_______。 反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油反应过程中不振荡,充分反应后,进行如下实验: ①固体混合物的成分是____________。填化学式 ②淡黄色溶液中加入试剂X 生成淡红色溶液的离子反应方程式为________。 已知红色褪去的同时有气体生成,经检验为。该小组内的同学们对红色褪去的原因提出了三种假设。 假设I:还原,使其转变为; 假设Ⅱ:分解生成,氧化试剂X; 假设Ⅲ:_______。如果表达中遇到试剂X,请写出其化学式。 并对假设进行了以下实验研究: ①取褪色后溶液三份,第一份滴加溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和溶液,产生白色沉淀。 ②另取同浓度的 溶液滴加2滴试剂X,溶液变红,再通入,无明显变化。实验①说明假设__________不正确;实验②的目的是_______________;由实验①②得出假设________是正确的。 5.某兴趣小组为了探究铁粉与水蒸气反应的产物,做了下面实验。资料:在不同温度下,铁粉与水蒸气反应的产物不同: Fe +H2OFeO+H2 ;3Fe + 4H2OFe3O4 + 4H2 实验一:某兴趣小组用如图所示装置,使铁粉与过量水蒸气充分反应并检验固体产物的组成。 (1)实验过程中,应先点燃_______(选填“酒精灯”或“酒精喷灯”);目的是________,装置中石棉绒的作用是________。 (2)若在实验中的某段时间内生成0.2g H2,则这段时间内参加反应的铁粉质量至少是_____g。 实验二:铁粉完全反应后,兴趣小组对硬质玻璃管中生成的FeO和Fe3O4的质量进行测定,实验流程如图: (1)实验前检查装置A的气密性:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差_____,则气密性良好。 (2)装置A中发生的反应方程式_______。 (3)为了安全,在点燃酒精灯之前,在F装置出口b处必须_______。 (4)装置C中所放试剂为______,装置B的作用是_______。 (5)干燥管E右边又连接干燥管F的目的是______。若无干燥管F,测得Fe3O4的质量将____(填“偏大”、“偏小”或“无影响”)。 6.工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动。 (探究一) (1)甲同学将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________。 (探究二) (2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为________。 分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略): (3)装置B中试剂的作用是________。 (4)认为气体Y中还含有Q的理由是_____________________(用化学方程式表示)。 (5)为确认Q的存在,需在装置中添加M于________(选填序号)。 a.A之前 b.A—B间 c.B—C间 d.C—D间 (6)如果气体Y中含有H2,预计实验现象应是_________________。 7.将所列仪器组装为一套实验室蒸馏石油的装置并进行蒸馏,可得到汽油和煤油。 (1)图中A、B、C三种仪器的名称分别是:A、______;B、______;C、______。 (2)将以上仪器按(一)→(六)顺序,用字母a,b,c…表示连接顺序: e接____;h接____;k接l;b接____;____接____。 (3)A仪器中的c口用于______,d口用于______。 (4)蒸馏时,温度计水银球的位置应在________________。 (5)在B中注入原油后,加几片碎瓷片的目的是________________。 (6)给B加热,收集到沸点为60℃~150℃间的馏分是______,收集到150℃~300℃间的馏分是______。 8.某化学课外小组用海带为原料制取少量碘。其实验操作可分解为如下几步 A.将海带灼烧成灰 B.______________ C.使用新制氯水置换出碘单质,反应方程式:Cl2+2KI=2KCl+I2 D. 萃取 E.得到固体碘 回答下列问题 (1)写出步骤A中需要的仪器_______。 (2)步骤B的实验操作名称_________。 (3)步骤D中向分液漏斗中加入苯作萃取剂后,如何操作可使两种溶液充分接触,_______;碘进入______层液体,颜色为________。 (4)步骤E中得到固体碘,还需要的仪器为______。 A. B. C.D. 参考答案 1.过滤 洗涤 4FeCO3+O22Fe2O3+4CO2 取固体样品少许放置试管中,加入足量稀硫酸,振荡试管,再加入几滴KMnO4溶液。如果溶液褪色,则有Fe2+ 5Fe2++MnO4-+8H+=Fe3++2Mn2++4H2O 0.9754 溶液由浅绿色变成紫红色,且半分钟内不立即退去 b d 【解析】 【分析】 (1)铁屑用碳酸钠溶液洗去油污后,加入稀硫酸充分反应,得到FeSO4溶液,过滤除去杂质,滤液即FeSO4溶液中加入稍过量的NH4HCO3溶液,得到FeCO3沉淀,然后经过滤、洗涤、干燥、煅烧得到产品铁红。 (2)用高锰酸钾溶液滴定测定绿矾中铁元素的含量,根据高锰酸钾和绿矾中的+2价铁发生的氧化还原反应以及所用的高锰酸钾的物质的量,即可计算绿矾中铁元素的物质的量。 【详解】 (1)①操作I后得到滤渣和滤液,所以应为过滤,沉淀干燥前应先洗涤除去杂质。 ②+2价铁在空气中加热易被氧化为+3价,即Fe2O3,发生反应的化学方程式为4FeCO3+O22Fe2O3+4CO2。 ③检验Fe2+可以选用氧化剂,为了使现象更加明显可选用KMnO4,两者发生反应后高锰酸钾溶液的紫色会褪去。 (2)①酸性KMnO4溶液与FeSO4溶液发生氧化还原反应,反应的离子方程式为5Fe2++MnO4-+8H+=Fe3++2Mn2++4H2O; ②n(KMnO4)=0.01000mol/L×0.02000L=2.000×10-4mol,根据反应的方程式可知:n(Fe2+)=5 n(KMnO4)=1.000×10-3mol,由于配制的是250mL溶液,取出25mL,故2.850g绿矾中FeSO4·7H2O的物质的量为1.000×10-2mol,所以样品中FeSO4·7H2O的质量分数为=0.9754。 ③滴定达到终点时,Fe2+被消耗完,滴入溶液的KMnO4溶液的颜色不退去,故答案为:溶液由浅绿色变成紫红色,且半分钟内不立即退去; ④a项,锥形瓶内有水对结果无影响,b项,滴定管未润洗相当于将标准液稀释,所用标准液体积增大,故结果偏高;c项,终点时产生气泡,读取体积偏小,结果偏低;d 项,取待测液结束时俯视导致所取待测液体积偏大,消耗标准液体积偏大,结果偏高。故选bd。 2.分液漏斗 NaOH或生石灰或碱石灰 BDADC 排出装置中的空气,防止干扰NO的检验 CEDB 检查装置的气密性 【解析】 【分析】 (1)①根据仪器的结构判断仪器名称,仪器b中加入的是氢氧化钠固体或碱石灰,能够吸收水蒸气; ②从发生装置中出来的氨气带有水蒸气,必须干燥,故B接D,D接A,吸收反应生成的水用装置D,最后多余的氨气用装置C吸收; (2)①NO易遇空气中的氧气反应生成二氧化氮; ②根据各部分装置的作用进行连接。有气体参与或生成的反应装置,实验前通常需要检验气密性; 【详解】 (1)通过测量生成水的质量来测定M的相对原子质量,a中试剂是浓氨水。 ①仪器a名称为分液漏斗,用来盛放和滴加液体,a中试剂是浓氨水,仪器b中加入的是氢氧化钠固体或碱石灰,滴入浓氨水固体溶解放热使一水合氨分解生成氨气; ②从发生装置中出来的氨气带有水蒸气,必须先进行干燥,又NH3的水溶液显碱性,因此要使用碱性干燥剂碱石灰干燥氨气,故B接D,干燥后的氨气在装置A中与MxOy发生氧化还原反应,得到N2和H2O,所以D接A,再通过碱石灰的U型管吸收反应生成的H2O蒸气,这时的气体中含有未完全反应的氨气,不能直接排入大气,要通过盛有浓硫酸的C装置吸收氨气后再排入大气,所以还需要装置C,故按气流方向正确的装置连接顺序为BDADC; (2)①反应前应打开弹簧夹,先通入一段时间氮气,目的是排出装置中的空气,防止反应产生的NO被装置中空气中含有的氧气氧化产生NO2,干扰NO的检验; ②装置A中反应制取NO、NO2的混合气体,装置C吸收水蒸气,E冷却NO2,使其转化为无色的N2O4,利用D检验NO,NO、NO2都是大气污染物,不能直接排入大气,利用二者能够与NaOH溶液反应的性质,利用装置B进行尾气处理,防止污染空气,所以装置的连接为A→C→E→D→B,组装好仪器后,接下来进行的操作实验是检查装置气密性。 【点睛】 本题考查了有气体参加反应的仪器的使用、装置的连接顺序等知识。对实验原理的理解、对实验过程、实验现象的正确分析和应用,掌握基础是解题关键。对于探究亚硝酸钠和稀硫酸反应生成气体的成分,难点在于NO2的存在对NO的检验有干扰,所以检验NO2后要排除NO2气体再检验NO,特别注意的是NO2能与水反应生成NO,因此气体需要干燥,考虑到氮氧化物对环境有污染,还需要用NaOH溶液吸收进行尾气处理。 3.4HCl(浓)+MnO2Cl2↑+MnCl2+2H2O 是 MnO2 HCl 除去氯气中混有的HCl气体 浓氢氧化钠(浓碱) 11.9mol/L 0.5mol 【解析】 【分析】 (1)根据化学反应中元素的化合价变化来分析,含有元素化合价升高的物质为还原剂; (2)根据氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度很大来分析; (3)根据氯气能与碱反应来分析尾气的处理; (4)利用c=来计算浓度,再利用氧化还原反应可知,生成1mol氯气,则有2mol的HCl被氧化来计算。 【详解】 (1)在反应4HCl(浓)+MnO2Cl2↑+MnCl2+2H2O中,Mn元素的化合价由+4价降低为+2价,则MnO2为氧化剂,Cl元素的化合价由-1价升高到0,则HCl为还原剂,故答案为:4HCl(浓)+MnO2Cl2↑+MnCl2+2H2O;是;MnO2;HCl; (2)因氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度很大,且浓盐酸易挥发,使生成的氯气中混有HCl,则饱和食盐水的作用为除去氯气中混有的HCl气体, 故答案为:除去氯气中混有的HCl气体; (3)因氯气有毒,不能排放在环境中,且氯气能被碱吸收,则可利用浓氢氧化钠(浓碱)来处理尾气, 故答案为:浓氢氧化钠(浓碱); (4)浓盐酸800mL,其密度为1.19g•cm-3、HCl的质量分数为36.5%,则浓盐酸的物质的量浓度是c===11.9mol/L, 由4HCl(浓)+MnO2Cl2↑+MnCl2+2H2O可知,氯气是氧化产物,1mol氯气生成,则有2mol的HCl被氧化, 则被氧化的HCl的物质的量为×2=0.5mol, 答: 11.9mol/L;0.5mol. 4.球形干燥管 除去氯气中的氯化氢气体 ,FeCl3 3 氧化KSCN I 证明假设II不成立 III 【解析】 【分析】 (1)根据装置图判断仪器名称;制取的氯气中混有HCl,需要用饱和食盐水除去; (2)排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理; (3)①铁离子与硫氰根离子变红,加入过量双氧水溶液颜色变深,说明铁离子浓度增大; ②根据Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色; (4)假设Ⅲ:自身就是一种强氧化剂,可能会将硫氰化钾氧化; ②根据②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-。 【详解】 (1)装碱石灰的仪器是球形干燥管;浓盐酸易挥发,制取的氯气中会混有HCl气体,需要用饱和食盐水除去氯气中的氯化氢气体; (2) 浓硫酸具有吸水性能作氯气干燥剂、碱石灰具有碱性而吸收氯气、饱和食盐水吸收氯化氢而抑制氯气溶解,装置排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理,所以装置连接顺序为:aghdebcf; (3)固体混合物加入过量稀盐酸后得到淡黄色溶液,可知含,试剂X是KSCN溶液,淡红色溶液,加入后颜色加深,证明浓度增大,证明溶液中存在,由此可知,固体混合物中可能含Fe、 ;和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,反应方程式为; (4)溶液中有和,还有,红色褪去,可能是X消耗了,也可能是消耗了,故假设Ⅲ为氧化KSCN;实验①说明假设Ⅰ 不正确,如果红色褪去是因为三价铁离子的原因,加入溶液应该红色复原,没有变化,证明不是的原因;实验②的目的是证明假设Ⅱ不成立,如果通入氧气,红色复原,证明假设 Ⅱ成立,结果没有变化,则说明Ⅱ不成立;由实验①②得出假设Ⅲ是正确的。 5.酒精灯 先产生水蒸气,排尽空气 增大铁粉与水蒸气接触面积 4.2 不变 Zn+2HCl=ZnCl2+H2↑ 验纯 浓硫酸 除去HCl气体 防止空气中的二氧化碳和水被E吸收 偏大 【解析】 【分析】 实验一: (1)铁能与空气中的氧气发生反应,先加热酒精灯利用生成的水蒸气排除装置中的空气;装置中石棉绒可以增大水蒸气与铁粉的接触面积; (2)分析两个反应可知产生四氧化三铁需要的铁少,因此可依据3Fe+4H2O(g) Fe3O4+4H2 ,由氢气的质量求出需要铁的质量; 实验二: 利用装置A制备氢气,加入药品反应可以随时进行随时停止,通过装置B除去挥发出的氯化氢气体,通过装置C中的浓硫酸干燥氢气,通过装置D还原铁的氧化物得到金属铁和水蒸气,通过装置E吸收生成的水蒸气,最后连接装置F是为了避免空气中的二氧化碳和水蒸气进入装置E影响测定结果。 (1)根据检验气密性的方法进行分析解答; (2)根据锌和盐酸反应产生氯化锌和氢气写出反应的方程式; (3)根据氢气容易发生爆炸分析使用注意事项; (4)根据产生的氢气会混有杂质,要进行除杂、干燥分析装置的作用; (5)根据碱石灰会吸收空气中的二氧化碳和水蒸气导致E装置质量增大,会使测定的水多,影响实验的测定分析。 【详解】 实验一: (1) 铁能与空气中的氧气发生反应,因此为了排除氧气的干扰,先加热酒精灯利用生成的水蒸气排除装置中的空气;装置中石棉绒可以增大水蒸气与铁粉的接触面积,故答案为:酒精灯;先产生水蒸气,排尽空气;增大铁粉与水蒸气的接触面积; (2)设生成0.2g氢气至少需要铁的质量为x,则有 3Fe+4H2O(g)Fe3O4+4H2 168 8 x 0.2g 则,解得x=4.2g,故答案为:4.2; 实验二: (1)检查A装置气密性的方法:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,形成的液柱不下降,即液面高度差不变,则气密性良好;故答案为:不变; (2)锌和盐酸反应产生氯化锌和氢气,故反应的方程式为:Zn+2HCl=ZnCl2+H2↑; (3)因为氢气在点燃时容易发生爆炸,为了安全,在点燃酒精灯之前,在F装置出口b处必须验纯;故答案为:验纯; (4)产生的氢气会混有氯化氢和水蒸气,因此要先通过水除去氯化氢,再通过浓硫酸除去水蒸气;故答案为:浓硫酸;除去HCl气体; (5) 干燥管E右边又连接干燥管F的目的是:防止空气中的二氧化碳和水被E吸收;若无干燥管F,E中碱石灰会吸收空气中的二氧化碳和水蒸气导致E装置质量偏大,会使测定生成的水偏大,测得Fe3O4的质量将偏大;故答案为:防止空气中的二氧化碳和水被E吸收;偏大。 6.铁钉表面被钝化 66.7% 检验SO2是否除尽 C+2H2SO4(浓)CO2↑+2SO2↑+2H2O c D中固体由黑变红和E中固体由白变蓝 【解析】 【详解】 (1)铁钉放入冷硫酸中,浓硫酸有较强的氧化性能使铁钉钝化导致铁钉表面有一层氧化膜,而氧化膜与硫酸铜不反应,所以将钝化后的铁钉移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显现象,其原因是铁钉表面被氧化; (2)铁与浓硫酸加热反应生成硫酸铁,二氧化硫和水,二氧化硫具有还原性,通入足量溴水中,发生反应SO2+Br2+2H2O=2HBr+H2SO4,反应生成的硫酸遇到氯化钡会产生白色沉淀BaSO4,生成的二氧化硫的物质的量为0.336L÷22.4L/mol=0.015mol;根据硫原子守恒,设SO2的物质的量为n,则 n=0.01mol,所以二氧化硫的体积分数为0.01mol÷0.015mol×100%=66.7%; (3)装置A的作用是除去二氧化硫,二氧化硫能使品红溶液褪色,则装置B中试剂的作用是检验二氧化硫是否除尽。 (4)在加热时,铁钉中不仅铁和浓硫酸反应,碳也和浓硫酸反应生成生成二氧化硫、二氧化碳和水,反应方程式为C+2H2SO4CO2↑+2SO2↑+2H2O; (5)Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,选择a或b受二氧化硫的影响无法判断二氧化碳的存在,选d时二氧化碳被碱石灰吸收,所以只能选c; (6)氢气还原氧化铜会生成水蒸气,水蒸气能使白色的硫酸铜粉末变蓝色,同时有红色的铜单质生成,则若Y中含有氢气,实验现象是D中固体由黑色变红和E中固体由白变蓝。 7.冷凝管 蒸馏烧瓶 锥形瓶 i a f g w 进水 出水 蒸馏烧瓶支管口 防止暴沸 溶剂油和汽油 煤油 【解析】 【分析】 (1)根据装置图判断仪器名称; (2)按实验要求和目的组装实验仪器; (3)冷凝水应是下进上出; (4)温度计测量的是蒸气的温度; (5)加几片碎瓷片的目的是防止暴沸; (6)汽油的沸点为60℃~150℃间,煤油的150℃~300℃间。 【详解】 (1)根据装置图可知,A是冷凝管,B是蒸馏烧瓶,C是锥形瓶, 故答案为冷凝管;蒸馏烧瓶;锥形瓶; (2)根据蒸馏装置图(如下)可知,仪器连接顺序为:e接i;h接a;k接l;b接f;g接w, 故答案为i;a;f;g;w; (3)冷凝水应是下进上出,延长热量交换时间,使热量能更充分吸收,故A仪器中的c口用于进水,d口用于出水, 故答案为进水;出水; (4)温度计测量的是蒸气的温度,故应放在蒸馏烧瓶支管口, 故答案为蒸馏烧瓶支管口; (5)为防止烧瓶内液体受热不均匀而局部突然沸腾(暴沸)冲出烧瓶,需要在烧瓶内加入几块沸石。故加几片碎瓷片的目的是防止暴沸, 故答案为防止暴沸; (6)汽油的沸点为60℃~150℃间,煤油的150℃~300℃间,故收集到沸点为60℃~150℃间的馏分是为溶剂油和汽油,收集到150℃~300℃间的馏分是煤油, 故答案为溶剂油和汽油;煤油。 8.坩埚、坩埚钳、三角架(或带铁圈的铁架台)、泥三角、酒精灯 溶解、过滤 盖好玻璃塞,倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正,静置、分层 上 紫红 D 【解析】 【分析】 灼烧海带时用坩埚盛放海带,用三角架和泥三角上放置坩埚,用酒精灯进行加热,海带灼烧→海带灰→加水溶解、过滤→滤液中通入氯气→液体装入到分液漏斗中,并加入苯→盖上玻璃塞,振荡、静置、分层→分液→蒸馏得到碘固体。据此解答。 【详解】 (1)灼烧海带时用坩埚盛放海带,用三角架和泥三角上放置坩埚,用酒精灯进行加热,故将海带灼烧成灰需要用到的仪器有:坩埚、坩埚钳、三角架(或带铁圈的铁架台)、泥三角、酒精灯; (2)将海带灰加水溶解得到海带灰的悬浊液,然后过滤; (3)步骤D中向分液漏斗中加入苯作萃取剂后,盖好玻璃塞,倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正,静置、分层;苯的密度比水的密度小,并且碘在苯中的溶解度大于苯在水中的溶解度,因此碘进入上层苯液中,上层液体呈紫红色; (4)因为碘单质与苯互溶,且苯与碘的沸点不同,所以采用蒸馏的方式得当碘,蒸馏操作时,温度计放在蒸馏烧瓶支管口处。A是过滤操作,用于分离固体与液体互不相溶的物质,此操作不能从碘的苯溶液中得到碘固体,A错误;B是分离两种互不相溶的液体,此操作不能从碘的苯溶液中得到碘固体,B错误;C是蒸馏操作中用直形冷凝管,不能用球形冷凝管,并且温度计放在蒸馏烧瓶支管口处,C错误;D装置可以从碘的苯溶液中得到碘固体,D正确;答案选D。查看更多