2017-2018学年河北省定州中学高二上学期期末考试化学试题 Word版
河北定州中学2017—2018学年度第一学期期末考试
高二年级 化学试卷
一、单选题
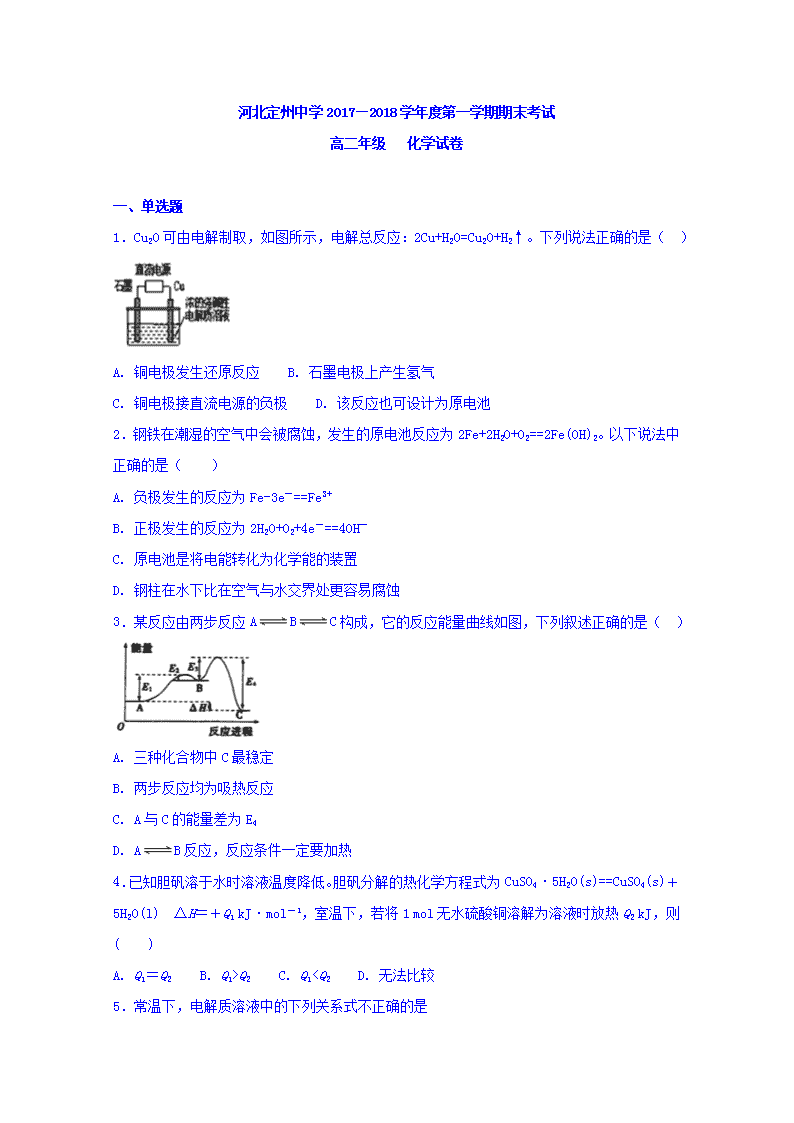
1.Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑。下列说法正确的是( )
A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 该反应也可设计为原电池
2.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2==2Fe(OH)2。以下说法中正确的是( )
A. 负极发生的反应为Fe-3e-==Fe3+
B. 正极发生的反应为2H2O+O2+4e-==4OH-
C. 原电池是将电能转化为化学能的装置
D. 钢柱在水下比在空气与水交界处更容易腐蚀
3.某反应由两步反应ABC构成,它的反应能量曲线如图,下列叙述正确的是( )
A. 三种化合物中C最稳定
B. 两步反应均为吸热反应
C. A与C的能量差为E4
D. AB反应,反应条件一定要加热
4.已知胆矾溶于水时溶液温度降低。胆矾分解的热化学方程式为CuSO4·5H2O(s)==CuSO4(s)+5H2O(l) ΔH=+Q1 kJ·mol-1,室温下,若将1 mol无水硫酸铜溶解为溶液时放热Q2 kJ,则( )
A. Q1=Q2 B. Q1>Q2 C. Q1
c(K+)>c(Al3+ )>c(H+)>c(OH-)
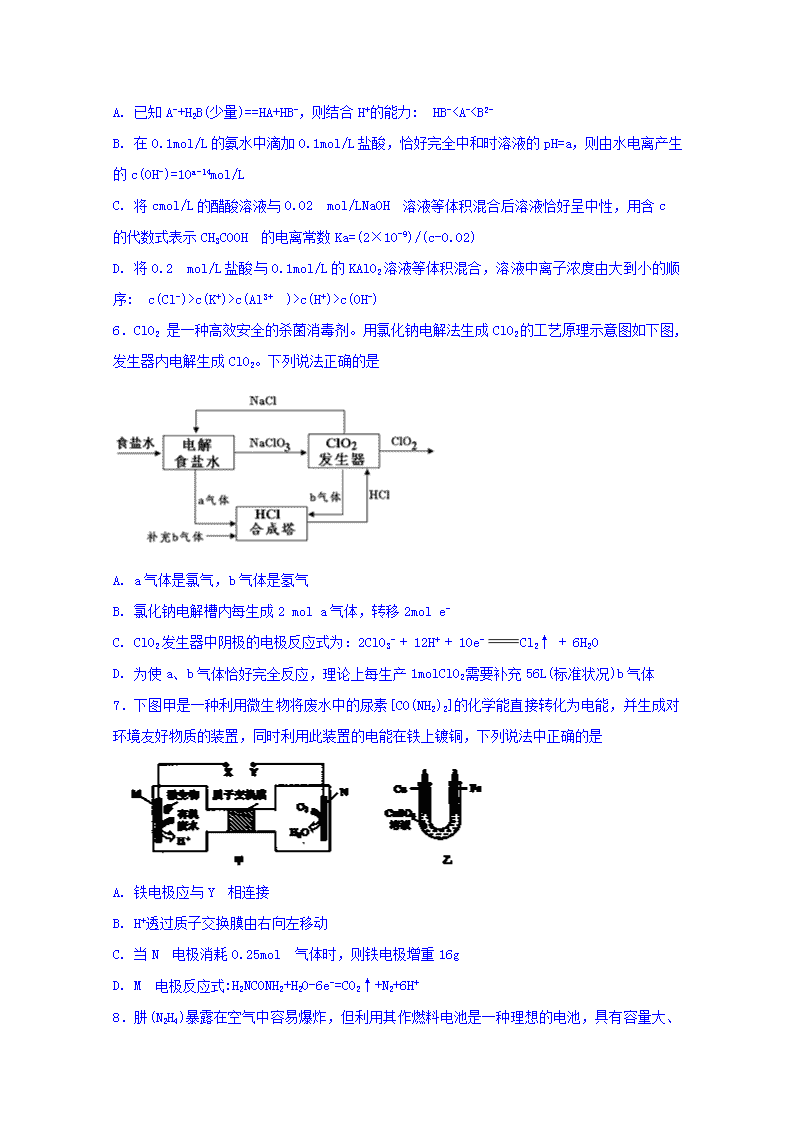
6.ClO2 是一种高效安全的杀菌消毒剂。用氯化钠电解法生成ClO2的工艺原理示意图如下图, 发生器内电解生成ClO2。下列说法正确的是
A. a气体是氯气,b气体是氢气
B. 氯化钠电解槽内每生成2 mol a气体,转移2mol e-
C. ClO2发生器中阴极的电极反应式为:2ClO3- + 12H+ + 10e-Cl2↑ + 6H2O
D. 为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充56L(标准状况)b气体
7.下图甲是一种利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成对环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是
A. 铁电极应与Y 相连接
B. H+透过质子交换膜由右向左移动
C. 当N 电极消耗0.25mol 气体时,则铁电极增重16g
D. M 电极反应式:H2NCONH2+H2O-6e-=CO2↑+N2+6H+
8.肼(N2H4)
暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化效率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是
A. 负极反应为4OH-+N2H4 − 4e– = N2↑+4H2O
B. 当消耗1molO2时,有2mol Na+由甲槽向乙槽迁移
C. 电池工作时,正极附近的pH降低
D. 若去掉离子交换膜电池也能正常工作
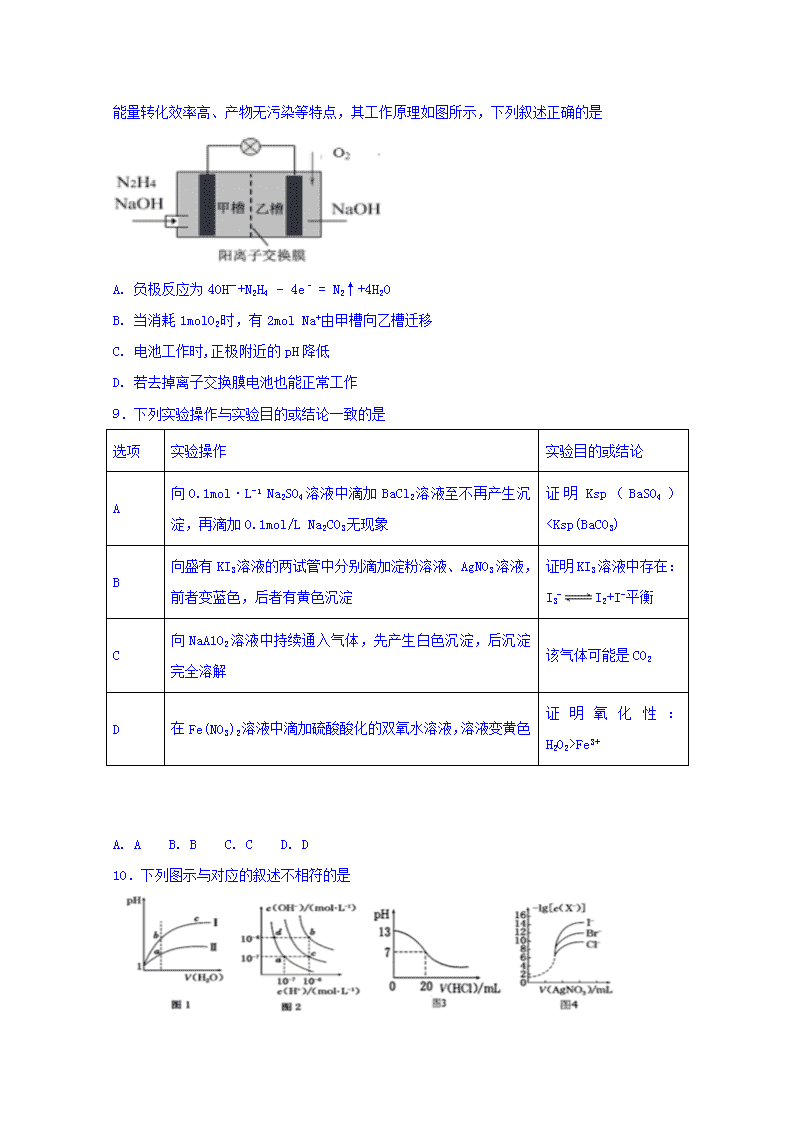
9.下列实验操作与实验目的或结论一致的是
选项
实验操作
实验目的或结论
A
向0.1mol·L-1 Na2SO4溶液中滴加BaCl2溶液至不再产生沉淀,再滴加0.1mol/L Na2CO3无现象
证明Ksp(BaSO4)Fe3+
A. A B. B C. C D. D
10.下列图示与对应的叙述不相符的是
A. 图1表示同温度下,pH=1 的盐酸和醋酸溶液分别加水稀释时pH 的变化曲线,其中曲线Ⅱ为醋酸,且a 点溶液的导电性比b 点强
B. 图2 中纯水仅升高温度,不能使a点变到c点
C. 图3 表示25 ℃时,用0.100 0 mol・L-1HCl 滴定20 mL 0.100 0 mol・L-1NaOH 溶液,溶液的pH随加入盐酸体积的变化
D. 用0.010 0 mol・L-1AgNO3标准溶液滴定浓度均为0.100 0 mol・L-1Cl-、Br-及I-的混合溶液,由图4 曲线,可确定首先沉淀的是I-
11.下列解释实验事实的方程式正确的是
A. Al2(SO4)3溶液滴加氨水产生白色胶状沉淀: Al3++3OH- = Al(OH)3↓
B. 90 ℃时,测得纯水中c(H+)·c(OH-) =3.8×10—13:H2O(l)⇌H+(aq)+OH-(aq)△H<0
C. 除去BaCO3中少量的BaSO4的方法是加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤:BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)
D. 碳酸钠溶液滴入酚酞变红:CO32 -+ 2H2O ⇌ H2CO3+2OH-
12.下列叙述中正确的是
A. 苯乙炔中最多有四个原子共直线
B. 2-甲基-1,3-丁二烯与Br2的加成产物有4种
C. 甲苯在一定条件下与H2完全反应,产物的一氯代物的同分异构体有4种
D. 已知具有单双键交替长链(如:—CH=CH—CH=CH—CH=CH—)的高分子有可能成为导电塑料,故聚乙烯和聚乙炔均可成为导电塑料
13.常温下,用0.10 mol·L—1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L—1 CH3COOH溶液和HCN溶液所得滴定曲线如图。下列说法正确的是
A. 点①和点②所示溶液中: c(CH3COO-)+c (CN-)=c(HCN)+c(CH3COOH)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO-)>c(CN-)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
14.Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑。下列说法正确的是( )
A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 该反应也可设计为原电池
15.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2==2Fe(OH)2。以下说法中正确的是( )
A. 负极发生的反应为Fe-3e-==Fe3+
B. 正极发生的反应为2H2O+O2+4e-==4OH-
C. 原电池是将电能转化为化学能的装置
D. 钢柱在水下比在空气与水交界处更容易腐蚀
16.某反应由两步反应ABC构成,它的反应能量曲线如图,下列叙述正确的是( )
A. 三种化合物中C最稳定
B. 两步反应均为吸热反应
C. A与C的能量差为E4
D. AB反应,反应条件一定要加热
17.已知胆矾溶于水时溶液温度降低。胆矾分解的热化学方程式为CuSO4·5H2O(s)==CuSO4(s)+5H2O(l) ΔH=+Q1 kJ·mol-1,室温下,若将1 mol无水硫酸铜溶解为溶液时放热Q2 kJ,则( )
A. Q1=Q2 B. Q1>Q2 C. Q1 ①
B. 溶液中阴离子的总物质的量浓度之和① > ②
C. ①溶液中:n(OH-)-n(H+)=n(HCO3-)+ 2n(H2CO3)
D. ②溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
20.在常温下,将体积相同,把pH=13的NaOH溶液、氨水,分别加水稀释m倍、n倍,溶液的pH都变成9,那么m与n的关系为
A. 4m=n B. m=n C. m
查看更多