- 2021-08-24 发布 |
- 37.5 KB |
- 21页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山东省菏泽市2020届高三联合模拟考试理综化学试题
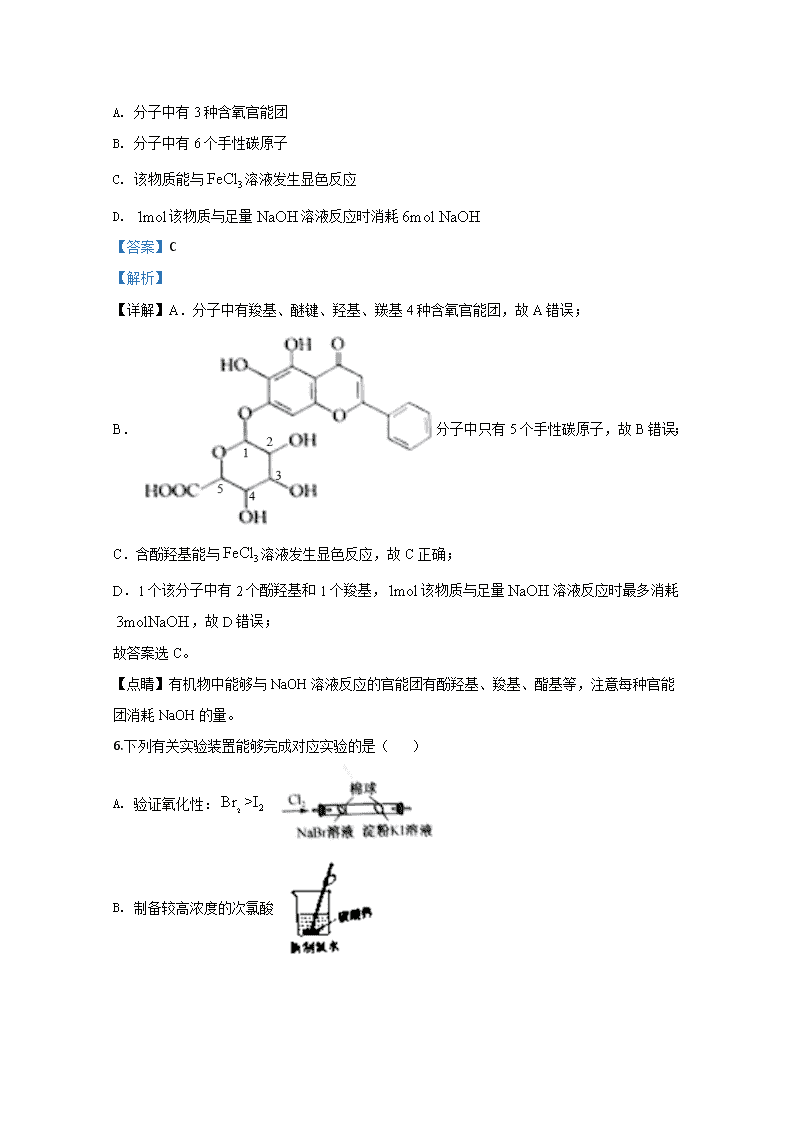
化学试题 一、选择题(本题共 10 小题,每小题 2 分,共 20 分。在每小题给出的四个选项 中,只有一项是符合题目要求的) 1.化学与生活密切相关。下列说法不正确...的是( ) A. 蛋白质、DNA 和 RNA 均属于生物高分子 B. 纤维素和蔗糖水解的最终产物均为葡萄糖 C. 体积分数为 75%的乙醇溶液常用于医疗消毒 D. 紫外光和高温均能使新型冠状病毒蛋白质变性 【答案】B 【解析】 【详解】A.蛋白质是由氨基酸构成的生物大分子,DNA、RNA 是由核苷酸构成的生物大分 子,故 A 正确; B.蔗糖的水解产物为葡萄糖和果糖,故 B 错误; C.体积分数为 75%的乙醇溶液常用于医疗消毒,故 C 正确; D.光、热使病毒蛋白质失去活性,故 D 正确; 故答案选 B。 2.下列有机物命名(括号内为名称)正确的是( ) A. (1,3,4 三甲苯) B. (2,2-二甲基-3-乙基丁烷) C. (2-甲基-3-戊醇) D. (2,3,4,4-四甲基-2-戊烯) 【答案】D 【解析】 【详解】A. 正确名称是 1,2,4-三甲苯,故 A 错误; B. 正确名称是 2,2,3-三甲基戊烷,故 B 错误; C. 正确名称是 4-甲基-2-戊醇,故 C 错误; D. 正确名称是 2,3,4,4-四甲基-2-戊烯,故 D 正确; 故答案选 D。 3.用 118mol L 的硫酸配制 1250mL 0.1mol L 的硫酸,下列仪器无须选用的是( ) A. 烧杯 B. 烧瓶 C. 容量瓶 D. 玻璃棒 【答案】B 【解析】 【详解】用 118mol L 的硫酸配制 1250mL 0.1mol L 的硫酸,需要先把浓硫酸在烧杯中稀释, 并用玻璃棒搅拌,然后才能转移到容量瓶中,整个实验操作不需要使用烧瓶,故答案选 B。 4.某元素基态原子 4s 轨道上有 2 个电子,则该基态原子价电子排布可能是( ) A. 4s B. 24s C. 6 23p 4s D. 9 23d 4s 【答案】B 【解析】 【详解】A.4s 不是价电子排布式,故 A 错误; B. 24s 可能是原子的价电子排布式,故 B 正确; C.依据洪特规则,该原子电子排布式应为 2 2 6 2 6 21s 2s 2p 3s 3p 4s ,价电子排布式为 4s2,故 C 错误; D.依据洪特规则,应为 10 13 4d s ,故 D 错误; 故答案选 B。 【点睛】注意基态原子电子排布式书写时要满足能量最低原理、洪特规则等;主族元素的价 层电子是最外层电子,但副族元素还包括次外层电子甚至倒数第三层电子,注意区分。 5.黄芩苷是双黄连口服液中的活性成分之一,其结构如图所示。下列关于黄芩苷的说法正确的 是( ) A. 分子中有 3 种含氧官能团 B. 分子中有 6 个手性碳原子 C. 该物质能与 3FeCl 溶液发生显色反应 D. 1mol该物质与足量 NaOH 溶液反应时消耗6mol NaOH 【答案】C 【解析】 【详解】A.分子中有羧基、醚键、羟基、羰基 4 种含氧官能团,故 A 错误; B. 分子中只有 5 个手性碳原子,故 B 错误; C.含酚羟基能与 3FeCl 溶液发生显色反应,故 C 正确; D.1 个该分子中有 2 个酚羟基和 1 个羧基,1mol该物质与足量 NaOH 溶液反应时最多消耗 3molNaOH ,故 D 错误; 故答案选 C。 【点睛】有机物中能够与 NaOH 溶液反应的官能团有酚羟基、羧基、酯基等,注意每种官能 团消耗 NaOH 的量。 6.下列有关实验装置能够完成对应实验的是( ) A. 验证氧化性: 2 2Br >I B. 制备较高浓度的次氯酸 C. 检验火柴燃烧有 2SO 生成 D. 制取并收集干燥的 NO 【答案】B 【解析】 【详解】A.氯气也能与 KI 反应,干扰验证,故 A 错误; B.碳酸钙消耗新制氯水中的盐酸,有利于氯气和水反应生成次氯酸,故 B 正确; C.试管中左侧导气管应为长导气管且插入溶液中,应向右拉注射器活塞,故 C 错误; D.NO 与 O2反应,不能用排空气法收集 NO ,故 D 错误; 故答案选 B。 7.三氟化硼乙醚络合物 3 2 5 2 BF O C H 是一种有机催化剂,测定其中 3BF 的含量时涉及的反 应为 3 2 3 2 3 3 32 2BF +6H O+3Ca NO 3CaF +2H BO +6HNO .下列说法错误的是( ) A. 3 2 5 2BF O C H 中 B 的杂化方式是 2sp B. - 3NO 的空间构型为平面三角形 C. 2 3 3H O H BO、 均可形成分子间氢键 D. 2CaF 晶体中每个 2+Ca 周围有 8 个 -F 【答案】A 【解析】 【详解】A. 3 2 5 2BF O C H 中 B 原子采用 3sp 杂化( ), 3 3H BO 中 B 为 2sp 杂 化,故 A 错误; B. 3NO 中心原子价层电子对数 5 1n 3 2 ,N 原子上无孤对电子,空间构型为平面三角形, 故 B 正确; C.H2O 和 3 3H BO 中均存在O H ,分子间可形成氢键,故 C 正确; D.在萤石结构中, 2Ca 的配位数为 8,F 的配位数为 4,故 D 正确; 故答案选 A。 8.下列有关仪器的使用方法或实验操作正确的是( ) A. 用广泛 pH 试纸测定次氯酸钙溶液的 pH,证明次氯酸是弱酸 B. 对于碘和铁粉的混合物,可加热,利用碘易升华的特性分离 C. 用乙醇和乙酸制取乙酸乙酯过程中忘加碎瓷片,立刻补加防止暴沸 D. 用容量瓶配制溶液时,定容时俯视刻度线,所配溶液浓度偏高 【答案】D 【解析】 【详解】A. 2Ca(ClO) 溶液具有漂白性,不能用 pH 试纸测定 2Ca(ClO) 溶液的 pH,故 A 错 误; B.加热时 Fe与 2I 会发生反应,故 B 错误; C.若忘记加碎瓷片,应冷却后再补加,故 C 错误; D.定容时俯视刻度线,溶液体积偏小,所配溶液浓度偏髙,故 D 正确; 故答案选 D。 【点睛】含有强氧化性的酸或某种离子存在时,不能用 pH 试纸测定相关溶液的 pH;进行化 学实验时,一定要注意实验安全,按照要求操作,减小误差的产生。 9.W、X、Y、Z 是同周期主族元素,Y 的最外层电子数是 X 次外层电子数的 3 倍,四种元素 与锂组成的盐是一种新型的锂离子电池的电解质(结构如图,箭头表示配位键)。下列说法不. 正确..的是( ) A. W 的非金属性比 Y 的强 B. 该物质中 X 原子满足 8 电子稳定结构 C. 该物质中含离子键和共价键 D. Z 的氧化物都易溶于水中 【答案】D 【解析】 【分析】 W、X、Y、Z 是同周期主族元素,Y 的最外层电子数是 X 次外层电子数的 3 倍,可知 X 的次 外层电子数只能为 2,Y 的最外层电子数为 6,由四种元素与锂组成的盐是一种新型的锂离子 电池的电解质,Z 可形成 4 个共价键,Y 可形成 2 个共价键,X 可形成 3 个共价键和 1 个配位 键,则 Z 为 C、Y 为 O、X 为 B,W 可提供电子对,且易得到 1 个电子,则 W 为 F,均为第 二周期元素,以此来解答。 【详解】由分析可知 W、X、Y、Z 四种元素依次为 F、B、O、C; A.氟的非金属性比氧的强,故 A 正确; B.硼原子与 F、O 形成四对共用电子对,满足 8 电子稳定结构,故 B 正确; C.由图可知该物质中含离子键和共价键,故 C 正确; D.Z 为 C,其氧化物 CO 不溶于水,故 D 错误; 故答案选 D。 10. 5 6H IO 是一种弱酸,可通过下列方法制备: 下列说法正确的是( ) A. 室温下, 3KIO 的溶解度比 3 2Ba IO 的小 B. 反应②中,被氧化的碘与被还原的碘物质的量之比为 5:1 C. 反应③的产物中 2 2n I :n O =4:9 D. 反应④中酸 X 可选用盐酸或硝酸 【答案】C 【解析】 【详解】A.由反应①复分解反应规律, 3 2Ba IO 的溶解度较小,故 A 错误; B.反应②产物为 3 2Ba IO 和 2BaI ,被氧化的碘与被还原的碘物质的量之比为 1:5,故 B 错误; C.依据氧化还原反应规律,发生 580 C 3 5 6 2 22 2 5Ba IO Ba IO 9O 4I ,产物中 2 2n I :n O =4:9,故 C 正确; D.Ba2+与 SO42-可以生成 BaSO4沉淀,为了有利于分离,适宜用硫酸,故 D 错误; 故答案选 C。 【点睛】本题关键是理解反应流程图中每一步反应的实验原理和实验目的,注意应用氧化还 原反应规律判断不同物质反应或生成的量的关系。 二、选择题(本题共 5 小题,每小题 4 分,共 20 分。每小题有 1 个或 2 个选项符 合题意,全都选对得 4 分,选对但不全的得 1 分,有选错的得 0 分) 11.电解法制取 2 4K FeO 的装置如图所示,下列说法正确的是( ) A. 铂极与电源的正极相连 B. 盐桥中向阴极迁移的主要是 +H C. 阳极池与阴极池中 -OH 浓度均减小 D. Fe 极上主要反应为 - - 2- 24Fe+8OH -6e FeO +4H O 【答案】D 【解析】 【详解】A.Pt 作阳极时,实际上是电解水,得不到 2 4K FeO ,故 A 错误; B. 3KNO 溶液中H浓度极小,向阴极迁移的主要是K,故 B 错误; C.阴极反应为 - 2 22H O 2e H 2OH ,阴极池O H 浓度增大,故 C 错误; D.Fe 作阳极,主要反应为 - - 2- 24Fe+8OH -6e =FeO +4H O ,故 D 正确; 故答案选 D。 【点睛】根据实验目的分析判断该电解池的正负极及电极反应式;电解池中阴离子向阳极移 动,阳离子向阴极移动。 12.下列化学方程式能表达反应颜色变化的是( ) A. 发黄的浓硝酸中通入 2O ,黄色逐渐褪去: 2 2 2 34NO +O +2H O 4HNO B. 向 2FeBr 溶液中滴入少量氯水,溶液变棕黄: 2 2 2 2FeBr +Cl FeCl +Br C. 用两个惰性电极电解 2CuCl 溶液,溶液颜色变浅: 2 2CuCl Cu Cl 通电 D. 吸有 2NO 的注射器,堵住针头增大容积红棕色变浅: 2 22NO (g) 2NO(g)+O (g) 【答案】AC 【解析】 【详解】A.浓硝酸发黄是由于硝酸分解生成的 2NO 溶解其中,通 2O 将其重新转化为硝酸, 故 A 正确; B. 2Fe 还原性大于Br ,首先氧化的是 2Fe ,故 B 错误; C.用惰性电极电解 2CuCl 溶液,电解发生反应 2 2CuCl Cu Cl 通电 ,故 C 正确; D.该条件下 2NO 不能分解为 NO 和 2O ,增大容积, 2 2 42NO N O 平衡向 2NO 方向移动, 变浅是由于体积增大,导致 2NO 浓度变小,故 D 错误; 故答案选 AC。 13.太阳能硫氨制氢循环过程如图所示。下列说法错误的是( ) A. “电解池”中阳极上主要反应为 - - 2 24OH 4e 2H O+O- B. “吸收”时发生的主要离子反应为 + 2- 2 3 2 4 3SO +2NH +H O 2NH +SO C. “低温反应器”中反应为 °400 C 4 4 2 4 2 2 7 3 22 NH SO +K SO K S O +2NH +H O D. “高温反应器”中,采用高温条件有利于提高 3SO 的平衡转化率 【答案】A 【解析】 【详解】A.电解池中阳极上主要发生 2 2 3 2 4SO H O 2e SO 2H ,故 A 错误; B.由图示,吸收“高温发生器”中的 2SO 和 2O 及“回收热能发电”后逸出的 3NH 和 2H O用水吸 收生成亚硫酸铵,氧气逸出,故 B 正确; C.由图示可知,“低温反应器”中反应为 °400 C 4 4 2 4 2 2 7 3 22 NH SO +K SO K S O +2NH +H O ,故 C 正确; D. 3 2 2 1SO (g) SO (g) O (g) H 0 2 ,高温有利于平衡向分解方向移动,故 D 正确; 故答案选 A。 14.向重铬酸盐酸性溶液中加入乙醚和 2 2H O ,水层发生反应: 2- + 2 7 2 2 3 2Cr O +4H O +2H 2CrO +5H O (已知 5CrO 的结构为 ),乙醚层发生反应: 5 2 5 5 2 52 2 CrO + C H O CrO O C H 。反应现象为上层出现蓝色,一段时间后溶液蓝色褪 去,水相变为绿色 3+Cr ,下列说法正确的是( ) A. 由水层反应可知,氧化性: 2- 2 7 5Cr O >CrO B. 乙醚在检验过程中作稳定剂和萃取剂 C. 5 2 5 2CrO O C H 中不存在非极性键 D. 水相变为绿色的离子反应为 + 3+ 3 2 24CrO +12H 4Cr +6H O+7O 【答案】BD 【解析】 【详解】A.水层发生反应: 2- + 2 7 2 2 3 2Cr O +4H O +2H =2CrO +5H O是非氧化还原反应,故 A 错误; B.乙醚与 5CrO 形成配合物并使 5CrO 进入有机相,在检验过程中作稳定剂和萃取剂,故 B 正确; C. 5 2 5 2CrO O C H 含O O C C 、 非极性键,故 C 错误; D.水相变为绿色的离子反应为 + 3+ 3 2 24CrO +12H =4Cr +6H O+7O ,故 D 正确; 故答案选 BD。 15. °25 C 时, -1100mL 0.100mol L 氨水用 -10.100mol L 的盐酸滴定,其滴定曲线如图所示。 下列说法正确的是( ) A. 可用酚酞作滴定指示剂 B. 在 a 点: + - 3 2 4c NH H O +c NH <2c Cl C. 在 a 点溶液中水的电离程度比 b 点的小 D. 在 b 点: + 6 3 2lgc NH -lgc NH H O =4.52 【答案】CD 【解析】 【详解】A.酚酞的变色范围是 8~10,与图中 pH 突变范围不符,故 A 错误; B.由电荷守恒: 4NH H Cl OHc c c c , 42c NH 2c H 2c Cl 2c OH ,由 3 2 4 3 2 4c NH H O c NH c NH H O c NH 2c Cl 2c OH 2c H , , 3 2 c 4c NH H O NH 2c Cl ,故 B 错误; C.在 a 点溶质为 4NH Cl和 3 2NH H O , 9.26c H 10 ,H全部来自水的电离,在 b 点, 溶质为 4NH Cl和HCl , 4.74c H 10 ,H来自HCl 的电离和 2H O的电离,由水电离的 4.74 9.26 c H 10 c OH 10 水 水 , ,故 C 正确; D.由 a 点知, 4.74 b 3 2K NH H O 10 ,在 b 点: 4 2 3 2NH H O NH H O H , 4.74 3 2 3 2 14 4.74w b4 4 c NH H O c H c NH H O 10KK 10 Kc NH c NH , , 3 2 4.52 4 c NH H O 10 c NH ,两边取对数得: 3 2 4lgc NH H O lg c NH 4.52 ,故 D 正确; 故答案选 CD。 三、非选择题(本题共 5 小题,共 60 分) 16. 2H S广泛存在于天然气等燃气及废水中,热分解或氧化 2H S有利于环境保护并回收硫资 源。 (1)Binoist 等进行了 2H S热分解实验: 2 2 22H S(g) 2H (g)+S (g) ,开始时, 2H S与Ar 的 体积比为 1:19.在压强为101 kPa 下测得在三种不同温度下 2H S的转化率如图 1 所示. 2H S分解反应的ΔH ______________(填“>”或“<”)0,A、B、C、D 四点中: v正最大的是 __________________, v逆最大的是___________,容器中 2H 的分压由大到小的关系是 __________________。 (2)当 21mol H S与19 mol Ar 混合,在101 kPa 及不同温度下反应达平衡时 2 2H H S、 及 2S (g) 的体积分数如图 2 所示。图中 b 表示的物质是___________,M 点时,反应 2 2 22H S(g) 2H (g)+S (g) 的平衡常数 pK = ____________________ kPa ( pK 为以分压表示 的平衡常数,保留两位小数) (3)用氯气除去废水中 2H S的反应为 2 2Cl (aq) H S(aq) S(s) 2HCl(aq) ,该反应的可 能机理如下: a. 2Cl 2Cl 慢 b. 2Cl 2Cl 快 2Cl H S HCl HS 快 2Cl H S HCl HS 慢 Cl HS HCl S 快 Cl HS HCl S 快 c. 2 2Cl H S Cl HS HCl 慢 d. 2 2Cl H S Cl HS HCl 快 Cl HS HCl S 快 Cl HS HCl S 慢 ①机理 a 的中间体为______________________。 ②已知 2 2Cl H Sv k c c 正 , v正 为正反应速率,k 为速率常数,上述机理中与该速率 方程一致的是_________________________(填字母)。 【答案】 (1). > (2). A (3). B (4). B A C D (5). 2S (6). 1.25 (7). Cl HS、 (8). c 【解析】 【分析】 (1)化学反应中,温度越高,化学反应速率越快,转化率越高,从化学平衡移动方向判断反应 吸热还是放热;温度越高,化学反应速率越快,随着反应进行,化学反应速率降低;A、C 两 点 H2S 转化率相同; (2)当 21mol H S与19 mol Ar 混合,发生反应 2 2 22H S(g) 2H (g)+S (g) ,生成 n(H2):n(S2)=2: 1,M 点时,n(H2S)=n(H2); (3)①机理 a 中Cl HS、 先生成,后被反应掉,作为中间体; ②慢反应决定化学反应速率。 【详解】(1)化学反应中,温度越高,化学反应速率越快,从图 1 可看出曲线ⅢH2S 转化速率 最快,说明曲线Ⅲ温度最高,而转化率也是最高,说明反应向正向移动,故正反应吸热,ΔH >0; 温度越高,化学反应速率越快,随着反应进行,化学反应速率降低,故 A、B、C、D 四点中: v正最大的是 A,v逆最大的是 B;由于 A、C 两点 H2S 转化率相同,则容器中 2H 的分压由大 到小的关系是B A C D ; (2)当 21mol H S与19 mol Ar 混合,发生反应 2 2 22H S(g) 2H (g)+S (g) ,生成 n(H2):n(S2)=2: 1,图中 b 表示的物质是 2S ,M 点时,n(H2S)=n(H2),反应 2 2 22H S(g) 2H (g)+S (g) 的平衡 常数 pK = 2 2 0.5 0.25( 101) 101 20.25 20.25 0.5( 101) 20.25 =1.25 kPa ; (3)①机理 a 中Cl HS、 先生成,后被反应掉,故机理 a 的中间体为Cl HS、 ; ②已知 2 2= Cl H Sv k c c 正 , v正 为正反应速率,k 为速率常数,慢反应决定化学反应速 率,上述机理中与该速率方程一致的是 c。 17. 2 3 3KBe BO F LiSrBO、 等均是我国发明的深紫外非线性光学晶体。 (1)Be Sr B、 、 三种元素的电负性由大到小的顺序是__________________,Be B O、 、 的 第一电离能从大到小的顺序是______________________。 (2)基态钾原子的核外电子排布式为____________________; 2K O的熔点比BeO 的低,其 原因是___________________________________________。 (3) 2Be(OH) 溶于 25%的 4 2NH HF 溶液中,在铂制或铅制器皿中浓缩可得四氟铍酸铵 4 42NH BeF 晶体,再在 2CO 气流中加热至 450℃可得 2BeF 。 ①气态 2BeF 是以单分子 2BeF 存在,固态 2BeF 的结构如图所示,气态 2BeF 与固态 2BeF 的中 心原子杂化方式依次为_____________、_________________。 ② 2 4BeF 的空间构型为________________,画出 2HF 的结构:_______________________. (4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标, 2SrF 晶胞结构如图所示,品胞中与点 1 1 1, , 4 4 4 距离最远的 -F 的原子分数坐标为 _______________; 2SrF 的摩尔质量为 1125.62g mol ,晶胞的密度为 34.24g cm ,则晶胞 参数 a ____________pm(用代数式表示) 【答案】 (1). B,Be,Sr (2). O,Be,B (3). 1[Ar]4s (4). 2K O的晶格能比BeO 的小 (5). sp (6). sp3 (7). 正四面体 (8). [F H F] (9). 3 3 3, , 4 4 4 (10). 10 3 A 4 125.62 10 N 4.24 【解析】 【分析】 (1)电负性的变化规律为同周期从左向右逐渐增大,同主族由上至下逐渐减小;第一电离能的 变化规律为同周期元素从左向右逐渐增大,第ⅡA 族元素 s 层电子充满,较稳定,第一电离能 较大; (2)基态钾原子的核外有 19 个电子; 2K O的熔点比BeO 的低,从晶格能角度分析; (3)①根据气态 2BeF 和固态 2BeF 的 Be 原子与 F 原子相连的形式,判断中心原子杂化方式; ② 2 4BeF 中 Be 与 F 原子形成 4 对共用电子对, 2HF 的结构中形成氢键; (4)根据 2SrF 晶胞结构计算可得晶胞中含有 Sr 原子、F-个数,从而判断 Sr 原子、F-在晶胞的位 置,每个 F 原子距最近的顶点距离都相等;根据晶胞参数 a 3 A 4M N 计算。 【详解】(1)电负性的变化规律为同周期从左向右逐渐增大,同主族由上至下逐渐减小, Be Sr B、 、 三种元素的电负性由大到小的顺序是 B,Be,Sr;第一电离能的变化规律为同周 期元素从左向右逐渐增大,第ⅡA 族元素 s 层电子充满,较稳定,第一电离能较大,Be B O、 、 的第一电离能从大到小的顺序是 O,Be,B; (2)基态钾原子的核外电子排布式为 1[Ar]4s ; 2K O的熔点比BeO 的低,其原因是离子半径 K+>Be2+, 2K O的晶格能比BeO 的小; (3)①气态 2BeF 是以单分子 2BeF 存在,气态 2BeF 中心原子杂化方式为 sp 杂化;固态 2BeF 的 结构如图所示,1 个 Be 原子与 4 个 F 原子相连,则 Be 原子杂化方式为 sp3 杂化; ② 2 4BeF 中 Be 与 F 原子形成 4 对共用电子对,空间构型为正四面体, 2HF 的结构为 [F H F] ; (4) 2SrF 晶胞结构如图所示,计算可得晶胞中含有 4 个 Sr 原子,8 个 F-,则 Sr 原子在晶胞顶点 和面心,F-在晶胞内部,形成立方体结构,每个 F 原子距最近的顶点距离都相等,则晶胞中与 点 1 1 1, , 4 4 4 距离最远的 -F 的原子分数坐标为 3 3 3, , 4 4 4 ; 2SrF 的摩尔质量为 1125.62g mol ,晶胞的密度为 34.24g cm ,则晶胞参数 a 3 A 4M N = 10 3 A 4 125.62 10 N 4.24 pm。 18. 2 2 4Na S O (连二亚硫酸钠)是易溶于水,不溶于甲醇的白色固体,在空气中极易被氧化, 是一种还原性漂白剂。制取 2 2 4Na S O 的方法很多, (1)在碱性溶液中用 4NaBH 还原 3NaHSO 法制备 2 2 4Na S O 的反应原理为: 3 2 2 2 24 4NaBH NaHSO NaOH Na S O NaBO H O (未配平)反应装置如图所示: ①实验开始及整个过程中均需通入 2N ,其目的是__________________________________。 ②制备过程中温度需控制在 10~45℃,采用水浴加热的主要优点是______________________。 ③为使 3NaHSO 尽可能完全被还原,加入三口烧瓶中的反应液,应控制 3 4 n NaHSO n NaBH ______________。 (2)用HCOONa 还原 2SO 制备 2 2 4Na S O 的装置(夹持加热仪器略)如下: ①装置 a 烧瓶中发生反应的化学方程式为_________________________________。 ②装置 b 用于净化 2SO ,适宜的试剂是______________________________。 ③装置 c 在 70~83℃生成 2 2 4Na S O 并析出,同时逸出 2CO ,该反应的化学方程式为 ________________________,加入 3CH OH 的目的是________________________;利用反应 后的浊液分离提纯 2 2 4Na S O 需经过的操作为 _____________________________________________________。 【答案】 (1). 排出装置内空气,使反应在无氧状况下进行 (2). 使反应液均匀受热 (3). 小于 8:1(或<8) (4). 2 3 2 2Na SO 2HCl 2NaCl H O SO (5). 饱和 3NaHSO 溶液 (6). 2 2 3 2 2 4 2 22HCOONa 4SO Na CO 2Na S O H O 3CO (7). 降低 2 2 4Na S O 的溶解度 (8). 过滤、洗涤、重结晶、过滤、干燥 【解析】 【分析】 (1)① 2 2 4Na S O 在空气中极易被氧化,通入 2N 其目的是排出装置内空气; ②采用水浴加热的主要优点是使反应液均匀受热; ③ 3 2 2 2 24 4NaBH NaHSO NaOH Na S O NaBO H O ,根据得失电子守恒可知, 3 4 n NaHSO n NaBH =8; (2)①装置 a 烧瓶中发生 Na2SO3 与盐酸反应生成 SO2的反应; ②生成的 SO2 气体中含有 HCl 气体,根据性质选择除杂溶液; ③装置 c 在 70~83℃HCOONa 和 2SO 、 2 3Na CO 反应生成 2 2 4Na S O 并析出,同时逸出 2CO ; 2 2 4Na S O 不溶于甲醇,加入 3CH OH 可降低 2 2 4Na S O 的溶解度;利用反应后的浊液分离提纯 2 2 4Na S O 需重结晶。 【详解】(1)① 2 2 4Na S O 在空气中极易被氧化,实验开始及整个过程中均需通入 2N ,其目的 是排出装置内空气,使反应在无氧状况下进行; ②制备过程中温度需控制在 10~45℃,采用水浴加热的主要优点是使反应液均匀受热; ③根据得失电子守恒配平方程式, 3 2 2 2 24 4NaBH 8NaHSO Na S O NaBO H=4 6 O , 3 4 n NaHSO n NaBH =8,为使 3NaHSO 尽可能完全被还原,加入三口烧瓶中的反应液,应控制 3 4 n NaHSO n NaBH <8; (2)①装置 a 烧瓶中发生反应的化学方程式为 2 3 2 2Na SO 2HCl 2NaCl H O SO ; ②生成的 SO2 气体中含有 HCl 气体,除杂适宜的试剂是饱和 3NaHSO 溶液; ③装置 c 在 70~83℃生成 2 2 4Na S O 并析出,同时逸出 2CO ,化学方程式为 2 2 3 2 2 4 2 22HCOONa 4SO Na CO 2Na S O H O 3CO ; 2 2 4Na S O 不溶于甲醇,加入 3CH OH 的目的是降低 2 2 4Na S O 的溶解度;利用反应后的浊液分离提纯 2 2 4Na S O 需经过的操 作为过滤、洗涤、重结晶、过滤、干燥。 19.从粉煤灰(含莫来石、石英等)中回收 2 3Al O 的一种工艺流程如下: (1)经反应器 I 可使莫来石和石英转化为 22CaO SiO (硅酸二钙)和______________(七 铝十二钙,填化学式),从而使其中的 2 3Al O 得到活化。 (2)控制条件,经反应器 I 烧结后固体自身不需要机械加工即可变成粉末,“自粉化”的意义 是_______。 (3)浸取器中,适量增大 2 3Na CO 溶液的投料,有利于提高铝酸钙转化为 2NaAlO 的产率, 其原因是_______________________________________;同时有少量硅进入浸取渣,硅的存在 形式是________________________________(填化学式)。 (4)反应器Ⅲ中发生反应的离子方程式为:__________________________________。 (5)反应器Ⅳ采取工艺方法是_____________________;上述工艺流程中可以循环使用的物 质是_______________________________(填化学式)。 【答案】 (1). 2 312CaO 7Al O (或 12 14 33Ca Al O ) (2). 不需要再粉磨,节省能量 (3). 过量的碳酸钠溶液有利于铝酸钙转化为碳酸钙沉淀,从而使平衡向生成 2NaAlO 方向移动 (4). 2 3Na SiO (5). 2 2 2 2 3 32AlO CO 3H O 2Al(OH) CO (6). 高温焙烧 (7). 2CO 和 2 3Na CO 【解析】 【分析】 (1)七铝十二钙化学式仿照硅酸二钙的形式进行书写; (2) “自粉化”是固体自身不需要机械加工即可变成粉末,可以节省能量; (3)浸取器中,适量增大 2 3Na CO 溶液的投料,有利于提高铝酸钙转化为 2NaAlO 的产率,其 原因是过量的碳酸钠溶液有利于铝酸钙转化为碳酸钙沉淀,从而使平衡向生成 2NaAlO 方向 移动;浸取渣中硅的存在形式是 2 3Na SiO ; (4)反应器Ⅲ中发生 CO2与 AlO2-的反应; (5)反应器Ⅳ采取工艺方法是高温焙烧,使氢氧化铝转变为氧化铝;根据工艺流程中先消耗, 后期又生成的角度判断可以循环使用的物质。 【详解】(1)七铝十二钙化学式为 2 312CaO 7Al O (或 12 14 33Ca Al O ); (2) “自粉化”是固体自身不需要机械加工即可变成粉末,可以节省能量; (3)浸取器中,适量增大 2 3Na CO 溶液的投料,有利于提高铝酸钙转化为 2NaAlO 的产率,其 原因是过量的碳酸钠溶液有利于铝酸钙转化为碳酸钙沉淀,从而使平衡向生成 2NaAlO 方向 移动;浸取渣中硅的存在形式是 2 3Na SiO ; (4)反应器Ⅲ中发生反应的离子方程式为: 2 2 2 2 3 32AlO CO 3H O 2Al(OH) CO ; (5)反应器Ⅳ采取工艺方法是高温焙烧,使氢氧化铝转变为氧化铝;上述工艺流程中可以循环 使用的物质是 2CO 和 2 3Na CO 。 20.甘草素具有抗癌活性,其合成路线如下: (1)E 中官能团名称为________________,A 的结构简式为_________________,B→C 的反 应方程式为___________________________________________。 (2)A~F 中含有手性碳原子的是_________________(填字母)。 (3)写出符合下列条件的B的同分异构体__________________(填结构简式不考虑立体异构)。 ①苯环上有两个取代基;②能发生银镜反应和水解反应;③能与 3FeCl 溶液发生显色反应。 (4)写出以HCHO和 为原料制备 的合成路线:_______________________ (无机试剂任选)。 【 答 案 】 (1). 醚 键 、 羰 基 (2). (3). +CH3OCH2Cl +HCl (4). EF (5). (6). 【解析】 【分析】 (1)由 E 的结构简式判断含有的官能团,由 A 的分子式 C6H6O2 和 D 的结构简式判断 A 的结构 简式,B→C 发生取代反应; (2)连接 4 个不同的结构的碳原子成为手性碳原子; (3)B 的结构简式为 ,能发生银镜反应和水解反应,说明含有醛基和酯基; 能与 3FeCl 溶液发生显色反应,说明含有酚羟基;苯环上有两个取代基,据此写出同分异构体; (4)仿照题目中的信息,以HCHO和 为原料制备 的合成路线。 【详解】(1)由 E 的结构简式可知,E 中官能团名称为醚键、羰基,由 A 的分子式 C6H6O2,可 知 A 中含有两个酚羟基,由 D 的结构简式可知,A 的结构简式为 ,B→C 发 生取代反应,反应方程式为 +CH3OCH2Cl +HCl; (2)连接 4 个不同的结构的碳原子成为手性碳原子,A~F 中含有手性碳原子的是 EF; (3)B 的结构简式为 ,其同分异构体能发生银镜反应和水解反应,说明含有 醛基和酯基;能与 3FeCl 溶液发生显色反应,说明含有酚羟基;苯环上有两个取代基,符合条 件的同分异构体有 ; (4)仿照题目中的信息,以HCHO和 为原料制备 的合成路线为: 。 【点睛】本题关键是通过流程图中各物质之间的反应判断各物质的结构简式,限定条件的同 分异构体书写需要根据条件推断出可能含有的官能团。查看更多