- 2021-08-24 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学鲁科版一轮复习突破精练:第1章 专题讲座一 化学计算的常用方法
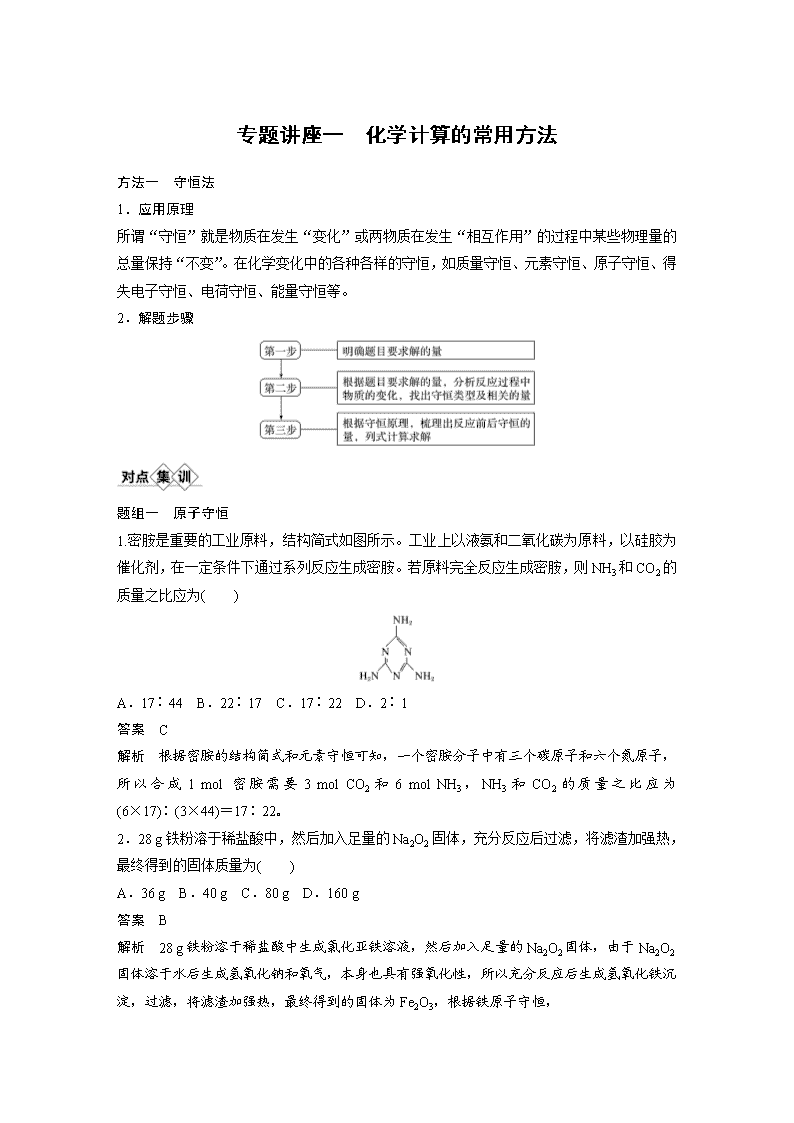
专题讲座一 化学计算的常用方法 方法一 守恒法 1.应用原理 所谓“守恒”就是物质在发生“变化”或两物质在发生“相互作用”的过程中某些物理量的总量保持“不变”。在化学变化中的各种各样的守恒,如质量守恒、元素守恒、原子守恒、得失电子守恒、电荷守恒、能量守恒等。 2.解题步骤 题组一 原子守恒 1.密胺是重要的工业原料,结构简式如图所示。工业上以液氨和二氧化碳为原料,以硅胶为催化剂,在一定条件下通过系列反应生成密胺。若原料完全反应生成密胺,则NH3和CO2的质量之比应为( ) A.17∶44 B.22∶17 C.17∶22 D.2∶1 答案 C 解析 根据密胺的结构简式和元素守恒可知,一个密胺分子中有三个碳原子和六个氮原子,所以合成1 mol 密胺需要3 mol CO2和6 mol NH3,NH3和CO2的质量之比应为(6×17)∶(3×44)=17∶22。 2.28 g铁粉溶于稀盐酸中,然后加入足量的Na2O2固体,充分反应后过滤,将滤渣加强热,最终得到的固体质量为( ) A.36 g B.40 g C.80 g D.160 g 答案 B 解析 28 g铁粉溶于稀盐酸中生成氯化亚铁溶液,然后加入足量的Na2O2固体,由于Na2O2固体溶于水后生成氢氧化钠和氧气,本身也具有强氧化性,所以充分反应后生成氢氧化铁沉淀,过滤,将滤渣加强热,最终得到的固体为Fe2O3,根据铁原子守恒, n(Fe2O3)=n(Fe)=×=0.25 mol 所得Fe2O3固体的质量为:0.25 mol×160 g·mol-1=40 g。 题组二 电荷守恒 3.将a g Fe2O3、Al2O3样品溶解在过量的200 mL pH=1的硫酸溶液中,然后向其中加入NaOH溶液,使Fe3+ 、Al3+刚好沉淀完全,用去NaOH溶液100 mL,则NaOH溶液的浓度为________________。 答案 0.2 mol·L-1 解析 当Fe3+ 、Al3+刚好沉淀完全时,溶液中溶质只有硫酸钠,而Na+全部来源于NaOH,且变化过程中Na+的量不变。根据电荷守恒可知:=,所以,n(NaOH)=n(Na+)=2n(SO)=n(H+)=0.1 mol·L-1×0.2 L=0.02 mol,c(NaOH)==0.2 mol·L-1。 4.若测得雨水所含水溶性无机离子的化学组分及其平均浓度如下表: 离子 K+ Na+ NH SO NO Cl- 浓度/mol·L-1 4×10-6 6×10-6 2×10-5 4×10-5 3×10-5 2×10-5 根据表中数据判断试样的pH=________。 答案 4 解析 根据表格提供的离子可知,NH水解导致试样溶液呈酸性,再根据电荷守恒可知,c(K+)+c(NH )+c(Na+)+[H+]=2c(SO)+c(Cl-)+c(NO),将表格中的数据代入得H+浓度为10-4 mol·L-1,则pH为4。 易错警示 列式时不要忘了离子浓度前乘上离子所带电荷数。 题组三 电子守恒 5.某强氧化剂XO(OH)可被Na2SO3还原。如果还原1.2×10-3 mol XO(OH)需用30 mL 0.1 mol·L-1的Na2SO3溶液,那么X元素被还原后的物质可能是( ) A.XO B.X2O3 C.X2O D.X 答案 D 解析 由题意知,S元素由+4价→+6价,假设反应后X的化合价为+x价,根据氧化还原反应中得失电子数目相等可得,1.2×10-3 mol×(5-x)=0.03 L×0.1 mol·L-1×(6-4),解得x=0,所以X元素被还原后的物质是X,D项正确。 6.以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为: 物质 V2O5 V2O4 K2SO4 SiO2 Fe2O3 Al2O3 质量分数/% 2.2~2.9 2.8~3.1 22~28 60~65 1~2 <1 以下是一种废钒催化剂回收工艺路线: “氧化”中欲使3 mol的VO2+变为VO,则需要氧化剂KClO3至少为________ mol。 答案 0.5 解析 “氧化”中使3 mol 的VO2+变为VO,转移电子的物质的量为3 mol×(5-4)=3 mol;氧化剂KClO3被还原为KCl,Cl元素的化合价由+5价降低到-1价,根据电子守恒可知,需要KClO3的物质的量至少为=0.5 mol。 方法二 关系式法 1.应用原理 关系式法是表示两种或多种物质之间“量”的关系的一种简化式子。在多步反应中,它可以把始态的反应物与终态的生成物之间的“量”的关系表示出来,把多步计算简化成一步计算。正确书写关系式是用关系式法解化学计算题的前提。 2.解题步骤 7.在氧气中燃烧0.22 g硫和铁组成的混合物,使其中的硫全部转化为二氧化硫,把这些二氧化硫全部氧化成三氧化硫并转变为硫酸,这些硫酸可用10 mL 0.5 mol·L-1氢氧化钠溶液完全中和,则原混合物中硫的百分含量为( ) A.72% B.40% C.36% D.18% 答案 C 解析 由S原子守恒和有关反应可得出: S~H2SO4~2NaOH 32 g 2 mol m(S) 0.5×10×10-3 mol 得m(S)=0.08 g 原混合物中w(S)=×100%≈36%。 8.金属锡的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为Sn+2HCl===SnCl2+H2↑,再加入过量的FeCl3溶液,发生如下反应:SnCl2+2FeCl3===SnCl4+2FeCl2,最后用已知浓度的K2Cr2O7溶液滴定生成的Fe2+,反应的化学方程式为6FeCl2+K2Cr2O7+14HCl===6FeCl3+2KCl+2CrCl3+7H2O。现有金属锡试样0.613 g,经上述反应后,共用去0.100 mol·L-1 K2Cr2O7溶液16.0 mL。求试样中锡的百分含量(假定杂质不参加反应,锡的相对原子质量为119)。 答案 Sn与K2Cr2O7物质的量的关系: 3Sn~3SnCl2~6FeCl2~K2Cr2O7 3×119 g 1 mol x 0.100×0.016 mol x==0.571 2 g w(Sn)=×100%≈93.2%。 9.(2019·北京,26改编)化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。 Ⅰ.用已准确称量的KBrO3固体配制一定体积的a mol·L-1 KBrO3标准溶液。 Ⅱ.取v1 mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色。 Ⅲ.向Ⅱ所得溶液中加入v2 mL废水。 Ⅳ.向Ⅲ中加入过量KI。 Ⅴ.用b mol·L-1Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液v3 mL。 已知:①I2+2Na2S2O3===2NaI+Na2S4O6 ②Na2S2O3和Na2S4O6溶液颜色均为无色 计算废水中苯酚的含量为________________g·L-1(苯酚摩尔质量:94 g·mol-1)。 答案 解析 n(BrO)=av1×10-3mol,根据反应BrO+5Br-+6H+===3Br2+3H2O可知n(Br2)=3av1×10-3mol,溴分别与苯酚和KI反应,先计算由KI消耗的溴的量,设为n1(Br2),根据I2+ 2Na2S2O3===2NaI+Na2S4O6可知I2~2Na2S2O3,又Br2+2I-===I2+2Br-可知Br2~I2,可得Br2~2Na2S2O3,n(Na2S2O3)=bv3×10-3mol,n1(Br2)=bv3×10-3mol,再计算由苯酚消耗的溴的量,设为n2(Br2)=n(Br2)-n1(Br2)=(3av1-bv3)×10-3mol,苯酚与溴水反应的计量数关系为3Br2~C6H5OH,n(C6H5OH)=n2(Br2)=(av1-bv3)×10-3mol,废水中苯酚的含量==g·L-1。 方法三 差量法 1.应用原理 差量法是指根据化学反应前后有关物理量发生的变化,找出“理论差量”。这种物理量可以是质量、物质的量、气态物质的体积和压强、反应过程中的热量等。用差量法解题时先把化学方程式中的对应差量(理论差量)跟实际差量列成比例,然后求解。 2.解题步骤 10.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( ) A. B. C. D. 答案 A 解析 由题意知(w1-w2)g应为NaHCO3分解生成的CO2和H2O的质量,设样品中NaHCO3质量为x g,由此可得如下关系: 2NaHCO3Na2CO3+ 2×84 62 x w1-w2 则x=, 故样品纯度为==。 11.将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定),该b L 气体中NH3的体积分数是( ) A. B. C. D. 答案 C 解析 设有x L NH3分解,则 2NH3(g)===N2(g)+3H2(g) ΔV 2 1 3 2 x (b-a)L = x=b-a w(NH3)==查看更多