- 2021-08-24 发布 |
- 37.5 KB |
- 80页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习化学常用计量课件(80张)(全国通用)
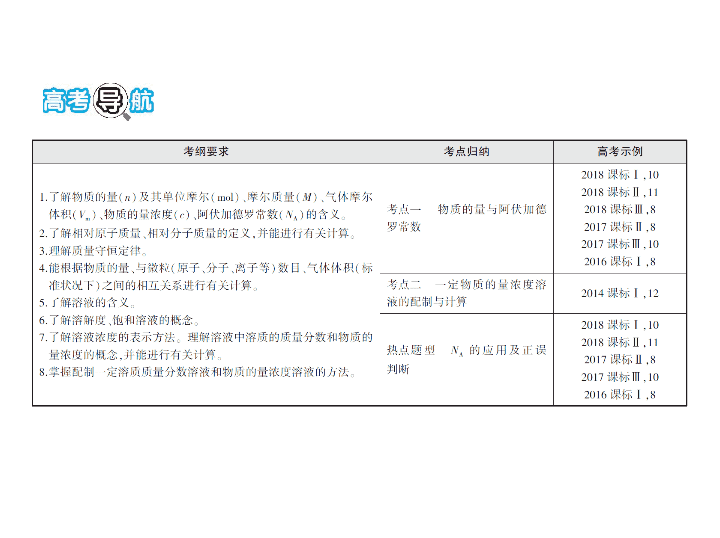
专题二 化学常用计量 总纲目录 考点一 物质的量与阿伏加德罗常数 考点二 一定物质的量浓度溶液的配制与计算 热点题型突破2 N A 的应用及正误判断 考点一 物质的量与阿伏加德罗常数 1. 两大常数:(1)阿伏加德罗常数 ; (2)气体摩尔体积(标准状况) 。 答案 (1)6.02 × 10 23 mol -1 (2)22.4 L·mol -1 2. 容易出错的“两组单位” (1)物质质量的常用单位为 ,摩尔质量的常用单位为 ,相对原子质量或相对分子质量的单位为 。 (2)气体体积的常用单位为 ,气体摩尔体积的常用单位为 L·mol -1 ,物质的量浓度的常用单位为 。 答案 (1)g g·mol -1 1 (2)L mol·L -1 3. 常考的标准状况下不是气体的“九种物质”: 。 答案 H 2 O、HF、SO 3 、Br 2 、CHCl 3 、CCl 4 、己烷、苯、乙醇 4. 有关物质的量的一系列公式(微粒数角度、质量角度、气体体 积角度、溶质的物质的量浓度角度): n = 。 答案 = = = c B · V 5. 物质的量浓度 c 、密度 ρ (单位为g/mL)、溶质摩尔质量 M 、溶质 质量分数 ω 的关系: c = 。 答案 6. 正误判断,正确的划“√”,错误的划“ ✕ ”。 Ⅰ .考查气体的摩尔体积 (1)常温常压下,22.4 L Cl 2 中含有的分子数为6.02 × 10 23 个 ( ) (2)标准状况下,80 g SO 3 中含3 N A 个氧原子,体积约为22.4 L ( ) (3)标准状况下,22.4 L N 2 和O 2 的混合气体中含有的分子数为 N A ( ) (4)标准状况下,22.4 L辛烷完全燃烧,生成的CO 2 的分子数为8 N A ( ) 答案 (1) ✕ (2) ✕ (3)√ (4) ✕ Ⅱ. 考查物质的组成与结构 (1)7.8 g Na 2 O 2 中含有的阴离子数为0.1 N A ( ) (2)1.8 g重水(D 2 O)中含 N A 个中子 ( ) (3)丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6 N A ( ) (4)0.1 mol FeCl 3 形成胶体后含有胶体粒子的数目为0.1 N A ( ) 答案 (1)√ (2) ✕ (3)√ (4) ✕ Ⅲ. 考查电解质溶液中粒子的数目 (1)1 L 0.5 mol·L -1 的NaClO溶液中含ClO - 0.5 N A ( ) (2)1 L 0.1 mol·L -1 的NaHCO 3 溶液中,HC 与C 的离子数之和为 0.1 N A ( ) (3)25 ℃时,pH=13的NaOH溶液中,含OH - 的数目为0.1 N A ( ) 答案 (1) ✕ (2) ✕ (3) ✕ Ⅳ .考查氧化还原反应中电子转移的数目 (1)1 mol Na与足量O 2 反应,生成Na 2 O和Na 2 O 2 的混合物,转移的电 子数为 N A ( ) (2)1 mol Na 2 O 2 与足量CO 2 充分反应转移的电子数为2 N A ( ) (3)向FeI 2 溶液中通入适量Cl 2 ,当有1 mol Fe 2+ 被氧化时,共转移电子 的数目为 N A ( ) (4)1 mol Cl 2 与足量NaOH溶液反应转移电子数为2 N A ( ) 答案 (1)√ (2) ✕ (3) ✕ (4) ✕ Ⅴ. 考查可逆反应 (1)1 mol Cl 2 通入足量水中生成HClO的分子数为 N A ( ) (2)一定条件下,0.5 mol N 2 与足量H 2 充分反应生成NH 3 的分子数为 N A ( ) (3)密闭容器中2 mol NO与1 mol O 2 充分反应,生成NO 2 的分子数 为2 N A ( ) 答案 (1) ✕ (2) ✕ (3) ✕ Ⅵ. 考查化学反应的“特殊性” (1)常温下,56 g铁片投入足量浓H 2 SO 4 中,生成 N A 个SO 2 分子 ( ) (2)50 mL 12 mol·L -1 的浓盐酸与足量的MnO 2 共热,生成0.15 N A 个Cl 2 分子 ( ) 答案 (1) ✕ (2) ✕ 1. (2018安徽合肥第三次质检)设 N A 为阿伏加德罗常数的值,下列 说法正确的是 ( ) A.10 g 46%乙醇水溶液中所含氢原子数目为0.6 N A B.0.1 mol·L -1 AlCl 3 溶液中含有Cl - 数目为0.3 N A C.标准状况下,4.48 L乙烯和环丁烷混合气中含碳原子数为0.4 N A D.7.8 g Na 2 O 2 与足量CO 2 或H 2 O反应转移电子数为0.1 N A 题组一 物质的量与阿伏加德罗常数 答案 D 10 g 46%乙醇水溶液中含4.6 g乙醇,即含0.1 mol乙醇, 0.1 mol乙醇含0.6 mol H,另外水分子中也有H,故溶液中所含氢原 子数目大于0.6 N A ,A不正确;0.1 mol·L -1 AlCl 3 溶液的体积未知,无法 计算其中含有Cl - 的数目,B不正确;1个乙烯分子中有2个C、1个环 丁烷分子中有4个C,环丁烷呈液态,其中所含碳原子数一定大于0. 4 N A ,C不正确;7.8 g Na 2 O 2 的物质的量为0.1 mol,其与足量CO 2 或H 2 O反应时,可以生成0.05 mol O 2 ,故转移电子数为0.1 N A ,D正确。 2. (2018福建龙岩教学质量检查)设 N A 为阿伏加德罗常数的值。下 列说法正确的是 ( ) A.1 L 0.1 mol/L FeCl 3 溶液最多可形成胶体粒子数为0.1 N A B.100 mL 98%( ρ =1.84 g/mL)硫酸与足量铜共热,充分反应后转移 的电子数为1.84 N A C.4.0 g O与D 2 O的混合物中所含质子数一定为2 N A D.标准状况下,2.24 L苯中含有的碳碳键数为0.6 N A 答案 C 一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故0.1 mol氯化铁所生成的胶粒数小于0.1 N A ,故A错误;98%( ρ =1.84 g/ mL)硫酸的物质的量浓度= = mol/L=18.4 mol/L,铜与稀硫酸不反应,一旦浓硫酸变稀,反应立即停止,故转移 的电子数小于1.84 N A ,故B错误; O与D 2 O的相对分子质量均为2 0,4.0 g O与D 2 O的物质的量= =0.2 mol,含有2 mol质 子,故C正确;标准状况下,苯非气体,不能根据气体摩尔体积来计 算其物质的量,故D错误。 3. (2018湖南衡阳一模)用 N A 表示阿伏加德罗常数的值,下列说法 正确的是 ( ) A.在1 L 0.1 mol/L的硫化钠溶液中,阴离子总数大于0.1 N A B.常温常压下,Na 2 O 2 与足量H 2 O反应,生成4.48 L O 2 ,转移电子的 数目为0.2 N A C.在密闭容器中充入1.5 mol H 2 和0.5 mol N 2 ,充分反应后可得到 NH 3 的分子数为 N A D.电解精炼铜的过程中,电路中每通过 N A 个电子,阳极溶解铜32 g 答案 A Na 2 S电离产生的S 2- 发生水解反应:S 2- +H 2 O HS - + OH - ,故1 L 0.1 mol/L的Na 2 S溶液中阴离子总数大于0.1 N A ,A正确;2 Na 2 O 2 +2H 2 O 4NaOH+O 2 ↑,每生成1 mol氧气转移电子总数2 mol,4.48 L气体在常温常压下的物质的量不是0.2 mol,所以转移 的电子数不是0.2 N A ,B项错误;N 2 与H 2 的反应是可逆反应,存在化 学平衡状态,0.5 mol N 2 不能够完全转化为1 mol NH 3 ,C项错误;精 炼铜的过程,粗铜做阳极,粗铜中比Cu活泼的金属Zn、Fe等优先 失去电子溶解,所以当阳极溶解32 g铜时,转移的电子数大于1 mol,即电路中每通过 N A 个电子,阳极溶解铜不足32 g,D项错误。 归纳总结 1. 注意气体摩尔体积的适用条件及物质的状态 一要看是否为标准状况下;二要看物质在标准状况下是否为气态, 如CCl 4 、水、液溴、SO 3 、己烷、苯等是非气体。 2. 注意与计算无关的一些干扰条件 给出标准状况下非气体的物质的量或质量,干扰判断,实质上,此 时物质所含的粒子数与温度、压强等外界条件无关。 3. 注意物质的组成与结构 (1)特殊物质中所含微粒(分子、原子、电子、质子、中子等)的 数目,如Ne、D 2 O、 18 O 2 、O 3 、P 4 、H 37 Cl等。 (2)物质中所含化学键的数目,如SiO 2 、CO 2 、C n H 2 n +2 等。 (3)最简式相同的物质中的微粒数目,如NO 2 和N 2 O 4 、乙烯和丙烯 等。 4. 注意难电离、易水解的粒子数目 一看是否有弱电解质的电离;二看是否有离子的水解;三看是否指 明了溶液的体积。 5. 注意电子转移(得失)数目 一要注意是否发生歧化反应,二要注意变价元素,三要注意过量问 题。 反应 参考物质 转移电子的物质的量或电子数目 Na 2 O 2 +CO 2 (或H 2 O) 1 mol Na 2 O 2 1 mol或 N A 1 mol O 2 2 mol或2 N A Cl 2 +NaOH 1 mol Cl 2 1 mol或 N A Cl 2 +Fe 1 mol Cl 2 2 mol或2 N A 1 mol Fe 3 mol或3 N A 6. 注意一些特殊条件 一要注意一些特殊的反应,如NO和O 2 不需要条件即可反应,NO 2 和N 2 O 4 之间存在相互转化,合成氨反应等属于可逆反应;二要注意 特殊的物质,如摩尔质量相同或成整数倍的关系的物质:N 2 和 CO、C 2 H 4 ;Na 2 S和Na 2 O 2 ;CaCO 3 与KHCO 3 ;NaHCO 3 与MgCO 3 ;Cu 2 S 和CuO;NO 2 与N 2 O 4 。 4. (电荷守恒)某硫酸铝和硫酸镁的中性混合液中, c (Mg 2+ )=2 mol·L -1 , c (S )=6.5 mol·L -1 。若将200 mL的此混合液中的Mg 2+ 和Al 3+ 分 离,至少应加入1.6 mol·L -1 的NaOH溶液的体积为 ( ) A.0.5 L B.1.625 L C.1.8 L D.2 L 题组二 “物质的量”在化学反应中的应用 答案 D 若忽略溶液中的H + 和OH - ,根据电荷守恒得2 c (Mg 2+ )+3 c (Al 3+ )=2 c (S ),2 × 2 mol·L -1 +3 c (Al 3+ )=2 × 6.5 mol·L -1 ,则 c (Al 3+ )=3 mol·L -1 。加入NaOH溶液使Mg 2+ 、Al 3+ 分离,此时NaOH转化成Na 2 SO 4 和NaAlO 2 ,此混合溶液的电荷守恒关系(忽略溶液中的H + 和 OH - )为 n (Na + )= )+ n (Al )=2 × 6.5 mol·L -1 × 0.2 L+3 mol·L -1 × 0. 2 L=3.2 mol, V (NaOH)= =2 L。 5. (原子守恒)(2018天津和平二模)利用绿矾制备还原铁粉的工业 流程如下: (1)干燥过程主要是为了脱去游离水和结晶水,过程中会有少量 FeCO 3 · n H 2 O在空气中被氧化为FeOOH,该反应的化学方程式为 。 (2)取干燥后的FeCO 3 样品12.49 g,焙烧,最终得到还原铁粉6.16 g, 计算样品中杂质FeOOH的质量 。 答案 (1)4FeCO 3 · n H 2 O+O 2 4FeOOH+4CO 2 +(4 n -2)H 2 O (2)0.89 g 解析 (1)干燥过程主要是为了脱去游离水和结晶水,过程中会有 少量FeCO 3 · n H 2 O被空气氧化为FeOOH,根据氧化还原反应中的得 失电子守恒和原子守恒规律,化学方程式为4FeCO 3 · n H 2 O+O 2 4FeOOH+4CO 2 +(4 n -2)H 2 O。 (2)设样品中FeCO 3 的物质的量为 x mol,FeOOH的物质的量为 y mol,则根据质量守恒定律和铁原子守恒列方程如下:116 x +89 y =1 2.49, x + y = =0.11, y =0.01,样品中杂质FeOOH的质量为0.01 mol × 89 g·mol -1 =0.89 g。 6. (关系式法)(2017江苏单科,18节选)碱式氯化铜是重要的无机杀 菌剂。碱式氯化铜有多种组成,可表示为Cu a (OH) b Cl c · x H 2 O。为 测定某碱式氯化铜的组成,进行下列实验:①称取样品1.116 0 g,用 少量稀HNO 3 溶解后配成100.00 mL溶液A;②取25.00 mL溶液A, 加入足量AgNO 3 溶液,得AgCl 0.172 2 g;③另取25.00 mL溶液A,调 节pH 4~5,用浓度为0.080 00 mol·L -1 的EDTA(Na 2 H 2 Y·2H 2 O)标准 溶液滴定Cu 2+ (离子方程式为Cu 2+ +H 2 Y 2- CuY 2- +2H + ),滴定至终 点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出 计算过程)。 答案 n (Cl - )= n (AgCl) × = × =4.800 × 10 -3 mol n (Cu 2+ )= n (EDTA) × =0.080 00 mol·L -1 × 30.00 mL × 10 -3 L· mL -1 × =9.600 × 10 -3 mol n (OH - )=2 n (Cu 2+ )- n (Cl - )=2 × 9.600 × 10 -3 mol-4.800 × 10 -3 mol=1.440 × 1 0 -2 mol m (Cl - )=4.800 × 10 -3 mol × 35.5 g·mol -1 =0.170 4 g m (Cu 2+ )=9.600 × 10 -3 mol × 64 g·mol -1 =0.614 4 g m (OH - )=1.440 × 10 -2 mol × 17 g·mol -1 =0.244 8 g n (H 2 O)= =4.800 × 10 -3 mol a ∶ b ∶ c ∶ x = n (Cu 2+ )∶ n (OH - )∶ n (Cl - )∶ n (H 2 O)=2∶3∶1∶1 化学式为Cu 2 (OH) 3 Cl·H 2 O 解析 根据AgCl的质量可求得 n (Cl - ),根据EDTA的用量可求得 n (Cu 2+ ),然后利用电荷守恒求得 n (OH - ),再根据样品的总质量及Cl - 、Cu 2+ 、OH - 的质量可求得 n (H 2 O),最后求出4种粒子的物质的量 的最简整数比即可得到样品的化学式。 归纳总结 化学计算中常用的方法 (1)守恒法:原子守恒、电荷守恒、得失电子守恒。 (2)关系式法:如工业制硫酸中的关系式FeS 2 ~2SO 2 ~2SO 3 ~2H 2 SO 4 。 (3)差量法:质量差、物质的量差、气体体积差。 题组三 物质的量的计算在图像中的应用 7. 8.34 g FeSO 4 ·7H 2 O(相对分子质量:278)样品受热脱水过程的热 重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确 的是 ( ) A.温度为78 ℃时固体物质M的化学式为FeSO 4 ·5H 2 O B.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃得到一种 固体物质Q,同时有两种无色气体生成,Q的化学式为Fe 3 O 4 C.在隔绝空气条件下,N得到P的化学方程式为FeSO 4 ·H 2 O FeSO 4 +H 2 O D.温度为159 ℃时固体N的化学式为FeSO 4 ·2H 2 O 答案 C 8.34 g FeSO 4 ·7H 2 O 样品的物质的量为 =0.03 mol,其中 m (H 2 O)=0.03 mol × 7 × 18 g/mol=3.78 g,如果晶体失去全 部结晶水,固体的质量应为8.34 g-3.78 g=4.56 g,可知在加热到373 ℃之前,晶体失去部分结晶水。温度为78 ℃时,固体质量为6.72 g,其中 m (FeSO 4 )=0.03 mol × 152 g/mol=4.56 g, m (H 2 O)=6.72 g-4.56 g=2.16 g, n (H 2 O)= =0.12 mol, n (H 2 O)∶ n (FeSO 4 )=0.12 mol∶0.03 mol=4∶1,则M的化学式为FeSO 4 ·4H 2 O,A项错误;加热 至650 ℃时,固体的质量为2.40 g,其中 n (Fe)= n (FeSO 4 ·7H 2 O)=0.03 mol, m (Fe)=0.03 mol × 56 g/mol=1.68 g,则固体中 m (O)=2.40 g-1.68 g=0.72 g, n (O)= =0.045 mol, n (Fe)∶ n (O)=0.03 mol∶0.045 mol=2∶3,所以固体物质Q的化学式为Fe 2 O 3 ,B项错误;固体N的质 量为5.10 g,其中 m (FeSO 4 )=0.03 mol × 152 g/mol=4.56 g, m (H 2 O)=5. 10 g-4.56 g=0.54 g, n (H 2 O)= =0.03 mol, n (H 2 O)∶ n (FeSO 4 ) =0.03 mol∶0.03 mol=1∶1,所以N的化学式为FeSO 4 ·H 2 O,而P的化 学式为FeSO 4 ,则由N得到P的化学方程式为FeSO 4 ·H 2 O FeSO 4 +H 2 O,C项正确,D项错误。 8. (2018甘肃重点高中联考)CoC 2 O 4 是制备钴的氧化物的重要原 料。下图为二水合草酸钴(CoC 2 O 4 ·2H 2 O)在空气中受热的质量变 化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。 (1)通过计算确定C点剩余固体的化学成分为 (填化学 式)。写出B点对应的物质与O 2 在225~300 ℃发生反应的化学方 程式: 。 (2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化 合价为+2、+3),用480 mL 5 mol·L -1 盐酸恰好完全溶解固体,得到 CoCl 2 溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物 中Co、O的物质的量之比(写出计算过程)。 答案 (1)Co 3 O 4 (写成CoO·Co 2 O 3 亦可) 3CoC 2 O 4 +2O 2 Co 3 O 4 +6CO 2 (2)标准状况下,由得失电子守恒有 n (Co 3+ )=2 n (Cl 2 )=2 × =0.4 mol 由元素守恒和电荷守恒有 n (Co) 总 = n (Co 2+ ) 溶液 =0.5 n (Cl - )=0.5 × 0.48 L × 5 mol·L -1 - × 2=1 mol, 所以钴氧化物中 n (Co 2+ )=1 mol-0.4 mol=0.6 mol 根据钴氧化物中元素化合价代数和为0有 n (O)= =1.2 mol 故 n (Co)∶ n (O)=1 mol∶1.2 mol=5∶6。 解析 CoC 2 O 4 ·2H 2 O CoC 2 O 4 Co x O y ,C点应为钴的氧化物, 18.3 g晶体中钴的物质的量为0.1 mol,铝的质量为5.9 g,8.03 g Co x O y 中的氧的物质的量为 ≈ 0.133 mol,故 = ≈ ,其化学式为Co 3 O 4 。 考点二 一定物质的量浓度溶液的配制与计算 1. 明确溶液配制过程中的“四数据” (1)记录质量或体积时保留一位小数。 (2)选择容量瓶时,要指明容量瓶的规格。 (3)转移溶液时要洗涤烧杯 次。 (4)定容时液面距刻度线1~2 cm时,改用 滴加蒸馏水。 答案 (3)2~3 (4)胶头滴管 2. 配制480 mL 1 mol/L的NaCl溶液所需的仪器有 。 答案 500 mL容量瓶、胶头滴管、药匙、托盘天平、烧杯、玻 璃棒 3. 配制80 mL 1 mol/L的盐酸所需的仪器有 (用5 mol/L的浓盐酸配制)。 答案 100 mL容量瓶、胶头滴管、25 mL量筒、烧杯、玻璃棒 4. 用“偏大”“偏小”或“无影响”填空(溶质质量分数): (1)用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤 液转移至小烧杯中 。 (2)用量筒量取浓硫酸时,仰视读数 。 (3)配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解, 未经冷却立即转移到容量瓶中并定容 。 (4)转移到容量瓶的过程中,有少量的溶液溅出 。 (5)转移后,未洗涤小烧杯和玻璃棒,或者未将洗涤液一并转移至 容量瓶中 。 (6)定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度 线 。 (7)定容摇匀后,发现液面下降,继续加水至刻度线 。 (8)配制前容量瓶中有水滴 。 答案 (1)偏大 (2)偏大 (3)偏大 (4)偏小 (5)偏小 (6)偏小 (7)偏小 (8)无影响 题组一 一定物质的量浓度溶液的配制 1. (2018四川凉山州第三次诊断)仅用下表提供的玻璃仪器(自选 非玻璃仪器)就能实现相应实验目的的是 ( ) 选项 实验目的 玻璃仪器 A 分离硝酸钾和氯化钠混合物 烧杯、酒精灯、玻璃棒、分液漏斗 B 配制450 mL 2 mol·L -1 氯化钠溶液 500 mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 C 除去氢氧化铝胶体中的泥沙 漏斗(带半透膜)、烧杯、玻璃棒 D 从食盐水中获得NaCl晶体 坩埚、玻璃棒、酒精灯、泥三角 答案 B 分离硝酸钾和氯化钠混合物需要进行重结晶,所以应 该用普通漏斗进行过滤,A项错误;除去氢氧化铝胶体中的泥沙,应 该用带滤纸的漏斗直接过滤,C项错误;从食盐水中获得NaCl晶体 的操作是蒸发,应该在蒸发皿中进行,D项错误。 2. 用98%的浓H 2 SO 4 (密度为1.84 g/mL)配制1 mol·L -1 的稀H 2 SO 4 10 0 mL,配制过程中可能用到下列仪器:①100 mL量筒;②10 mL量 筒;③50 mL烧杯;④托盘天平;⑤100 mL容量瓶;⑥胶头滴管;⑦玻 璃棒。按使用的先后顺序排列正确的是 ( ) A.②⑥③⑦⑤ B.④③⑤⑦⑥ C.①③⑦⑤⑥ D.②⑤⑦⑥ 答案 A 98%的浓H 2 SO 4 中溶质的物质的量浓度 c = = mol·L -1 =18.4 mol·L -1 ,配制1 mol·L -1 的稀H 2 SO 4 100 mL需要浓硫酸的体积 V = ≈ 0.005 4 L,即5.4 mL。 配制一定物质的量浓度的溶液的步骤为量取、稀释、转移、洗 涤、定容、摇匀等,量取浓硫酸时需要用到10 mL量筒和胶头滴 管,稀释浓硫酸时需要用到烧杯和玻璃棒,转移溶液时需要用到玻 璃棒,定容时需要用到100 mL容量瓶和胶头滴管,所以正确顺序 为②⑥③⑦⑤。 归纳总结 配制溶液所需仪器及配制步骤 题组二 误差分析与判断 3. 配制250 mL 0.100 mol·L -1 的盐酸时,下列操作会使配得的溶液 中HCl的物质的量浓度偏大的是 ( ) A.移液后未洗涤烧杯 B.在容量瓶中进行定容时,仰视刻度线 C.在容量瓶中进行定容时,俯视刻度线 D.定容后摇匀,发现液面低于刻度线,再加水至刻度线 答案 C A项,移液后未洗涤烧杯,导致氯化氢的物质的量偏小, 所配溶液浓度偏小;B项,在容量瓶中进行定容时,仰视刻度线,导 致所配溶液体积偏大,浓度偏小;C项,在容量瓶中进行定容时,俯 视刻度线,导致所配溶液体积偏小,浓度偏大;D项,再加水会导致 所配溶液体积偏大,浓度偏小。 4. 需要配制500 mL 0.5 mol·L -1 氢氧化钠溶液,经测定实际所配氢 氧化钠溶液的浓度为0.45 mol·L -1 。可能的原因是 ( ) A.定容时溶液没有冷却至室温 B.容量瓶没有烘干 C.称量氢氧化钠固体时砝码和物质放反了 D.定容时仰视读数 答案 D 溶液未冷却至室温就定容会导致所配溶液体积偏小, 则浓度偏高,A错误;容量瓶没有烘干,对所配溶液的浓度没有影 响,B错误;本实验需称量10.0 g氢氧化钠固体,不用游码,砝码和物 质放反对结果没有影响,C错误;定容时仰视读数,使所配溶液体积 偏大,则浓度偏小,D正确。 归纳总结 1. 误差分析思维流程 2. 俯视、仰视对结果的影响 题组三 物质的量浓度的计算 5. 在200 mL某硫酸盐溶液中含有1.5 N A 个硫酸根离子( N A 表示阿伏 加德罗常数的值),同时含有 N A 个金属阳离子,则该硫酸盐的物质 的量浓度为 ( ) A.1 mol/L B.2.5 mol/L C.5 mol/L D.2 mol/L 答案 B 1.5 N A 个硫酸根离子的物质的量为1.5 mol, N A 个金属阳 离子的物质的量为1 mol,则硫酸根离子与金属阳离子的物质的量 之比为3∶2,所以该硫酸盐可以表示为M 2 (SO 4 ) 3 ,则硫酸盐的物质 的量为0.5 mol,所以该硫酸盐的物质的量浓度为 =2.5 mol/L。 6. 取100 mL 0.3 mol·L -1 的硫酸溶液和300 mL 0.25 mol·L -1 的硫酸 溶液加水稀释至500 mL,该混合溶液中H + 的物质的量浓度是 ( ) A.0.21 mol·L -1 B.0.42 mol·L -1 C.0.56 mol·L -1 D.0.26 mol·L -1 答案 B 所得混合溶液中 n (H + )=(0.1 L × 0.3 mol·L -1 +0.3 L × 0.25 mol·L -1 ) × 2=0.21 mol,所以 c (H + )= =0.42 mol·L -1 。 归纳总结 灵活运用物质的量浓度计算中的两个定律 1. 稀释定律 (1) m 1 · ω 1 = m 2 · ω 2 ( m 1 、 m 2 分别为稀释前、后溶液的质量; ω 1 、 ω 2 分别为稀释前、后溶质的质量分数) (2) V 1 · c 1 = V 2 · c 2 ( V 1 、 V 2 分别为稀释前、后溶液的体积; c 1 、 c 2 分别为稀释前、后溶液的浓度 ) 2. 电荷守恒定律:溶液中阳离子所带正电荷总数等于阴离子所带 负电荷总数。 热点题型突破2 N A 的应用及正误判断 主要命题点:(1)物质中所含的微粒数目;(2)气体摩尔体积的 适用条件;(3)氧化还原反应中电子转移的数目;(4)电解质的电离 和盐类的水解;(5)分子或晶体结构中的化学键数目。 C.向含有0.2 mol NH 4 Al(SO 4 ) 2 的溶液中滴加NaOH溶液至沉淀完 全溶解,消耗OH - 的数目为 N A D.60 g SiO 2 和12 g金刚石中各含有4 N A 个Si—O键和2 N A 个C—C键 破题关键 解答本题的关键是明确标准状况下HF是否为气体。 典例 (2018湖南岳阳一模)设 N A 为阿伏加德罗常数的值,下列有 关叙述不正确的是 ( ) A.标准状况下,2.24 L HF与1.8 g H 2 O所含电子数目均为 N A B.标准状况下, V L气态烯烃(C n H 2 n )含中子的数目为 解析 HF的沸点是19.5 ℃,标准状况下,氟化氢不是气体,不能使 用标准状况下的气体摩尔体积,无法计算2.24 L HF的物质的量,A 项错误;C原子的质子数是6,中子数是6,H原子的质子数是1,中子 数是0,所以1 mol C n H 2 n 中含有中子6 n mol,所以 N = × 6 n × N A = ,B项正确;根据N +OH - NH 3 ↑+H 2 O,Al 3+ +4OH - Al +2H 2 O,0.2 mol N 消耗0.2 mol OH - ,0.2 mol Al 3+ 转变成Al 消耗0.8 mol OH - ,所以共消耗1 mol OH - ,即消耗OH - 的数目为 N A ,C 项正确;60 g SiO 2 的物质的量是1 mol,1 mol SiO 2 中有4 mol Si—O 键,12 g金刚石的物质的量是1 mol,1 mol金刚石含2 mol C—C键, D项正确。 答案 A 解题必备 应用阿伏加德罗常数时常见的陷阱 陷阱一:抓“两看”,突破状态陷阱 一看物质是否处于标准状况。 二看物质在标准状况下的聚集状态是否为气态。如:H 2 O、CCl 4 、 SO 3 、HF在标准状况下为非气态。 陷阱二:审“组成”“结构”,突破微观粒子数目陷阱 一审气体分子组成。如:He、Ne为单原子分子。 二审构成物质的粒子是否水解。 1. (2018湖南教育联盟联考)设 N A 为阿伏加德罗常数的值。下列有 关叙述正确的是 ( ) A.2.0 g O与2.0 g D 2 O中所含的中子数均为 N A B.14 g分子式为C n H 2 n 的烃中含有的碳碳双键数为 N A / n C.100 g质量分数为17%的H 2 O 2 溶液中氢原子数为 N A D.常温下,将56 g铁片投入到足量的浓硫酸中生成SO 2 的分子数为 1.5 N A 答案 A 2.0 g O中所含的中子数为 × (18-8) N A mol -1 = N A ,2.0 g D 2 O中所含的中子数为 × [(2-1) × 2+(16-8)] N A mol -1 = N A ,A项正确;14 g分子式为C n H 2 n 的烯烃的物质的量为 = mol,含有的碳碳双键数为 N A / n ,但分子式为C n H 2 n 的 烃不一定为烯烃,如是环烷烃,则没有碳碳双键,B项错误;水和过 氧化氢中均含有氢原子,100 g质量分数为17%的H 2 O 2 溶液中氢原 子数大于 N A ,C项错误;常温下,铁在浓硫酸中钝化,D项错误。 2. 用 N A 表示阿伏加德罗常数的值。下列叙述不正确的是( ) A.含有氢原子数为0.4 N A 的CH 3 OH分子中含有的共价键数目为0. 5 N A B. a g某气体含分子数为 b , c g该气体在标准状况下体积为 L C.电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数 目为2 N A D.常温下,1.0 L pH=13的Ba(OH) 2 溶液中含有的OH - 数目为0.1 N A 答案 C 电解饱和食盐水,阳极产生气体的状态不明确,22.4 L 气体的物质的量无法计算,电路中通过的电子的数目无法计算,故 C错误。 3. (2018江西景德镇第二次联考)设 N A 为阿伏加德罗常数的值。下 列有关叙述错误的是 ( ) A.常温常压下,3.6 g H 2 O中所含电子数为2 N A B.1 mol NH 4 HCO 3 晶体中,含有N 、NH 3 和NH 3 ·H 2 O的总数为 N A C.标准状况下,22.4 L O 2 和22.4 L NO混合后所得气体分子数小于 1.5 N A D.由1 mol CH 3 COONa和少量CH 3 COOH形成的中性溶液中,CH 3 COO - 数目为 N A 答案 B 3.6 g H 2 O的物质的量为0.2 mol,所含电子数为0.2 × (1 × 2+8) × N A =2 N A ,A正确;NH 4 HCO 3 为离子化合物,晶体中只存在N 和HC 两种离子,不含有NH 3 和NH 3 ·H 2 O,B错误;标准状况下,一氧 化氮和氧气反应生成二氧化氮:2NO+O 2 2NO 2 ,二氧化氮能转 化为四氧化二氮:2NO 2 N 2 O 4 ,所以1 mol O 2 和1 mol NO混合后 所得气体分子数小于1.5 N A ,C正确;由1 mol CH 3 COONa和少量CH 3 COOH形成的中性溶液中,氢离子与氢氧根离子浓度相等,根据 电荷守恒,则醋酸根离子与钠离子浓度及数目相等,钠离子的物质 的量为1 mol,则CH 3 COO - 数目为 N A ,D正确。 4. (2018河南八市第二次测评)设 N A 为阿伏加德罗常数的值。下列 说法中正确的是 ( ) A.20 g D 2 O中含有的中子数为8 N A B.3.36 L NO 2 与足量的水充分反应后,生成0.05 N A 个NO分子 C.1 mol碳酸钠和碳酸氢钠的混合物中碳酸根离子的数目为 N A D.3 mol单质Fe完全燃烧转变为Fe 3 O 4 ,失去8 N A 个电子 答案 D 20 g D 2 O中含有的中子数为 × 10 N A mol -1 =10 N A ,A项错误;未指明气体所处状况,B项错误;NaHCO 3 固体中不存 在C ,C项错误;3 mol单质Fe在氧气中完全转变为Fe 3 O 4 ,Fe的化 合价变为+2、+3,失去8 N A 个电子,D项正确。 5. (2018陕西榆林四模)设 N A 为阿伏加德罗常数的值。下列说法错 误的是 ( ) A.标准状况下,2.24 L H 2 S中含有0.1 N A 个H 2 S分子 B.常温常压下,7.0 g由丁烯与丙烯组成的混合气体中含有的氢原 子数目为 N A C.常温下,将2.7 g铝片投入足量的浓硫酸中,转移电子的数目为0.3 N A D.向1 L的密闭容器中充入46 g NO 2 气体,容器中氮原子的数目为 N A 答案 C 浓硫酸与铝在常温下发生钝化,所以常温下,2.7 g铝片 投入足量的浓硫酸中,铝失去的电子数小于0.3 N A ,故C错误。 6. (2018广东汕头二模)设 N A 为阿伏加德罗常数的值。下列说法错 误的是 ( ) A.8.4 g NaHCO 3 固体中含有的离子总数为0.3 N A B.标准状况下,13.8 g NO 2 与水充分反应转移的电子数目为0.2 N A C.1 L 1 mol·L -1 的NaClO溶液中ClO - 的数目小于 N A D.常温常压下,23 g Na与O 2 充分反应,生成Na 2 O和Na 2 O 2 混合物时, 转移电子总数为 N A 答案 A NaHCO 3 固体中含有钠离子和碳酸氢根离子,8.4 g NaHCO 3 固体的物质的量为 =0.1 mol,含有的离子总数为 0.2 N A ,故A错误。 1. (2018课标Ⅰ,10,6分) N A 是阿伏加德罗常数的值。下列说法正确 的是 ( ) A.16.25 g FeCl 3 水解形成的Fe(OH) 3 胶体粒子数为0.1 N A B.22.4 L(标准状况)氩气含有的质子数为18 N A C.92.0 g甘油(丙三醇)中含有羟基数为1.0 N A D.1.0 mol CH 4 与Cl 2 在光照下反应生成的CH 3 Cl分子数为1.0 N A 答案 B 16.25 g FeCl 3 的物质的量是0.1 mol,Fe 3+ 水解生成的Fe (OH) 3 胶体粒子是若干Fe(OH) 3 的聚集体,故胶体粒子数目远小于 0.1 N A ,A项错误;Ar是单原子分子,22.4 L(标准状况)氩气的物质的 量是1 mol,含有的质子数为18 N A ,B项正确;甘油(丙三醇)的分子式 为C 3 H 8 O 3 ,其摩尔质量是92 g·mol -1 ,则92.0 g甘油含有羟基的数目 为3.0 N A ,C项错误;甲烷与氯气反应的产物中CH 3 Cl、CH 2 Cl 2 、 CHCl 3 、CCl 4 同时存在,1.0 mol CH 4 与足量氯气反应时上述四种 有机物的总物质的量为1.0 mol,D项错误。 2. (2018课标Ⅱ,11,6分) N A 代表阿伏加德罗常数的值。下列说法正 确的是 ( ) A.常温常压下,124 g P 4 中所含P—P键数目为4 N A B.100 mL 1 mol·L -1 FeCl 3 溶液中所含Fe 3+ 的数目为0.1 N A C.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2 N A D.密闭容器中,2 mol SO 2 和1 mol O 2 催化反应后分子总数为2 N A 答案 C 本题考查物质的量与阿伏加德罗常数的应用。1 mol P 4 分子中有6 mol P—P键,A不正确;Fe 3+ 水解,100 mL 1 mol·L -1 Fe- Cl 3 溶液中Fe 3+ 数目小于0.1 N A ,B不正确;标准状况下,11.2 L甲烷 (CH 4 )和乙烯(C 2 H 4 )混合物的物质的量为0.5 mol,其中含氢原子的 物质的量为2 mol,C正确;SO 2 与O 2 的反应为可逆反应,无法进行到 底,2 mol SO 2 和1 mol O 2 充分反应后分子总数大于2 N A ,D不正确。 3. (2018课标Ⅲ,8,6分)下列叙述正确的是 ( ) A.24 g镁与27 g铝中,含有相同的质子数 B.同等质量的氧气和臭氧中,电子数相同 C.1 mol重水与1 mol水中,中子数比为2∶1 D.1 mol乙烷和1 mol乙烯中,化学键数相同 答案 B 本题考查原子结构与化学键。A项,24 g镁和27 g铝的 物质的量均为1 mol,1 mol镁含有的质子数为12 N A ,1 mol铝含有的 质子数为13 N A ,错误;B项,等质量的O 2 和O 3 中含有等物质的量的氧 原子,含有的电子数相同,正确;C项,1 mol重水含有10 mol中子,1 mol水含有8 mol中子,故中子数比为5∶4,错误;D项,乙烷的结构 式为 ,1 mol乙烷中含有的化学键为7 mol,乙烯的 结构式为 ,1 mol乙烯中含有的化学键为5 mol,错误。 4. (2017课标Ⅱ,8,6分)阿伏加德罗常数的值为 N A 。下列说法正确 的是 ( ) A.1 L 0.1 mol·L -1 NH 4 Cl溶液中,N 的数量为0.1 N A B.2.4 g Mg与H 2 SO 4 完全反应,转移的电子数为0.1 N A C.标准状况下,2.24 L N 2 和O 2 的混合气体中分子数为0.2 N A D.0.1 mol H 2 和0.1 mol I 2 于密闭容器中充分反应后,其分子总数为 0.2 N A 答案 D 由于NH 4 Cl溶液中存在N 的水解,所以1 L 0.1 mol·L -1 NH 4 Cl溶液中,N 的数量少于0.1 N A ,A错;2.4 g Mg与H 2 SO 4 完全 反应,转移的电子数为0.2 N A ,B错;标准状况下,2.24 L N 2 和O 2 的混 合气体为0.1 mol,所含分子数为0.1 N A ,C错;H 2 与I 2 反应的化学方程 式为H 2 (g)+I 2 (g) 2HI(g),反应前后气体分子总数不变,D正 确。 5. (2017课标Ⅲ,10,6分) N A 为阿伏加德罗常数的值。下列说法正确 的是 ( ) A.0.1 mol的 11 B中,含有0.6 N A 个中子 B.pH=1的H 3 PO 4 溶液中,含有0.1 N A 个H + C.2.24 L(标准状况)苯在O 2 中完全燃烧,得到0.6 N A 个CO 2 分子 D.密闭容器中1 mol PCl 3 与1 mol Cl 2 反应制备PCl 5 (g),增加2 N A 个P —Cl键 答案 A 11 B的质量数为11,质子数为5,则中子数为6,A正确;题 中未给出溶液的体积,B不正确;标准状况下苯为固体,C不正确; PCl 3 与Cl 2 制备PCl 5 的反应为可逆反应,D不正确。 6. (2016课标Ⅰ,8,6分)设 N A 为阿伏加德罗常数值。下列有关叙述 正确的是 ( ) A.14 g乙烯和丙烯混合气体中的氢原子数为2 N A B.1 mol N 2 与4 mol H 2 反应生成的NH 3 分子数为2 N A C.1 mol Fe溶于过量硝酸,电子转移数为2 N A D.标准状况下,2.24 L CCl 4 含有的共价键数为0.4 N A 答案 A A项,乙烯和丙烯的最简式相同,为CH 2 ,故14 g乙烯和 丙烯混合气体中含氢原子数为2 N A ;B项,N 2 和H 2 的反应为可逆反 应,转化率不可能达到100%,因此生成的NH 3 分子数小于2 N A ;C项, 1 mol Fe和过量HNO 3 反应生成Fe 3+ ,电子转移数为3 N A ;D项,标准状 况下,CCl 4 呈液态。查看更多