- 2021-08-24 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年辽宁师大附中高二上学期10月月考试题 化学 Word版
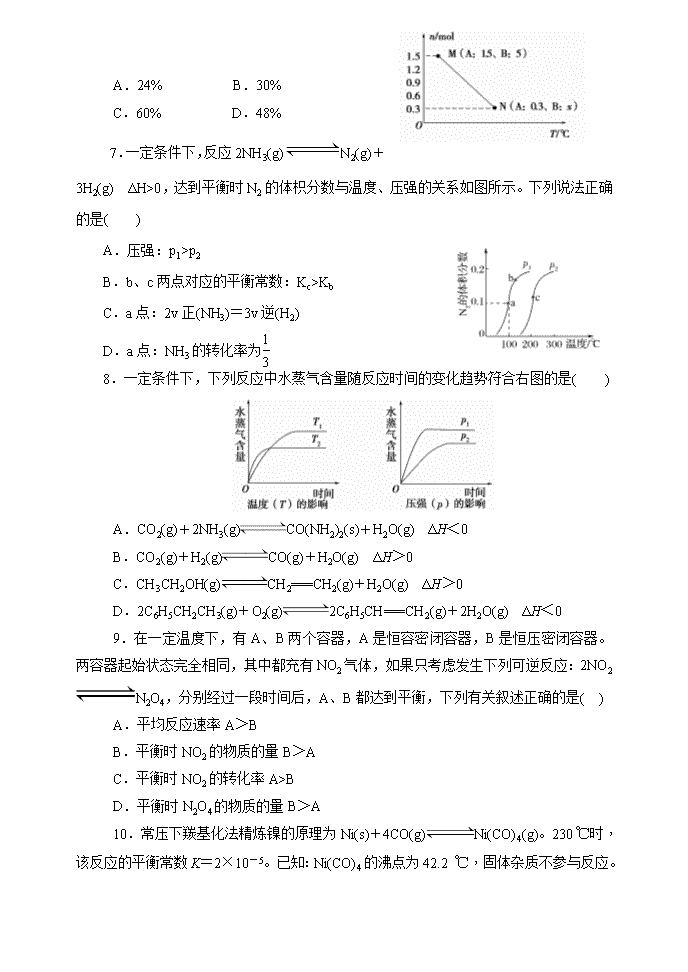
2019-2020学年辽宁师大附中高二上学期10月月考试题 化学 考试时间:50分钟 满分:100分 第 Ⅰ 卷 选择题(共51分) 一、选择题:本题共17个小题,每小题3分,共51分。在每小题给出的四个选项中,只有一个正确选项 1.下列措施对增大反应速率明显有效的是( ) A.Na与无水乙醇反应时增大无水乙醇的用量 B.Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸 C.在K2SO4与BaCl2两溶液反应时,增大压强 D.将炭块磨成炭粉用于燃烧 2.已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( ) A.加入催化剂,减小了反应的热效应 B.加入催化剂,可提高H2O2的平衡转化率 C.H2O2分解的热化学方程式:H2O2===H2O+1/2 O2 ΔH>0 D.反应物的总能量高于生成物的总能量 3.对于可逆反应:2SO2(g)+O2(g)2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( ) A.增大压强 B.升高温度 C.使用催化剂 D.多充入O2 4.在一定温度下,反应2HBr(g) H2(g)+Br2(g) ΔH>0,达到平衡时,要使混合气体颜色加深,可采取的方法是( ) A.缩小体积 B.减小压强 C.降低温度 D.增大氢气的浓度 5.使用一种试剂就能鉴别出来的一组是( ) A.苯、甲苯、己烯 B.甲苯、己烯、四氯化碳 C.己烯、汽油、苯 D.苯、甲苯、二甲苯 6.一定条件下,将一定量的A、B混合气体充入密闭容器中发生下列反应: 2A(g)+2B(g)C(g)+D(g) ΔH>0。当由M平衡到N平衡过程中,温度与对应变化及M、N平衡混合气体中某些气体的物质的量如图所示。则平衡M到平衡N过程中B的转化率是( ) A.24% B.30% C.60% D.48% 7.一定条件下,反应2NH3(g)N2(g)+3H2(g) ΔH>0,达到平衡时N2的体枳分数与温度、压强的关系如图所示。下列说法正确的是( ) A.压强:p1>p2 B.b、c两点对应的平衡常数:Kc>Kb C.a点:2v正(NH3)=3v逆(H2) D.a点:NH3的转化率为 8.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合右图的是( ) A.CO2(g)+2NH3(g)CO(NH2)2(s)+H2O(g) ΔH<0 B.CO2(g)+H2(g)CO(g)+H2O(g) ΔH>0 C.CH3CH2OH(g)CH2===CH2(g)+H2O(g) ΔH>0 D.2C6H5CH2CH3(g)+O2(g)2C6H5CH===CH2(g)+2H2O(g) ΔH<0 9.在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器。两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2N2O4,分别经过一段时间后,A、B都达到平衡,下列有关叙述正确的是( ) A.平均反应速率A>B B.平衡时NO2的物质的量B>A C.平衡时NO2的转化率A>B D.平衡时N2O4的物质的量B>A 10.常压下羰基化法精炼镍的原理为Ni(s)+4CO(g)Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃, 固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。下列判断正确的是( ) A.增加c(CO),平衡向正向移动,反应的平衡常数增大 B.第一阶段,在30 ℃和50 ℃两者之间选择反应温度,选50 ℃ C.第二阶段,Ni(CO)4分解率较低 D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) 11.已知:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。对于下列稀溶液或固体之间的反应: ①HCl(aq)+NH3·H2O (aq)===NH4Cl(aq)+H2O(l) ΔH1=-a kJ·mol-1 ②HCl(aq)+NaOH(s)===NaCl(aq)+H2O(l) ΔH2=-b kJ·mol-1 ③HNO3 (aq)+NaOH (aq)===NaNO3 (aq)+H2O(l) ΔH3=-c kJ·mol-1 下列有关a、b、c三者的大小关系中正确的是( ) A.a>b>c>57.3 B.a>b=c=57.3 C.b>c=57.4>a D.ΔH2>ΔH3>ΔH1 12.下列叙述与图象对应符合的是( ) A.对于达到平衡状态的N2(g)+3H2(g)2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动 B.P2>P1,T1>T2 C.该图象表示的方程式为:2A===B+3C D.对于反应2X(g)+3Y(g)2Z(g) ΔH<0,y可以表示Y的百分含量 13.一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是( ) A.反应CH4+H2O3H2+CO,每消耗1 mol CH4转移12 mol电子 B.电极A上H2参与的电极反应为H2+2OH--2e-===2H2O C.电池工作时,CO向电极B移动 D.电极B上发生的电极反应为O2+2CO2+4e-===2CO 14.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)I(aq)。测得不同温度下该反应的平衡常数如下表: t/℃ 5 15 25 35 50 K 1 100 841 680 533 409 下列说法正确的是( ) A.反应I2(aq)+I-(aq)I(aq)的ΔH>0 B.利用该反应可以除去硫粉中少量的碘单质 C.在上述平衡体系中加入苯,平衡不移动 D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于680 15.温度为T时,向2 L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)C(g)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( ) A.反应前10 min内反应的平均速率为v(D)=0.3 mol·L-1·min-1 B.若平衡时保持温度不变,压缩容器体积,平衡逆向移动,平衡常数K值减小 C.反应至15 min时,其他条件不变,改变的条件可能是缩小容器体积 D.反应至15 min时,其他条件不变,改变的条件可能是降低反应体系温度 16.科学家提出如下光分解法制备氢气: ①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+O2(g)+2H+(aq) ΔH1 ②Ce3+(aq)+H2O(l)===Ce4+(aq)+H2(g)+OH-(aq) ΔH2 ③H2O(l)===H+(aq)+OH-(aq) ΔH3 ④2H2O(l)===2H2(g)+O2(g) ΔH4 下列说法正确的是( ) A.Ce4+能够增大水分解反应的活化能,提高反应速率 B.Ce3+是反应②和反应③的催化剂 C.上述反应中,ΔH4=2ΔH1+4ΔH2-4ΔH3 D.通常条件下,反应④中生成H2、O2的速率之比为1∶2 17.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示: 已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是( ) A.550 ℃时,若充入惰性气体,v(正)、v(逆)均减小,平衡不移动 B.650 ℃时,反应达平衡后CO2的转化率为25.0% C.T ℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 D.925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总 第 Ⅱ 卷 非选择题(共49分) 二、本题包括三道小题,共49分。 18.(14分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同[已知:2NO2(g)N2O4(g) ΔH<0]。 (1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)________v(B)(填“>”“<”或“=”);若打开活塞K2,气球B将________(填“变大”“变小”或“不变”)。 (2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将________(填“增大”“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,(填“变大”“变小”或“不变”)B中NO2的转化率将________。(同上回答) (3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深。(填“A”或“B”) (4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为________。 19.(14分)已知2A(g)+B(g)2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。 (1)已知:A(g)+X(g)2B(g) ΔH=-133.2 kJ·mol-1; 5A(g)+X(g)4C(g) ΔH=-650.4 kJ·mol-1。则a=________。 (2)不同温度下该反应的平衡常数如表所示。 由此可推知,表中T1________T2(填“>”“=”或“<”)。 T/K T1 T2 T3 K 1.00×107 2.45×105 1.88×103 若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度_________ω mol·L-1(填“>”“=”或“<”),a、b、c之间的关系为________。 (3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是________(填序号)。 A.4 mol A和2 mol B B.4 mol A、2 mol B和2 mol C C.4 mol A和4 mol B D.6 mol A和4 mol B (4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d________b(填“>”“=”或“<”)。 (5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,充分反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量________(填“增大”“减小”或“不变”) 20.(21分)中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下: 2CH4(g) C2H4(g) +2H2(g) ΔH>0 化学键 H—H C—H C = C C—C E(kJ / mol) a b c d (1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=___________ (用含a.b.c.d的代数式表示)。 (2)T1温度时,向1 L的恒容反应器中充入2 molCH4 ,仅发生上述反应,反应过程中 0~15 min CH4的物质的量随时间变化如图1所示,测得10-15 min时H2的浓度为1.6 mol/L。 ①0~ 10 min内CH4表示的反应速率为____mol/(L・min) o ②若图中曲线a、曲线b分别表示在温度T1 时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填"a"或 “b”)。 ③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是_____(任答一条即可)。 (3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4).c2(H2) 其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正 ____V逆(填“>”“=”或“<”),判断的理由是__________ (4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2- ①C极的Pt为_______ 极(选填“阳”或“阴” )。 ②该电池工作时负极反应方程式为_____________________ 。 ③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则阴极区所得溶液c(OH—)=_______ (假设电解前后溶液的体积均为500 mL)。 高二化学试题参考答案 一、选择题答案(1—17题,每题3分) D D B A B A B A D B C B D B C C B 二、非选择题答案 18.(14分,每空2分) (1)< 变小 (2)增大 不变 变小 (3)A (4)0.02 mol 19.(14分,每空2分) (1)258.6 (2)< = a=b+c (3)D (4)> (5)不变 20.(21分,除特别标明外每空2分) (1)+ (4b-c-2a) kJ•moL-1 (3分,单位1分) (2)0.16 b 升高温度 或减小压强 或减小某一生成物浓度 (3)12.8 > 该反应ΔH>0,温度升高,平衡向正反应方向移动,即V正 > V逆,也就是k正增大的倍数大于k逆 (4)阳 CH4-8e-+4O2-=CO2+2H2O 0.01mol·L-1 查看更多