- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届湖北省荆州市公安县车胤中学高二上学期期中考试(2017
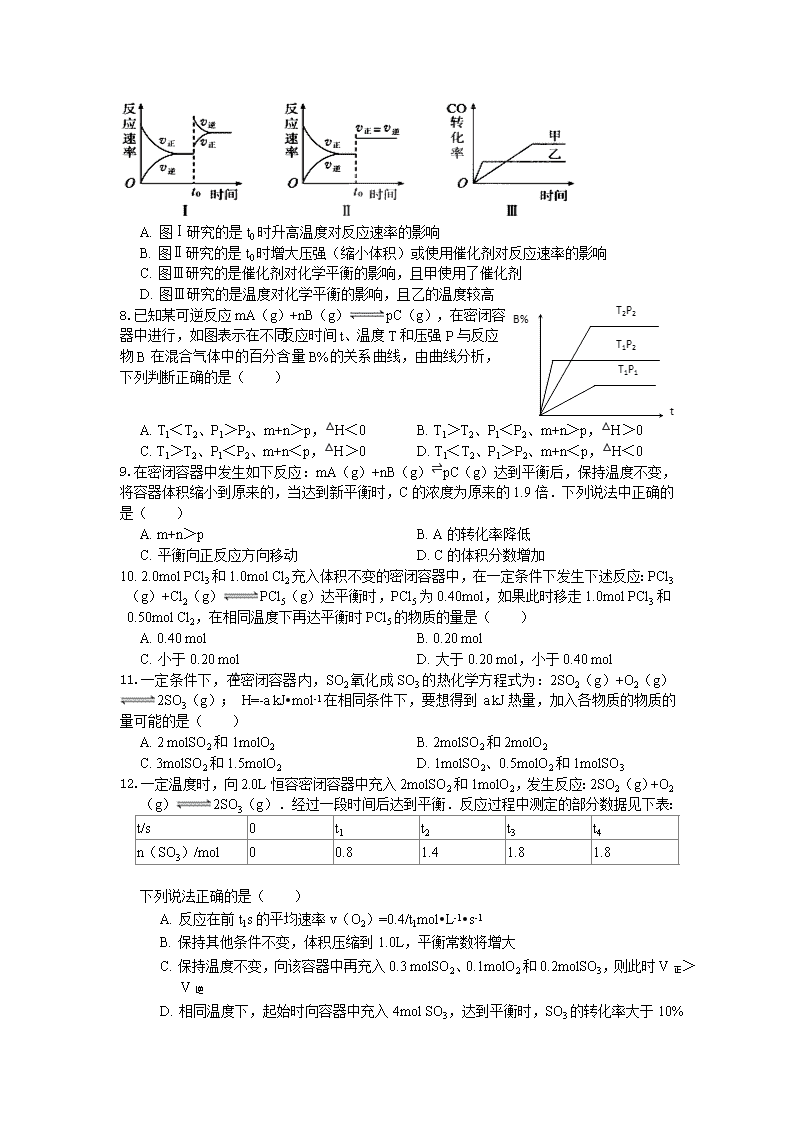
车胤中学2017-2018学年度上学期高二期中考试 化学试卷 考试时间:90分钟;分值:100分;命题人:罗承恺;审卷人:严永兵 相关相对原子质量:H-1 C-12 N-14 O-16 第I卷(单选题) 一、选择题(本大题共16小题,共48.0分) 1.对于某一可逆反应,改变下列条件,一定能使化学平衡发生移动的是( ) A. 增加某反应物的质量 B. 使用催化剂 C. 降低反应体系的压强 D. 升高温度 2.某反应:A⇌B+C 在低温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是( ) A. △H<0、△S<0 B. △H>0、△S<0 C. △H<0、△S>0 D. △H>0、△S>0 3.汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=-373.4kJ/mol-1,若反应在恒容的密闭容器中达到平衡状态,下列有关说法正确的是( ) A. 其它条件不变,加入催化剂,△H变大 B. 及时除去二氧化碳,能使NO完全转化 C. 充入氦气使体系压强增大,可提高反应物的转化率 D. 若升高温度,该反应的平衡常数增大 4.在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应A(s)+2B(g)⇌C(g)+D(g)已达到平衡的是( ) A. 混合气体的压强 B. 混合气体的密度 C. 气体的平均摩尔质量 D. 反应物A的质量 5.向三个体积相等的密闭容器中分别通入一定量的PCl5、HI、NO2,发生如下反应:①PCl5(g)PCl3(g)+Cl2(g),②2HI (g)H2(g)+I2(g),③2NO2(g)N2O4(g),在一定条件下达到平衡后,三者的转化率均为a%,在恒温恒容的条件下向三个容器中分别再加入PCl5、HI、NO2各1mol,再次达到平衡后,转化率( ) A. 均不变 B. ①增大,②不变,③减小 C. 均增大 D. ①减小,②不变,③增大 6.对于反应N2O4⇌2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).下列说法正确的是( ) A. A、C两点的正反应速率的关系A>C B. A、B、C、D、E各状态,V正>V逆的是状态D C. 使E状态从水平方向到达C状态,从理论上来讲,可选用的条件是从P1突然加压至P2 D. 维持P1不变,E→A所需时间为x,维持P2不变,D→C所需时间为y,则x<y 7.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,下列对图象的分析中不正确的是( ) A. 图Ⅰ研究的是t0时升高温度对反应速率的影响 B. 图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 8.已知某可逆反应mA(g)+nB(g)pC(g),在密闭容器中进行,如图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( ) A. T1<T2、P1>P2、m+n>p,△H<0 B. T1>T2、P1<P2、m+n>p,△H>0 C. T1>T2、P1<P2、m+n<p,△H>0 D. T1<T2、P1>P2、m+n<p,△H<0 9.在密闭容器中发生如下反应:mA(g)+nB(g)⇌pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的,当达到新平衡时,C的浓度为原来的1.9倍.下列说法中正确的是( ) A. m+n>p B. A的转化率降低 C. 平衡向正反应方向移动 D. C的体积分数增加 10. 2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( ) A. 0.40 mol B. 0.20 mol C. 小于0.20 mol D. 大于0.20 mol,小于0.40 mol 11.一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g)2SO3(g);△H=-a kJ•mol-1在相同条件下,要想得到 a kJ热量,加入各物质的物质的量可能的是( ) A. 2 molSO2和1molO2 B. 2molSO2和2molO2 C. 3molSO2和1.5molO2 D. 1molSO2、0.5molO2和1molSO3 12.一定温度时,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应:2SO2(g)+O2(g)2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表: t/s 0 t1 t2 t3 t4 n(SO3)/mol 0 0.8 1.4 1.8 1.8 下列说法正确的是( ) A. 反应在前t1s的平均速率v(O2)=0.4/t1mol•L-1•s-1 B. 保持其他条件不变,体积压缩到1.0L,平衡常数将增大 C. 保持温度不变,向该容器中再充入0.3 molSO2、0.1molO2和0.2molSO3,则此时V正>V逆 D. 相同温度下,起始时向容器中充入4mol SO3,达到平衡时,SO3的转化率大于10% 13.在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)2NH3(g)ΔH =-92.4 kJ/mol]:下列说法正确的是 容器 甲 乙 丙 反应物投入量 1 mol N2、3 mol H2 2 mol NH3 4 mol NH3 NH3的浓度(mol/L) c1 c2 c3 反应的能量变化 放出a kJ 吸收b kJ 吸收c kJ 体系压强(Pa) p1 p2 p3 反应物转化率 α1 α2 α3 A. 2c1>c3 B. a+b>92.4 C. 2p2﹤p3 D. α1+α3<1 14.CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+对于该平衡,下列叙述正确的是( ) A. 加入水时,平衡向逆反应方向移动 B. 加入少量NaOH固体,平衡向正反应方向移动 C. 加入少量0.10 mol•L-1HCl溶液,溶液中c(H+)减小 D. 加入少量CH3COONa固体,平衡向正反应方向移动 15.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加 入水的体积V变化的曲线如图所示,下列叙述正确的是( ) A. a、b、c三点处,溶液c(H+)由小到大的顺序为a、b、c B. a、b、c三点处,电离程度最大的是b C. a、b、c三点处,c(CH3COO-)最大的是c D. 若使c点溶液中c(CH3COO-)增大,可采取的措施有加入NaOH固体或加热 16.下表是几种弱酸常温下的电离平衡常数: CH3COOH H2CO3 H2S H3PO4 1.8×10-5 K1=4.3×10-7 K2=5.6×10-11 K1=9.1×10-8 K2=1.1×10-12 K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 则下列说法中不正确的是( ) A. 碳酸的酸性强于氢硫酸 B. 多元弱酸的酸性主要由第一步电离决定 C. 常温下,加水稀释醋酸,增大 D. 向弱酸溶液中加少量NaOH溶液,电离常数不变 第Ⅱ卷(非选择题) 二、简答题(本大题共5小题,共52.0分) 17.(10分)氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol. (1)(3分)写出合成氨的热反应方程式 _____ 生成1molNH3需要吸收或放出 ______ kJ (2)(2分)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中t1时引起平衡移动的条件可能是 ______ .其中表示平衡混合物中NH3的含量最高的一段时间是 ______ . (3)(3分)温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为 ______ . (4) (2分)已知373K时,可逆反应平衡常数为K=0.12,若某时刻时,测得 C(N2)=1mol/L, C(H2)=3mol/L,C(NH3)=2mol/L.此刻可逆反应 ( ) A.向正方向进行 B.向逆方向进行 C处于平衡状态. 18.(12分)已知常见的弱酸在25℃时的电离平衡常数为: 酸 Ka1 Ka2 H2C2O4 5.9×10-2 6.4×10-5 H2CO3 4.2×10-7 5.6×10-11 H2SO3 1.3×10-2 5.6×10-8 HClO 4.7×10-10 CH3COOH 1.6×10-5 (1)(2分)相等物质的量浓度的①CH3COOH、②HClO、③H2C2O4三种溶液,pH由大小的顺序为: _____ _ . (填序号) (2) (2分)饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一,在饱和氯水中加入以下物质中的 ______ (填序号)也可以获得较浓的HClO溶液. A.Na2CO3 B.NaHCO3 C.Na2SO3 D.NaOH (3) (2分)向NaClO溶液中通入少量CO2发生反应的离子方程式为: _____ _ . (4) (3分)若某醋酸溶液中醋酸的起始浓度为0.010mol/L,平衡时C(H+)= ______ mol/L. (提示:醋酸的电离程度很小,平衡时c(CH3COOH)可近似认为等于起始浓度) (5)(3分)书写H2SO3在水溶液中的电离方程式 19. (16分)已知反应CO(g)+H2O(g)CO2(g)+H2(g)进行过程中的能量变化如图1所示.回答下列问题: (1)(1分)该反应的△H= _____ _ . (2)(2分)在恒温恒压的条件下,向密闭容器中投入1molCO(g)、1molH2O(g),达到平衡时放出热量为a kJ;若条件不变,开始投入2molCO(g)、2molH2O(g),则达到平衡时放出热量为b kJ.下列关系正确的是 ______ . A.a>41,b=2a B.a=41,b>2a C.a<41,b=2a D.a<41,b<2a (3)为探究外界条件对化学反应速度和化学平衡的影响,某同学在某固定容积的容器中进行了以下几组实验,记录如下表: 组别 温度(℃) 起始浓度(mol/L) 反应达平衡时所需时间(min) 平衡浓度(mol/L) c(CO2)或c(H2) c(CO) c(H2O) Ⅰ 800 1.00 1.00 10 0.50 Ⅱ 800 1.00 4.00 t2 c2 Ⅲ 800 1.00 1.00 1 0.50 Ⅳ 1000 1.00 1.00 8 0.40 Ⅴ 1000 2.00 2.00 t5 c5 ①(1分)第Ⅰ组实验中,反应进行到10min时,用CO的浓度变化表示的反应速率v(CO)= _____ _ ; ②(3分)第Ⅱ组实验中,平衡时CO2的物质的量浓度c2= _____ _ ; ③(1分)第Ⅲ组实验与实验Ⅰ相比,还隐含的条件是 _____ _ ; ④(2分)根据图2第Ⅰ组实验c(CO2)随时间(t)的变化曲线,在答题卡上画出第Ⅴ组实验中c(CO2)随时间(t)的变化曲线.(图中要明确标出c5的数值) ⑤(3分)800℃时,向容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是 ___ ___ . (4)(3分)碳与氧气不完全燃烧可以生成CO.已知3.6g碳与6.4g氧气完全反应,放出61.45kJ的热量,且碳的燃烧热为△H=-393.5kJ/mol,则碳与氧气反应生成CO的热化学方程式为 ______ . 20.(4分)通过实验发现:分别向0.1mol/L CH3COOH(醋酸)溶液和饱和H3BO3(硼酸)溶液中滴加等浓度Na2CO3溶液,前者有气泡产生,后者无明显现象。 (1)完成醋酸与碳酸钠溶液反应的离子方程式 。 (2)查阅资料:25℃ 时 H2CO3 的电离常数 K1=4.4 x 10-7 K2= 4.7 x 10-11 H3BO3 的电离常数K =5.8 x 10-10 。 【科学探究】饱和硼酸溶液与碳酸钠溶液 (能、否)反应; 若能, CO32-生成 (填入字母序号) A. HCO3- B. CO2 ; 若不能,请说明原因 。 21. (a)(4分)已知: 2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑。在4mL 0.01mol/L KmnO4溶液中滴加2mL0.1mol/L H2C2O4溶液的实验中,开始一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色.针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是 ______ 的影响.若用实验证明你的猜想, 除酸性高锰酸钾溶液、草酸溶液外,可以选择在反应开始前是否加入 ______ (填字母序号)做对比实验. A.K2SO4 B.MnSO4 C.MnCl2 D.H2O. (b)(6分)某化学小组设计实验验证温度对化学反应速率的影响. 【实验用品】0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4、烧杯、冷水、热水、秒表等 【实验步骤】 Ⅰ.取两支试管各加入5mL 0.1mol/LNa2S2O3. Ⅱ.另取两支试管各加入5mL 0.1mol/LH2SO4. Ⅲ.… Ⅳ.一段时间后,分别混合并搅拌. Ⅴ.记录实验现象及数据. (1)(2分)步骤Ⅲ的操作为 _____ . (2)(1分)该实验需要记录的实验数据是 _____ _ . (3)(2分)Na2S2O3和H2SO4反应的化学方程式为 _____ _ . (4)(1分)能说明温度升高反应速率增大的现象是 _____ _ . sc车胤中学2017-2018学年上学期高二期中考试化学试卷 【答案】 1. D 2. D 3. B 4. A 5. D 6. C 7. C 8. C 9. B 10. C 11. C 12. C 13. D 14. B 15. D 16. C 17. (1)(2分)N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol;(1分)46;(2)(1分)加压;(1分)t2-t3;(3)(3分);(4)(2分)B 18. (1)(2分)②>①>③;(2)(2分)B;(3)(2分)ClO-+CO2+H2O =HClO+HCO3-;(4)(3分)4.00×10-4;(5)(3分)H2SO3≒H+ +HSO3- 、 HSO3- ≒ H+ + SO32- 19.(1)(1分) -41KJ/mol;(2)(2分)C;(3)①(1分)0.05mol/(L•min);②(3分)0.8mol/L;③(1分)使用催化剂;④(2分) 图(省略)⑤(3分) 0≤x<3.0; (4)(3分)2C(s)+O2(g)=2CO(g)△H=-221KJ/mol 20.(1)(2分)2CH3COOH + CO32- =2CH3COO- + H2O +CO2↑ (2)(1分)能 ;(1分)A 21 (a)(2分) Mn2+的催化作用;(2分)B (b)(1)(2分)将四支试管分成两组(各有一支盛Na2S2O3和H2SO4的试管),一组放入冷水中,另一组放入热水中; (2)(1分)出现浑浊的时间; (3)(2分)Na2S2O3+H2SO4═S↓+Na2SO4+H2O+SO2↑; (4)(1分)放入热水中的一组先出现浑浊查看更多