- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
甘肃省天水一中2021届高三化学上学期第一学段考试试题(Word版附答案)
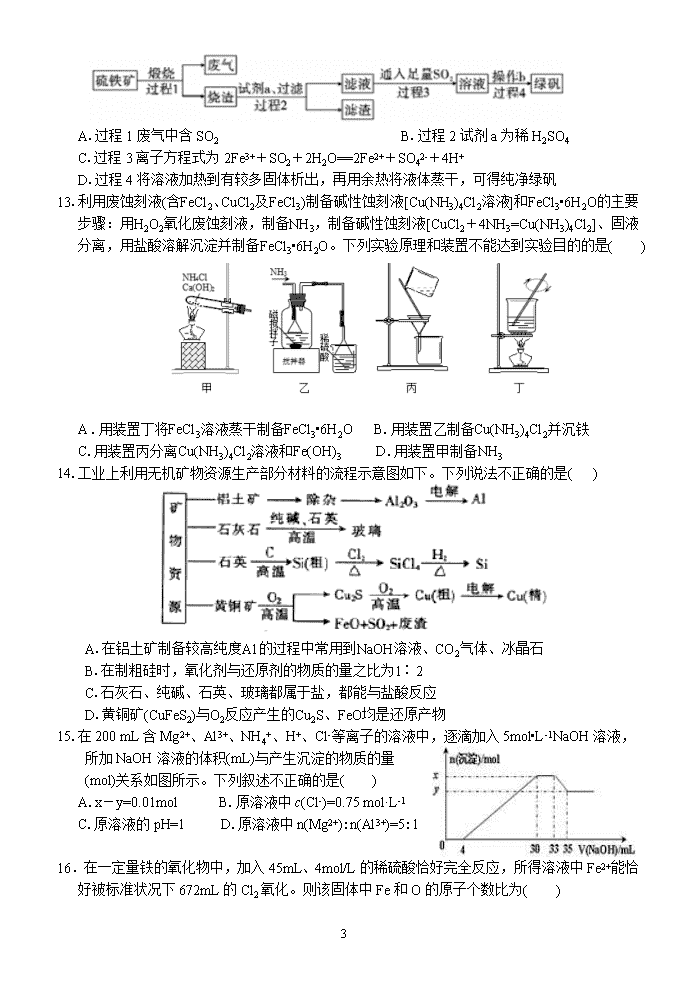
天水市一中2018级2020~2021学年度第一次考试 化 学 试 题 (满分:100分 时间:90分钟) 可能用到的相对原子质量:H-1、C-12、N-14、O-16、Na-23、Mg-24、Al-27、Fe-56、Cu-64、Zn-65、S-16、Cl-35.5、Ag-108、Br-80、I-127、Ba-137、Ca-40、K-39 第I卷 选择题(共48分) 注意:1~6,每小题2分;7~18,每小题3分。共48分,每小题只有一个正确答案 1.“白墙黑瓦青石板,烟雨小巷油纸伞”,是著名诗人戴望舒《雨巷》中描述的景象,下列有关说法中错误的是( ) A.“白墙”的白色源于墙体表层的CaO B.“黑瓦”与陶瓷的主要成分都是硅酸盐 C.做伞骨架的竹纤维的主要成分可表示为(C6H10O5)n D.刷在伞面上的熟桐油是天然植物油,具有防水作用 2.下列说法中,正确的是( ) A.Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物 B.SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐和水 C.FeO、Fe2O3均为碱性氧化物,与氢碘酸反应均只发生复分解反应 D.工业上电解熔融MgCl2制取金属镁;也可用电解熔融AlCl3的方法制取金属铝 3.设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,5.6 LCO2与足量Na2O2反应转移的电子数为0.5NA B.16.25gFeCl3溶于水形成的Fe(OH)3胶体粒子数为0.1NA C.标准状况下,11g3H216O中含有的中子数目为5NA D.4.6g金属钠与一定量的O2充分反应转移电子数为0.2NA 4.下列关于物质或离子检验的叙述正确的是( ) A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 C.灼烧某白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 5.下列各组离子在溶液中一定能大量共存的是( ) A. Fe3+、Mg2+、SCN-、Cl- B.OH-、Na+、SO42-、HCO3- C.AlO2-、Na+、HCO3-、K+ D. Fe2+、NH4+、Cl-、SO42- 6.下列解释实验现象的反应方程式不正确的是( ) A.切开的金属 Na 暴露在空气中,光亮表面逐渐变暗:4Na+O2==2Na2O B.向AgCl 悬浊液中滴加Na2S溶液,白色沉淀变为黑色:2AgCl(s)+S2–(aq)Ag2S(s)+2Cl–(aq) C.向Ba(NO3)2溶液中通入SO2气体,出现白色沉淀:SO2+H2O+Ba2+==BaSO3↓+2H+ D.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性:2H++SO42-+Ba2++2OH–=BaSO4↓+2H2O 7.已知PbO2在盐酸溶液中易被还原成PbCl2,且PbO2、Cl2、FeCl3、 I2 7 的氧化性依次减弱。下列叙述中,正确的是( ) A.Cl2通入FeI2溶液中,可存在反应3Cl2+6FeI2==2FeCl3+4FeI3 B.FeCl3 溶液能将KI溶液中的I-氧化 C.I2具有较强的氧化性,可以将PbCl2氧化成PbO2 D.1mol PbO2在盐酸溶液中被氧化生成PbCl2时转移2 mole- 8.在一定条件下进行的下列化学反应,已知A、B、C中均含有同种元素,则下列对应物质不正 选项 A物质 B物质 C物质 D物质 A NaOH溶液 Na2CO3溶液 NaHCO3溶液 CO2 B Fe FeCl2 FeCl3 Cl2 C AlCl3溶液 Al(OH)3 NaAlO2溶液 NaOH溶液 D H2S S SO2 O2 确的是( ) 9.固体粉末X中可能含有Fe、FeO、CuO、MnO2、KCl和K2CO3中的若干种。为确定该固体粉末的成分,某同学依次进行了以下实验: ①将X加入足量水中,得到不溶物Y和溶液Z; ②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物; ③用玻璃棒蘸取溶液Z滴于广泛pH试纸上,试纸呈蓝色; ④向Z溶液中滴加AgNO3溶液,生成白色沉淀。分析以上实验现象,下列结论正确的是( ) A.不溶物Y中一定含有MnO2和CuO,而Fe与FeO中至少含有一种 B.X中一定不存在FeO C.Z溶液中一定含有K2CO3 D.向④中生成的白色沉淀中加盐酸,若沉淀不完全溶解,则粉末X中含有KCl 10.下列物质的转化在给定条件下能实现的是( ) A.Fe─→Fe2O3─→Fe2(SO4)3 B.S─→SO3─→H2SO4 C.饱和NaCl(aq)─→NaHCO3─→Na2CO3 D.MgCl2(aq)─→MgCl2·6H2O─→Mg 11.高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:下列叙述错误的是( ) A. 用K2FeO4作水处理剂时,既能杀菌消毒又能净化水 B. 反应I中尾气可用FeCl2溶液吸收再利用 C.反应II中氧化剂与还原剂的物质的量之比为3:2 D.该条件下,物质的溶解性:Na2 FeO4< K2FeO4 12.由硫铁矿(主要成分:FeS2 和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:下列说法不正确的是( ) 7 A.过程1废气中含SO2 B.过程2试剂a 为稀H2SO4 C.过程3离子方程式为2Fe3++SO2+2H2O==2Fe2++SO42-+4H+ D.过程4将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾 13.利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3•6H2O的主要步骤:用H2O2氧化废蚀刻液,制备NH3,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl3•6H2O。下列实验原理和装置不能达到实验目的的是( ) A .用装置丁将FeCl3溶液蒸干制备FeCl3•6H2O B.用装置乙制备Cu(NH3)4Cl2并沉铁 C.用装置丙分离Cu(NH3)4Cl2溶液和Fe(OH)3 D.用装置甲制备NH3 14.工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法不正确的是( ) A.在铝土矿制备较高纯度A1的过程中常用到NaOH溶液、CO2气体、冰晶石 B.在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2 C.石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应 D.黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物 15.在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量 (mol)关系如图所示。下列叙述不正确的是( ) A.x-y=0.01mol B.原溶液中c(Cl-)=0.75 mol·L-1 C.原溶液的pH=1 D.原溶液中n(Mg2+):n(Al3+)=5:1 16.在一定量铁的氧化物中,加入45mL、4mol/L的稀硫酸恰好完全反应,所得溶液中Fe2+能恰好被标准状况下672mL的Cl2氧化。则该固体中Fe和O的原子个数比为( ) 7 A.5:6 B.7:9 C.3:4 D.2:3 17.已知NaHSO3溶液显酸性,还原性:HSO3->I-,氧化性:IO3->I2。在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图。下列说法正确的是( ) A.反应过程中的氧化产物均为Na2SO4 B.a点时消耗NaHSO3的物质的量为1.0 mol C.O~b间的反应可用如下离子方程式表示: 3HSO3-+IO3-+3OH-==3SO42-+I-+3H2O D.当溶液中I-与I2的物质的量之比为5∶3时,加入的NaIO3为1.1 mol 18.将某一钠铝合金置于水中,合金全部溶解,得到体积为 20mL、其中c(NaOH)=1mol/L的溶液,然后用1mol/L 的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示。 则下列判断正确的是( ) A.图中m值为1.56g B.标准状况下产生H2896 mL C.图中V2为60 mL D.原合金质量为0.92g 第II卷 非选择题(共52分) 19(14分).氧化剂和还原剂在生产生活中广泛使用。 (1)KMnO4和HBr溶液可以发生如下反应:2KMnO4+16HBr==2KBr+2MnBr2+8H2O+5Br2 ①其中还原剂和氧化剂的物质的量之比为_________ ②若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量为_________,转移电子数目_______。 (2)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为______________,但Fe2+在酸性条件下很容易被空气中的O2氧化,写出该反应的离子方程式_________________ (3)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,可与足量的NaOH完全中和生成NaH2PO2,NaH2PO2溶液可使酚酞试液变红,回答下列问题: ①H3PO2中,磷元素的化合价为______ ②写出H3PO2电离方程式__________________________ ③H3PO2及NaH2PO2均可将溶液中的Ag+还原为金属银,从而用于化学镀银。利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,写出该反应的离子方程式 20(8分).Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2 与H2能发生反应。为了验证此推测结果,该同学设计并进行如下实验。 K1 A 7 I.实验探究 步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。 步骤2:打开K1、K2,在产生的H2流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。 步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水CuSO4未变蓝。 (1)组装好仪器后,要检查装置的气密性。简述检查A装置气密性的方法:______________________ (2)B装置中所盛放的试剂是______________,其作用是___________________________________ (3)步骤3中的必要操作为打开K1、K2,_______(请按正确的顺序填入下列步骤的字母) A.加热至Na2O2逐渐熔化,反应一段时间 B.用小试管收集气体并检验其纯度 C.关闭K1 D.停止加热,充分冷却 (4)由上述实验可推出Na2O2与H2反应的化学方程式为____________________________________ II.数据处理 (5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。其操作流程如下: 一定量样品 稀HCl 操作1 溶液转移 操作2 冷却 称量 ①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和_________ ②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_________(填“偏大”“偏小”或“不变”) 21(15分).某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如图: 已知:①Cu2O+2H+==Cu+Cu2++H2O ②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示: 沉淀物 Cu(OH)2 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀pH 5.4 4.0 2.7 5.8 沉淀完全pH 6.7 5.2 3.7 8.8 (1)为了加快反应Ⅰ的速率,可以采取的措施是__________________________________ (任写1条) (2)固体混合物A中的成分是______________ (3)反应Ⅰ完成后,铁元素的存在形式为______ (填离子符号);写出生成该离子的离子方程式_______ (4)操作1主要包括:____________、____________、____________,洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是________________________________________________ (5)用NaClO调pH可以生成沉淀B,利用题中所给信息分析沉淀B的化学式为_________________,该反应中氧化剂与还原剂的物质的量之比为________ (6)用NaOH调pH可以生成沉淀C,利用题中所给信息分析y的范围为_______________________ 22(15分).氮化铝(AlN) 7 是一种性能优异的新型材料,在许多领域有广泛应用。某化学小组模拟工业制氮化铝原理,欲在实验室制备氮化铝并检验其纯度。查阅资料: ①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4ClNaCl+N2↑+2H2O ②工业制氮化铝:Al2O3+3C+N22AlN+3CO,氮化铝在高温下能水解。 ③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O==NaAlO2+NH3↑ Ⅰ.氮化铝的制备 (1)实验中使用的装置如上图所示,请按照氮气气流方向将各仪器接口连接 e→c→d__________ (上述装置可重复使用) (2)A装置内的X液体可能是____________;E装置内氯化钯溶液的作用可能是_______________ Ⅱ.氮化铝纯度的测定 (方案i)甲同学用右图装置测定AlN的纯度(部分夹持装置已略去)。 (3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是________. a.CCl4 b.H2O c.NH4Cl饱和溶液 d.植物油 (4)用下列仪器也能组装一套量气装置,其中必选的仪器有_________ a.单孔塞 b.双孔塞 c.广口瓶 d.容量瓶 e.量筒 f.烧杯 (方案ii)乙同学按以下步骤测定样品中AlN的纯度(流程如下图) 样品(m1g) 含C、Al2O3 等杂质 过量NaOH溶液 ①过滤、洗涤 滤液及 洗涤液 滤渣(m2g) ② 过滤、洗涤 ③ 滤液 滤渣 煅烧 ④ m3g (5)步骤②的操作是_____________ (6)实验室里灼烧滤渣使其分解,除了必要的热源和三脚架以外,还需要的硅酸盐仪器有__、 等 (7)样品中AlN的纯度是________________ (用含m1、m2、m3表示)。 (8)若在步骤③中未洗涤,测定结果将_____(填“偏高”、“偏低”或“无影响”) 7 天水市一中2018级2020~2021学年度第一次考试 化学试题答案 一、 选择题 1-5 :ABDBD 6-10: CBBCC 11-15: DDACB 16-18: BDA 19. (1)5:1 0.5mol 0.5NA (2)2H++Fe=Fe2++H2↑ 4Fe2++O2+4H+=4Fe3++2H2O +1 D 正盐 H3PO2H++H2PO2— (3)H3PO2+4Ag++2H2O=4Ag↓+H3PO4+4H+ 20. (1)关闭K1,向A装置中的漏斗加水至漏斗内液面高于漏斗外液面,并形成一段液柱,一段时间后水柱稳定不降,说明A装置气密性良好。 (2)碱石灰 吸收氢气中的水和氯化氢 (3)BADC (4)Na2O2+H22NaOH (5)玻璃棒 偏小 21.(1)适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等 (2)SiO2、Cu (3)Fe2+ Cu+2Fe3+=2Fe2++Cu2+ (4)蒸发浓缩、冷却结晶、过滤 冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失 (5)Fe(OH)3 1:2 (6)5.2≤pH<5.4 22.(1) (2) 浓硫酸 吸收CO防污染 (3)ad (4)bce (5)通入过量气体 (6)坩埚、泥三角 (7) 或 (8)偏高 7 查看更多