- 2021-08-24 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版江苏新高考选考化学(苏教版)一轮复习同步练习:专题8 5 小专题突破8 利用曲线变化判断粒子浓度的关系
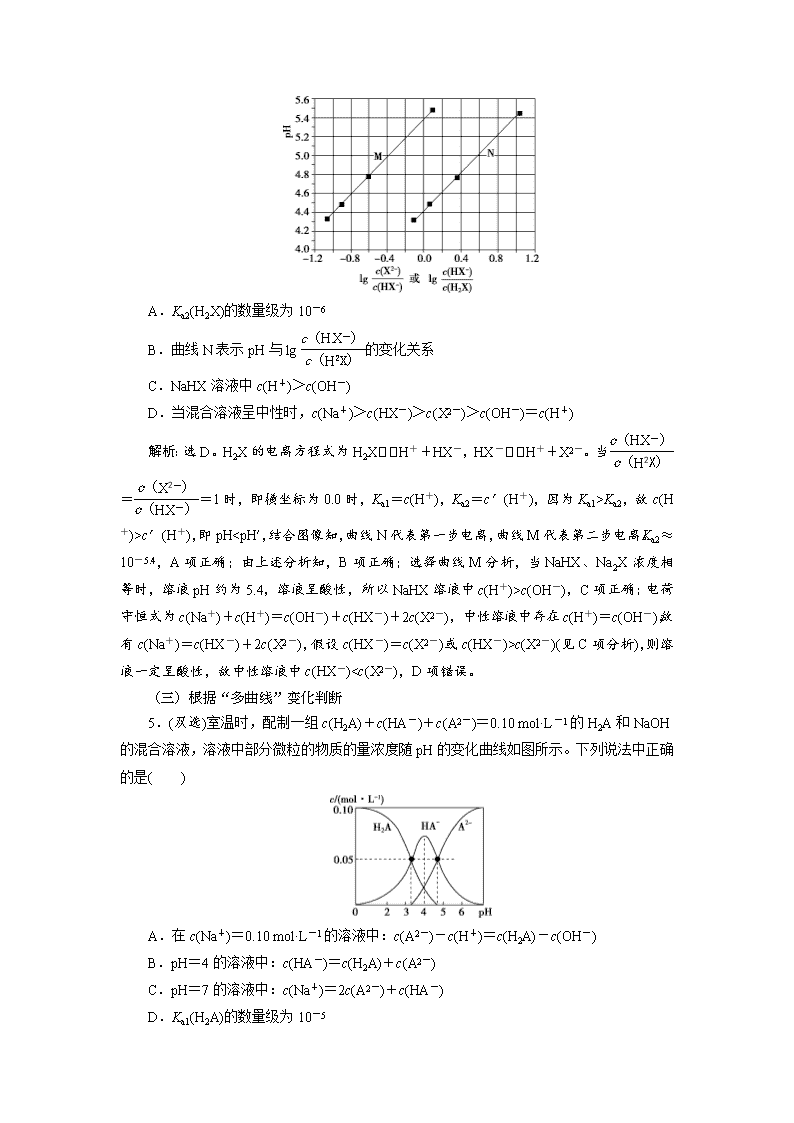
小专题突破8 利用曲线变化判断粒子浓度的关系 (一)根据“单曲线”变化判断 1.已知:pKa=-lg Ka,25 ℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1 H2SO3溶液的滴定曲线如图所示。下列说法不正确的是( ) A.a点所得溶液中:2c(H2SO3)+c(SO)=0.1 mol·L-1 B.b点所得溶液中:c(H2SO3)+c(H+)=c(SO)+c(OH-) C.c点所得溶液中:c(Na+)>3c(HSO) D.d点所得溶液中:c(Na+)>c(SO)> c(HSO) 解析:选A。发生反应:NaOH+H2SO3===NaHSO3+H2O、NaHSO3+NaOH===Na2SO3+H2O。A.a点溶液中的溶质为NaHSO3和H2SO3,根据物料守恒得出,c(H2SO3)+c(HSO)+c(SO)<0.1 mol·L-1,根据电离平衡常数Ka1=c(HSO)·c(H+)/c(H2SO3),此时溶液的pH=1.85,即c(H+)=10-1.85,推出c(HSO)=c(H2SO3),代入上式得出,2c(H2SO3)+c(SO)<0.1 mol·L-1,故说法错误;B.b点加入20 mL NaOH溶液,NaOH和H2SO3恰好完全反应生成NaHSO3,即溶质为NaHSO3,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HSO)+2c(SO),根据物料守恒:c(Na+)=c(H2SO3)+c(HSO)+c(SO),因此有c(H2SO3)+c(H+)=c(SO)+c(OH-),故说法正确;C.c点溶质为Na2SO3和NaHSO3,溶液显碱性,SO+H2OHSO+OH-,根据水解平衡常数Kh=c(OH-)·c(HSO)/c(SO)=Kw/Ka2,c(OH-)=Kw/c(H+),推出c(HSO)=c(SO),根据物料守恒:2c(Na+)=3c(H2SO3)+3c(HSO)+3c(SO),则有c(Na+)=3c(HSO)+1.5c(H2SO3),显然:c(Na+)>3c(HSO),故说法正确;D.d 点溶质为Na2SO3和NaHSO3,且n(Na2SO3)>n(NaHSO3),溶液中离子浓度c(Na+)>c(SO)>c(HSO),故说法正确。 2.(双选)常温下,向20.00 mL 0.100 0 mol·L-1的(NH4)2SO4溶液中逐滴加入0.200 0 mol·L-1的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。下列说法正确的是( ) A.a点所示溶液中:c(NH)>c(SO)>c(H+)>c(OH-) B.b点所示溶液中:c(NH)=c(Na+)>c(H+)=c(OH-) C.c点所示溶液中:c(SO)+c(H+)=c(NH3·H2O)+c(OH-) D.d点以后的溶液中可能出现:c(SO)>c(NH3·H2O)>c(OH-)>c(NH) 答案:AC (二)根据“双曲线”变化判断 3.常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。下列说法正确的是( ) A.点①和点②所示溶液中:c(CH3COO-)<c(CN-) B.点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) D.点②和点③所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) 解析:选C。A项,点①所示溶液中的电荷守恒为c(OH-)+c(CN-)=c(Na+)+c(H+),且c(OH-)>c(H+),故c(CN-)<c(Na+),点②所示溶液中的电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),且c(OH-)<c(H+),故c(CH3COO-)>c(Na+),二者中钠离子浓度相同,所以c(CH3COO-)>c(CN-),错误;B项,点③所示溶液中pH=7,即c(OH-)=c(H+),则点③所示溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),点④所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),错误;C项,点①所示溶液中的物料守恒为c(HCN)+c(CN-)=2c(Na+),点②所示溶液中的物料守恒为c(CH3COOH)+c(CH3COO-)=2c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),故得c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),正确;D项,点②和点③所示溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),c(Na+)≠c(CH3COOH),错误。 4.(2017·高考全国卷Ⅰ)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( ) A.Ka2(H2X)的数量级为10-6 B.曲线N表示pH与lg的变化关系 C.NaHX溶液中c(H+)>c(OH-) D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) 解析:选D。H2X的电离方程式为H2XH++HX-,HX-H++X2-。当==1时,即横坐标为0.0时,Ka1=c(H+),Ka2=c′(H+),因为Ka1>Ka2,故c(H+)>c′(H+),即pH查看更多
相关文章
- 当前文档收益归属上传用户