- 2021-08-24 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年北京101中学高二下学期期中考试化学试题 Word版
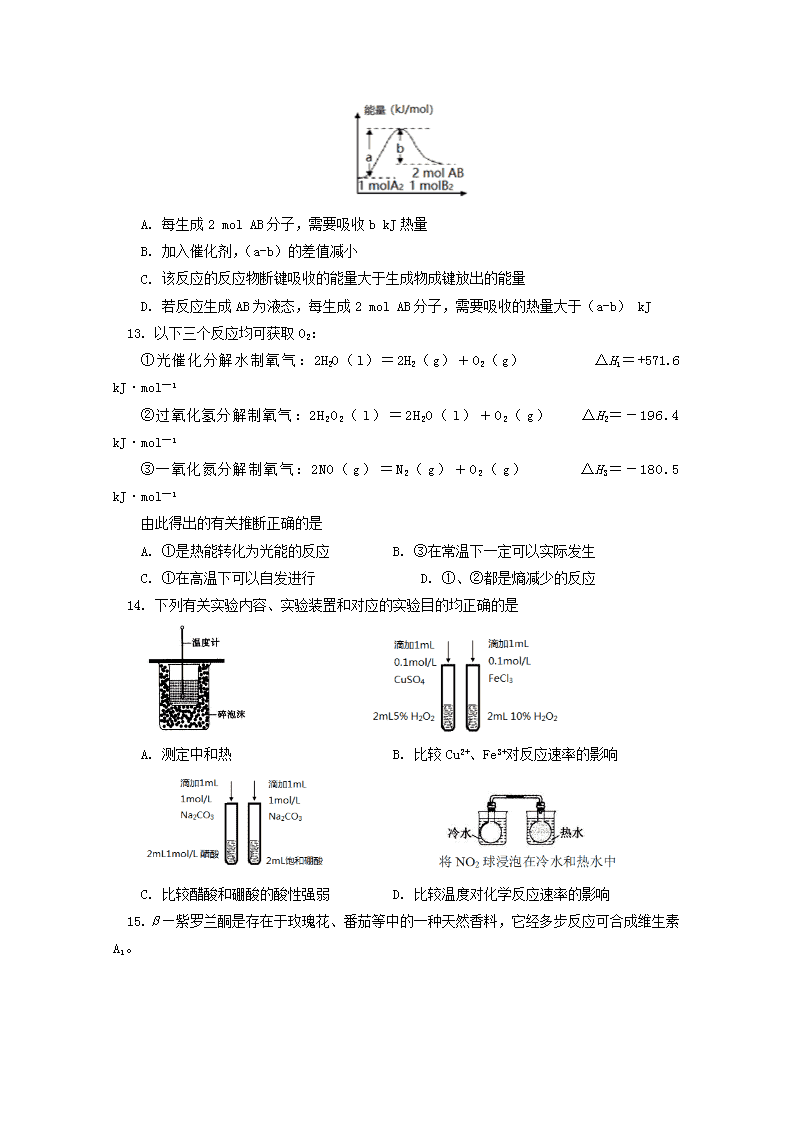
北京101中学2017-2018学年下学期高二年级期中考试化学试卷 友情提示: 本试卷分为Ⅰ卷、Ⅱ卷两部分,共25个小题,满分100分;答题时间为90分钟。 Ⅰ卷 选择题(共42分) 1. 下列能量转化过程与氧化还原反应无关的是 A. 硅太阳能电池 B. 锂离子电池放电 C. 火箭的燃料燃烧 D. 葡萄糖提供能量 2. 反应A(g)+3B(g)2C(g)+2D(g),在不同条件下测得反应速率,其中速率最快的是 A. υ(C)=0.5 mol / (L·s) B. υ(D)=0.4 mol / (L·s) C. υ(B)=0.6 mol / (L·s) D. υ(A)=0.15 mol / (L·s) 3. 下列物质中属于电解质的是 ①酒精 ②硫酸铜 ③水 ④醋酸 ⑤镁 ⑥氨水 A. ①②④⑤ B. ②③④ C. ②③④⑥ D. 全部 4. 在一定温度下的密闭容器中,发生反应:2SO2(g)+O2(g)2SO3(g),达到平衡状态时缩小容器容积,下列叙述不正确的是 A. 该反应的平衡常数不变 B. 平衡向正反应方向移动 C. SO3的浓度增大 D. 正反应速率增大,逆反应速率减小 5. 关于常温下pH=12的稀氨水,下列叙述不正确的是 A. 溶液中c (OH-)=1.0´10-2 mol·L-1 B. 由水电离出的c (OH-)=1.0´10-12 mol·L-1 C. 加水稀释后,氨水的电离程度增大 D. 加入少量NH4Cl固体,溶液pH变大 6. 25℃时,水中存在电离平衡:2H2OH3O++OH-ΔH>0。下列叙述不正确的是 A. 向水中通入HCl,抑制水的电离 B. 向水中加入少量氨水,促进水的电离 C. 向水中加入少量Na2CO3固体,促进水的电离 D. 将水加热,Kw增大 7. 100 mL 2 mol/L的盐酸与过量的锌片反应时,为减慢反应速率,又不影响生成的氢气的总量,可采用的方法是 A. 加入适量的6 mol/L的盐酸 B. 加入适量的醋酸钠固体 C. 加入适量的NaOH固体 D. 加入几滴氯化铜溶液 8. 下列事实与对应的方程式不符合的是 A. 自然界中正常的雨水呈酸性:H2O+CO2H2CO3 ,H2CO3H++HCO3— B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色)N2O4 (g) (无色) ΔH<0 C. 甲烷的燃烧热为-890.3 kJ·mol—1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol—1 D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32—+2H+=S ¯+SO2 +H2O 9. 据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实: 2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g) 下列叙述错误的是 A. 反应需在300 ℃进行可推测该反应是吸热反应 B. 使用催化剂可提高反应速率 C. 充入大量CO2气体可提高H2的转化率 D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率 10. 对反应2A(g)+2B(g)3C(g)+D(?),下列图象的描述正确的是 图① 图② A. 依据图①,若t1时升高温度,则ΔH<0 B. 依据图①,若t1时增大压强,则D是固体或液体 C. 依据图②,P1>P2 D. 依据图②,物质D是固体或液体 11. 下列实验事实不能用平衡移动原理解释的是 A. 90 oC,纯水的pH<7 B. 黄绿色的氯水光照后颜色变浅 C. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 D. 重铬酸钾溶液中滴加氢氧化钠溶液,溶液由橙色变黄色 12. 反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,有关该反应的下列说法正确的是 A. 每生成2 mol AB分子,需要吸收b kJ热量 B. 加入催化剂,(a-b)的差值减小 C. 该反应的反应物断键吸收的能量大于生成物成键放出的能量 D. 若反应生成AB为液态,每生成2 mol AB分子,需要吸收的热量大于(a-b) kJ 13. 以下三个反应均可获取O2: ①光催化分解水制氧气:2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6 kJ·mol—1 ②过氧化氢分解制氧气:2H2O2(l)=2H2O(l)+O2(g) ΔH2=-196.4 kJ·mol—1 ③一氧化氮分解制氧气:2NO(g)=N2(g)+O2(g) ΔH3=-180.5 kJ·mol—1 由此得出的有关推断正确的是 A. ①是热能转化为光能的反应 B. ③在常温下一定可以实际发生 C. ①在高温下可以自发进行 D. ①、②都是熵减少的反应 14. 下列有关实验内容、实验装置和对应的实验目的均正确的是 A. 测定中和热 B. 比较Cu2+、Fe3+对反应速率的影响 C. 比较醋酸和硼酸的酸性强弱 D. 比较温度对化学反应速率的影响 15. β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。 下列说法正确的是 A. β—紫罗兰酮可使酸性KMnO4溶液褪色 B. 1 mol中间体X最多能与2 mol H2发生加成反应 C. 维生素A1易溶于NaOH溶液 D. β—紫罗兰酮与中间体X互为同分异构体 16. 新制氢氧化铜存在平衡:Cu(OH)2+2OH-Cu(OH)42-(深蓝色)。某同学进行下列实验: 下列说法不正确的是 A. ①中出现蓝色沉淀 B. ③中现象是Cu(OH)2+2OH-Cu(OH)42-正向移动的结果 C. ④中现象证明葡萄糖具有还原性 D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42- 17. 温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生反应PCl5(g)PCl3(g)+Cl2(g)。反应过程中c(Cl2)随时间变化的曲线如下图所示,下列说法不正确的是 A. 反应在0 ~50 s 的平均速率υ(Cl2)=1.6×10-3 mol/(L·s) B. 该温度下,反应的平衡常数K=0.025 C. 保持其他条件不变,升高温度,若平衡时c(PCl3)=0.11 mol/L,则该反应的ΔH >0 D. 反应达到平衡后,再向容器中充入1 mol PCl5,该温度下再达到平衡时,c(Cl2)>0.2 mol/L 18. 某温度下,CO(g)+H2O (g)CO2(g)+H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5 min时的浓度如下表所示。 甲 乙 起始浓度 5min时浓度 起始浓度 5min时浓度 c(CO)/mol/L 0.1 0.08 0.2 x c(H2O)/mol/L 0.1 0.08 0.2 y 下列判断不正确的是 A. x=y=0.16 B. 反应开始时,乙中反应速率比甲快 C. 平衡时,乙中的c(CO)是甲中的2倍 D. 平衡时,乙中H2O的转化率是50% 19. 将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应为:SiHCl3(g)+H2(g)Si(s)+3HCl(g)。不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是 A. 该反应是放热反应 B. 横坐标表示的投料比应该是 C. 该反应的平衡常数随温度升高而增大 D. 实际生产中为提高SiHCl3的利用率,可以适当增大压强 20. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4的沸点为 42.2℃,固体杂质不参与反应。 第一阶段:将粗镍与 CO 反应转化成气态 Ni(CO)4; 第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。 下列判断正确的是 A. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ B. 增大c(CO),平衡正向移动,反应的平衡常数增大 C. 第二阶段,Ni(CO)4分解率较低 D. 该反应达到平衡时,υ生成[Ni(CO)4]=4υ生成(CO) 21. 已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下: 物质 CH3OH CH3OCH3 H2O 浓度/(mol·L-1) 0.44 0.6 0.6 下列说法正确的是 A. 加入CH3OH的物质的量a=1.64 B. 此时刻正反应速率大于逆反应速率 C. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率减小 D. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 II卷 非选择题(共58分) 22. (16分)研究弱电解质的电离,有重要的实际意义。 Ⅰ. 醋酸是一种常见的有机酸。 (1)醋酸的电离方程式为 。 (2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是 。 A. c(CH3COO-) B. c(H+) C. c(OH-) D. CH3COOH电离平衡常数 (3)向0.1 mol·L-1 CH3COOH溶液中加水稀释,c(CH3COO-) / c(CH3COOH)的比值将 (填“变大”、“不变”或“变小”)。 (4)下列事实一定能说明CH3COOH是弱电解质的是 (填字母)。 A. 相同温度下,浓度均为1 mol·L-1的盐酸和醋酸的导电性对比:盐酸>醋酸 B. 1 mol·L-1 CH3COOH溶液能使紫色石蕊试液变红 C. 25℃时,1 mol·L-1 CH3COOH溶液的pH约为2 D. 10 mL 1mol·L-1的CH3COOH溶液恰好与10 mL 1mol·L-1 NaOH溶液完全反应 Ⅱ. 对比酸性的相对强弱 (5)现有a. CH3COOH b. HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。 ① 将pH相同的两种酸溶液分别稀释100倍后,pH的大小关系为a b。 ② pH相同、体积相同的两 种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a b。 ③ 将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a b。 ④ 相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a b。 (6)某些弱酸的电离常数如下: 化学式 CH3COOH HSCN HCN HClO H2CO3 电 离 常 数 1.8×10-5 1.3×10-1 4.9×10-10 3.0×10-8 K1=4.4×10-7 K2=4.7×10-11 ①下列反应可以发生的是 (填字母)。 A. CH3COOH+Na2CO3=NaHCO3+CH3COONa B. CH3COOH+NaCN=CH3COONa+HCN C. CO2+H2O+2NaClO=Na2CO3+2HClO D. NaHCO3+HCN=NaCN+H2O+CO2↑ ②25℃时,将20 mL 1 mol·L-1 CH3COOH溶液和20 mL 1 mol·L-1 HSCN溶液分别与20 mL1 mol·L-1 NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式。 23. (12分)NOx、CO、SO2等大气污染气体的处理和利用是世界各国研究的热点问题。 (1)已知: I. II. 2NO(g)+O2(g) 2NO2(g) ΔH1 2SO2(g)+O2(g) 2SO3(g) ΔH2 =-196.6 kJ·mol-1 ① ΔH1 = kJ·mol-1。 ② 写出NO2气体与SO2气体反应生成SO3气体和NO气体的热化学方程式 。 (2)煤炭燃烧过程中释放出大量的SO2,严重破坏生态环境。燃烧过程中加入石灰石可以把硫元素以CaSO4的形式固定,从而降低SO2的排放,该反应的化学方程式是 。 (3)煤炭燃烧过程中产生的CO又会与CaSO4 发生化学反应,降低了脱硫效率。发生的两个相关反应的热化学方程式如下: 反应Ⅰ:CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1 反应Ⅱ:CaSO4(s)+4CO(g)CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1 资料:①反应Ⅰ和反应Ⅱ同时发生 ②反应Ⅰ的速率大于反应Ⅱ的速率 请回答下列问题: ① 下列反应过程能量变化示意图正确的是 。 A B C D ② 图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有 (填字母)。 A. 向该反应体系中投入石灰石 B. 在合适的温度区间内控制较低的反应温度 C. 提高CO的初始体积百分数 D. 提高反应体系的温度 ③ 图2表示恒温恒容条件下反应体系中c(SO2)随时间t变化的总趋势图。请从化学反应原理的角度解释c(SO2)先增加后降低的原因 。 24.(16分)甲醇是重要的化工原料和燃料,CO、CO2在催化剂的作用下都可以合成甲醇。 Ⅰ. 工业上一般在恒容密闭容器中采用下列反应合成甲醇: CO(g)+2H2(g)CH3OH(g) ΔH (1)判断反应达到平衡状态的依据是 (填字母)。 A. CH3OH的浓度不再发生变化 B. 生成CH3OH的速率与消耗CO的速率相等 C. 氢气的体积分数保持不变 D. 混合气体的密度不变 (2)为研究平衡时CO的转化率与反应物投料比及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。 ①反应热△H 0(填“>”或“<”),判断依据是 。 ②若其他条件相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。 a. 投料比:Ⅰ Ⅱ(填“>”、“<”或“=”)。 b. 若Ⅱ反应的n(CO)起始=10 mol、 投料比为0.5,A点的平衡常数KA = ,B点的平衡常数KB KA (填“>”、“<”或“=”)。 ③要提高CO的转化率,可以采取的措施是_______________。(填字母) a. 升温 b. 加入催化剂 c. 增大压强 d. 加入惰性气体 Ⅱ. 用CO2在催化剂的作用下合成甲醇的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g)某密闭容器中充入3 mol氢气和1 mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如下图所示。 (1)下图中Q点的速率υ正 υ逆(填“>”、“<”或“=”)。 (2)解释T0~T1内甲醇的体积分数变化趋势的原因_______________________。 25. (14分)已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。 (1)甲同学首先进行了实验1。 实验 1 实验步骤 实验现象 ⅰ. 取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 ⅰ. 溶液呈棕黄色。 ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 ⅱ. 溶液不显红色。 ① 写出FeCl3溶液与KI溶液反应的离子方程式 。 ② 加入KSCN溶液的目的是 。 ③ 甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,改进实验方案,进行实验2。 实验 2 实验步骤 实验现象 ⅰ. 取2 mL 0.1 mol·L-1 KI溶液, 滴加 0.1 mol·L-1 FeCl3溶液3滴。 ⅰ. 溶液呈棕黄色。 ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 ⅱ. 溶液显红色。 ⅲ. 继续加入2 mL CCl4,充分振荡、静置。 ⅲ. 液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 本实验改用0.1 mol·L-1 KI溶液的目的是 。 用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因 。 (2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I-I3- 。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。 ① 为验证假设,乙同学设计并完成了实验3。 实验3 实验步骤 实验现象 ⅰ. 取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 ⅰ. 液体分层,上层呈黄色,下层呈紫红色。 ⅱ. 取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 ⅱ. 液体分层,上层为无色,下层呈紫红色。 实验3的结论是 。 ② 甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I- I3-的存在。 请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中 。两支试管中的现象分别为 。 参考答案 I卷 选择题(共42分) 1 2 3 4 5 6 7 8 9 10 11 A A B D D B B C A B C 12 13 14 15 16 17 18 19 20 21 C C C A D D A C A B II卷 非选择题(共58分) 22. (16分) (1)CH3COOHCH3COO-+H+ (2)B (3)变大 (4)AC (5)①< ②> ③< ④> (6)①BC ② 23. (12分) (1)①-113 ②NO2(g)+SO2(g)SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1 (2)2CaCO3+2SO2+O2=2CaSO4+2CO2 (3)①A ②A B C ③因为>,反应Ⅰ较快,先生成大量的SO2,所以SO2浓度先增大;随着反应时间的增长,因为反应Ⅱ的限度大(平衡向正向进行的程度大),消耗CO,使反应Ⅰ的CO浓度降低,反应Ⅰ平衡逆向移动,SO2浓度减小 24.(16分) Ⅰ.(1)AC (2)①<;温度升高,CO的转化率降低,平衡逆向移动了,说明正反应是放热反应 ②a.< b. 1,= ③c Ⅱ.(1)> (2)正反应是放热反应,温度升高,平衡逆向移动了,所以T0~T1内甲醇的体积分数降低 25.(14分) (1)① 2Fe3++2I- 2Fe2++I2 ②检验溶液中是否大量存在Fe3+ ③提高平衡时溶液中的c(Fe3+) 加入CCl4后,I2被CCl4萃取,平衡2Fe3++2I—2Fe2++I2正向移动,或c(Fe3+)降低,平衡Fe3++3SCN—Fe(SCN)3逆向移动,或c[Fe(SCN)3]降低,所以红色消失 (2)①萃取后的溶液呈棕黄色的主要原因是存在I3- ②加入1 mL 0.1 mol·L-1 KI溶液,振荡、静置 试管1中液体分层,上层为无色,下层呈紫红色,试管2中液体分层,上层呈黄色,下层呈紫红色(或紫红色变浅)查看更多