- 2021-08-24 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学作业13pH的计算及应用含解析 人教版选修4
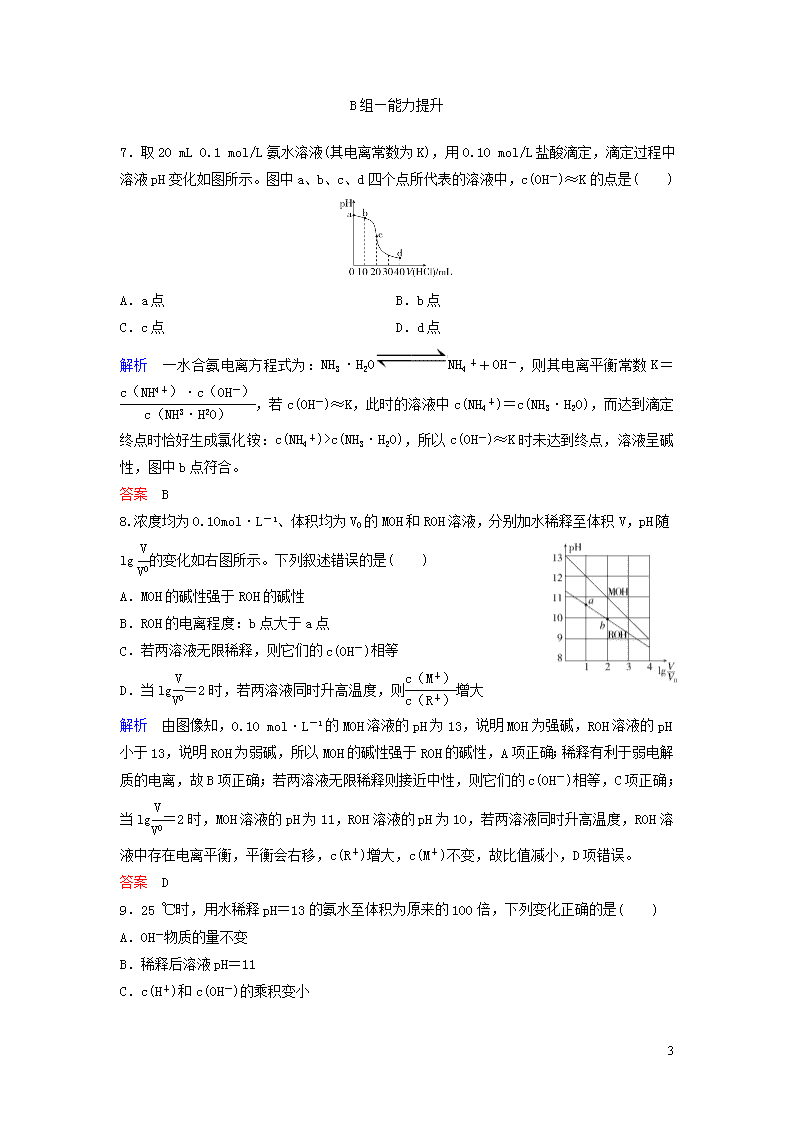
课时作业(十三) A组—基础巩固 一、pH及相关计算 1.900 mL pH=5的盐酸和100 mL pH=1的盐酸混合,该混合溶液的pH约为( ) A.2 B.3 C.4 D.5 答案 A 2.把pOH定义为pOH=-lg c(OH-),则弱碱溶液中c(OH-)可表示为( ) A. mo/L B.10pH mo/L C.10-pH mo/L D.10pH-14 mo/L 解析 因为Kw=c(H+)·c(OH-)=1×10-14,pOH=-lgc(OH-)=-lg=14-pH,故c(OH-)=10pH-14 mo/L。 答案 D 3.同温下,有甲、乙两瓶醋酸稀溶液,测得甲的pH=a,乙的pH=a+1,下列推断正确的是( ) A.物质的量浓度c(甲)是c(乙)的10倍 B.溶液中c(OH-)甲是乙的10倍 C.由水电离产生的c(H+)乙是甲的10倍 D.与等量的NaOH反应消耗甲、乙两酸的体积V(乙)<10V(甲) 解析 如果醋酸的电离程度相等,则物质的量浓度c(甲)=10c(乙),实际上乙的电离程度大于甲,所以c(甲)>10c(乙),故A项错误;相同温度下,水的离子积常数相同,数据pH知,甲中c(OH-)=,乙中c(OH-)=,则甲中氢氧根离子浓度是乙的,故B项错误;甲中c(H+)水=,乙中c(H+)水=,所以c(H+)水乙是甲的10倍,故C项正确;因c(甲)>10c(乙),所以中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲),故D项错误。 答案 C 4.(1)25 ℃时,0.05 mol·L-1 H2SO4溶液的pH=________,0.01 mol·L-1 NaOH溶液的pH=________。 (2)某温度下纯水中的c(H+)=2×10-7 mol·L-1,则此时溶液中的c(OH-)=________;若温度不变,滴入稀盐酸,使c(H+)=5×10-4 mol·L-1,则此时溶液中由水电离产生的c(H 9 +)=________。 解析 (1)0.05 mol·L-1H2SO4溶液中: c(H+)=0.05 mol·L-1×2=0.1 mol·L-1,pH=1。 0.01 mol·L-1NaOH溶液中,c(OH-)=0.01 mol·L-1,c(H+)===10-12 mol·L-1,pH=12。 (2)纯水中,c(H+)=c(OH-)=2×10-7 mol·L-1,此温度下Kw=4×10-14。加入稀盐酸,c(H+)=5×10-4 mol·L-1,则c(OH-)= mol·L-1=8×10-11 mol·L-1,c(H+)水=c(OH-)=8×10-11 mol·L-1。 答案 (1)1 12 (2)2×10-7 mol·L-1 8×10-11 mol·L-1 二、酸碱中和滴定 5.酚酞作指示剂,用NaOH溶液滴定盐酸时,由于滴定速率太快,当混合溶液变红时,不知NaOH是否过量,判断它是否过量的方法是( ) A.加入5 mL盐酸进行滴定 B.返滴一滴待测盐酸 C.重新进行滴定 D.以上方法均不适用 解析 判断是否滴定过量的方法是返滴一滴待测盐酸,看颜色是否复原。 答案 B 6.下面是一段关于酸碱中和滴定实验操作的叙述:①取一锥形瓶,用待测NaOH溶液润洗两次,②在一锥形瓶中加入25.00 mL待测NaOH溶液,③加入几滴石蕊试剂作指示剂,④取一支酸式滴定管,洗涤干净,⑤直接往酸式滴定管中注入标准酸溶液,进行滴定,⑥左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶,⑦两眼注视着滴定管内盐酸液面下降,直至滴定终点。文中所述操作有错误的序号为( ) A.④⑥⑦ B.①⑤⑥⑦ C.③⑤⑦ D.①③⑤⑦ 解析 锥形瓶不用待测液润洗,①错误;石蕊变色不明显,不易观察颜色,在酸碱中和滴定时不用石蕊作指示剂,③错误;滴定管使用前要用标准酸溶液润洗,⑤错误;滴定过程中眼睛应观察锥形瓶中溶液颜色变化,⑦错误。 答案 D 9 B组—能力提升 7.取20 mL 0.1 mol/L氨水溶液(其电离常数为K),用0.10 mol/L盐酸滴定,滴定过程中溶液pH变化如图所示。图中a、b、c、d四个点所代表的溶液中,c(OH-)≈K的点是( ) A.a点 B.b点 C.c点 D.d点 解析 一水合氨电离方程式为:NH3·H2ONH4++OH-,则其电离平衡常数K=,若c(OH-)≈K,此时的溶液中c(NH4+)=c(NH3·H2O),而达到滴定终点时恰好生成氯化铵:c(NH4+)>c(NH3·H2O),所以c(OH-)≈K时未达到终点,溶液呈碱性,图中b点符合。 答案 B 8.浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如右图所示。下列叙述错误的是( ) A.MOH的碱性强于ROH的碱性 B.ROH的电离程度:b点大于a点 C.若两溶液无限稀释,则它们的c(OH-)相等 D.当lg=2时,若两溶液同时升高温度,则增大 解析 由图像知,0.10 mol·L-1的MOH溶液的pH为13,说明MOH为强碱,ROH溶液的pH小于13,说明ROH为弱碱,所以MOH的碱性强于ROH的碱性,A项正确;稀释有利于弱电解质的电离,故B项正确;若两溶液无限稀释则接近中性,则它们的c(OH-)相等,C项正确;当lg=2时,MOH溶液的pH为11,ROH溶液的pH为10,若两溶液同时升高温度,ROH溶液中存在电离平衡,平衡会右移,c(R+)增大,c(M+)不变,故比值减小,D项错误。 答案 D 9.25 ℃时,用水稀释pH=13的氨水至体积为原来的100倍,下列变化正确的是( ) A.OH-物质的量不变 B.稀释后溶液pH=11 C.c(H+)和c(OH-)的乘积变小 9 D.的值变大 解析 因为一水合氨是一元弱碱,在稀释时不断地电离出氢氧根离子,其物质的量不断增多,A项错误;稀释100倍时,pH减小不到2个单位,即pH>11,B项错误;温度不变,水的离子积不变,C项错误;在分子分母同乘以c(OH-),则有,加水稀释,Kw不变,c(OH-)和c(NH3·H2O)均减小,所以分式的值变大,D项正确。 答案 D 10.下列几种情况,对中和滴定结果无影响的是( ) A.滴定管用水冲洗后即注入标准液 B.锥形瓶里有少量水 C.滴定前标准液在“0”刻度以上 D.滴定管尖端未充满液体 解析 滴定管水洗后应润洗,否则所盛溶液被稀释,A项不符合题意;锥形瓶里有少量水对滴定结果无影响,B项符合题意;滴定前标准液应调节至“0”刻度或“0”刻度以下,否则无法记录溶液体积,C项不符合题意;滴定管尖嘴应充满液体,不能留有气泡,D项不符合题意。 答案 B 11.25 ℃时,下列两溶液混合后所得溶液pH<7的是( ) A.pH=3的盐酸和pH=11的氨水等体积混合 B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 D.pH=3的硫酸和pH=11的氨水等体积混合 解析 pH=3的酸溶液中的c(H+)与pH=11的碱溶液中的c(OH-)相等。B项是强酸与强碱的反应,酸碱恰好完全中和生成强酸强碱盐,所得溶液pH=7,故B项错误;A、D项是强酸与弱碱的反应,两溶液中:已电离出的c(H+)=c(OH-),随着反应的进行,弱碱溶液中未电离的分子继续电离出OH-,使得溶液的pH>7,故A、D两项均错误;C项是强碱与弱酸的反应,两溶液中:已电离出的c(H+)=c(OH-),随着反应的进行,弱酸溶液中未电离的分子继续电离出H+,导致所得溶液的pH<7,故C项正确。 答案 C 12.(1)选用以下主要仪器和试剂,是否可以达到测定NaOH溶液浓度的目的?________(填“是”或“否”)。 主要仪器:滴定管、锥形瓶、烧杯 9 试剂:NaOH溶液、0.100 0 mol·L-1盐酸 (2)现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白: ①用标准NaOH溶液滴定时,应将标准NaOH溶液注入________(填“甲”或“乙”)中。 ②某学生的操作步骤如下: A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; B.用标准溶液润洗滴定管2~3次; C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液; D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上2~3 mL; E.调节液面至“0”或“0”以下刻度,记下读数; F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。 正确操作步骤的顺序是________(用字母序号填写)。 上述B步骤操作的目的是______________________________。 判断到达滴定终点的实验现象是_____________________________。 ③上图是碱式滴定管中液面在滴定前后的读数,c(HCl)=________mol·L-1。 解析 (1)缺少酸碱指示剂,无法判断滴定终点。 (2)①NaOH为强碱,应将NaOH溶液注入碱式滴定管中,故选乙。②按查漏→水洗→润洗→装液→排气泡→调液面→读数→加待测液和指示剂→滴定→判断终点→读数、记录数据→计算的顺序思考。判断滴定终点的方法是当滴入最后一滴标准液,溶液由无色变为浅红色,且半分钟内不褪色。③滴定过程中消耗NaOH溶液的体积为(V2-V1) mL,因此c(HCl)= mol·L-1。 答案 (1)否 (2)①乙 ②BDCEAF 洗去附在滴定管内壁上的水,防止其将标准溶液稀释而带来误差 当滴入最后一滴标准液后,溶液由无色变为浅红色,且半分钟内不褪色 ③ 13.在25.00 mL氢氧化钠溶液中逐滴加入0.200 0 mol·L-1醋酸溶液,滴定曲线如下图所示。 9 (1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式 _____________________________________________________。 (2)该氢氧化钠溶液的物质的量浓度为________ mol·L-1。 (3)设在B点时酸碱恰好中和,则a=________。 (4)若所加入的酸为0.200 0 mol·L-1的盐酸,则D点时溶液的c(H+)=________。 解析 因c(NaOH)=0.100 0 mol·L-1,则a=12.50 mL,D点c(H+)= =0.050 00 mol·L-1。 答案 (1)OH-+CH3COOH===CH3COO-+H2O (2)0.100 0 (3)12.50 mL (4)0.050 00 mol·L-1 14.某温度下的水溶液中,c(H+)=10x mol·L-1,c(OH-)=10y mol·L-1。x与y的关系如图所示。 (1)该温度下,水的离子积为________。 (2)该温度下,0.01 mol·L-1 NaOH溶液的pH为________。 答案 (1)10-15 (2)13 15.下表是不同温度下水的离子积数据: 温度/℃ 25 t1 t2 水的离子积Kw 1×10-14 a 1×10-12 试回答以下问题: (1)若25查看更多