- 2021-08-24 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学考前疑难易错专练十含解析
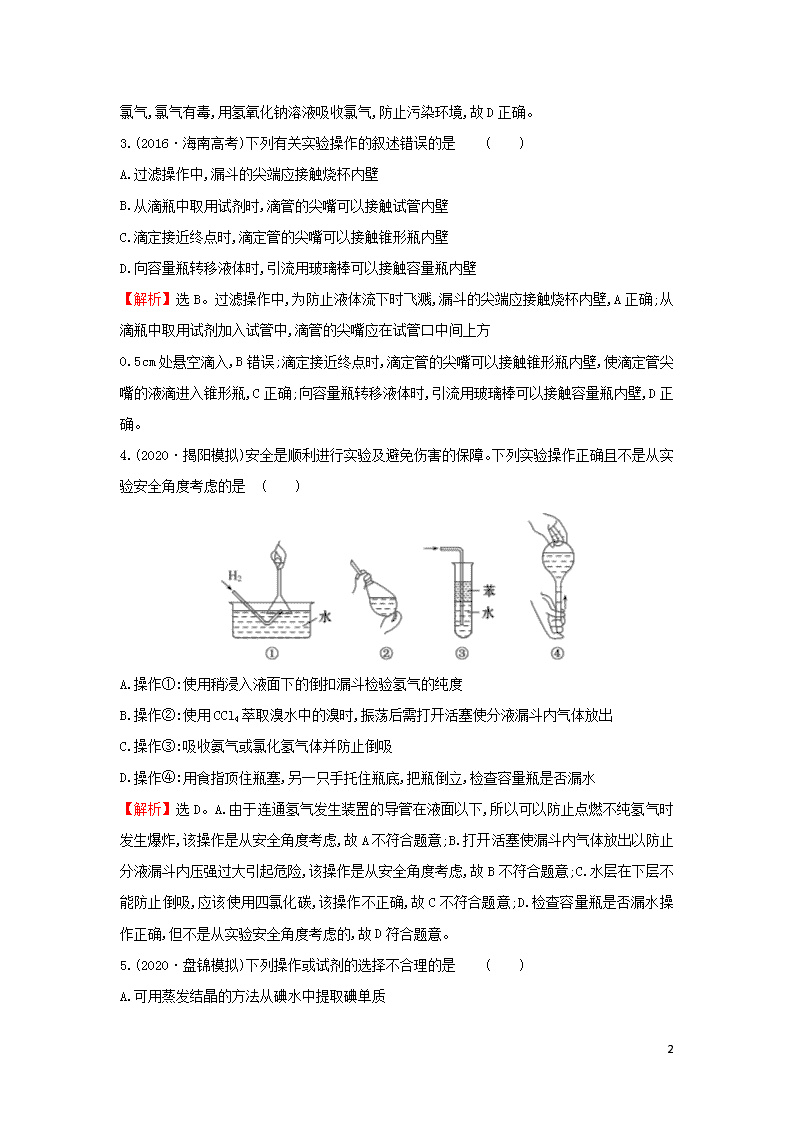
疑难易错专练(十) (建议用时50分钟) 一、选择题 1.(2020·敦煌模拟)下列各种仪器:①漏斗 ②容量瓶 ③滴定管 ④分液漏斗 ⑤天平 ⑥量筒 ⑦胶头滴管 ⑧蒸馏烧瓶。常用于物质分离的是 ( ) A.①③⑦ B.②⑥⑦ C.①④⑧ D.④⑥⑧ 【解析】选C。①漏斗可用于过滤,过滤是一种分离混合物的方法,故①正确;②容量瓶是配制一定物质的量浓度的溶液的仪器,故②错误;③滴定管是量取液体体积的仪器,故③错误;④分液漏斗是分离互不相溶且密度不同的液体的仪器,故④正确;⑤天平是称量药品质量的仪器,故⑤错误;⑥量筒是量取液体体积的仪器,故⑥错误;⑦胶头滴管是吸取和滴加少量试剂的仪器,故⑦错误;⑧蒸馏烧瓶是用于蒸馏实验的容器,蒸馏是一种分离物质的方法,故⑧正确。 2.(2020·云南师大附中模拟)下列有关实验室的制备方法中,不能达到实验目的的是 ( ) 【解析】选B。A.双氧水在二氧化锰的催化作用下分解生成氧气,故A正确;B.应该将氢氧化钠溶液滴入新制硫酸铁溶液中制备氢氧化铁,故B错误;C.实验室在浓硫酸的催化作用下,乙醇与乙酸发生酯化反应制备乙酸乙酯,并用饱和碳酸钠溶液吸收反应生成的乙酸乙酯,故C正确;D.实验室用高锰酸钾与浓盐酸反应制取氯气,氯气比空气密度大, 7 用向上排空气法收集氯气,氯气有毒,用氢氧化钠溶液吸收氯气,防止污染环境,故D正确。 3.(2016·海南高考)下列有关实验操作的叙述错误的是 ( ) A.过滤操作中,漏斗的尖端应接触烧杯内壁 B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁 C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 D.向容量瓶转移液体时,引流用玻璃棒可以接触容量瓶内壁 【解析】选B。过滤操作中,为防止液体流下时飞溅,漏斗的尖端应接触烧杯内壁,A正确;从滴瓶中取用试剂加入试管中,滴管的尖嘴应在试管口中间上方 0.5 cm处悬空滴入,B错误;滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁,使滴定管尖嘴的液滴进入锥形瓶,C正确;向容量瓶转移液体时,引流用玻璃棒可以接触容量瓶内壁,D正确。 4.(2020·揭阳模拟)安全是顺利进行实验及避免伤害的保障。下列实验操作正确且不是从实验安全角度考虑的是 ( ) A.操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度 B.操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使分液漏斗内气体放出 C.操作③:吸收氨气或氯化氢气体并防止倒吸 D.操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水 【解析】选D。A.由于连通氢气发生装置的导管在液面以下,所以可以防止点燃不纯氢气时发生爆炸,该操作是从安全角度考虑,故A不符合题意;B.打开活塞使漏斗内气体放出以防止分液漏斗内压强过大引起危险,该操作是从安全角度考虑,故B不符合题意;C.水层在下层不能防止倒吸,应该使用四氯化碳,该操作不正确,故C不符合题意;D.检查容量瓶是否漏水操作正确,但不是从实验安全角度考虑的,故D符合题意。 5.(2020·盘锦模拟)下列操作或试剂的选择不合理的是 ( ) A.可用蒸发结晶的方法从碘水中提取碘单质 7 B.可用灼烧法除去氧化铜中混有的铜粉 C.可用硫酸鉴别碳酸钠、硅酸钠和硫酸钠 D.可用含氢氧化钠的氢氧化铜悬浊液鉴别乙醇、乙醛和乙酸 【解析】选A。A项,碘单质不易溶于水,易溶于有机溶液,一般使用萃取来提纯;B项,铜与氧气反应生成氧化铜,则灼烧可除去杂质;C项,硫酸与碳酸钠反应生成气体,与硅酸钠反应会有沉淀生成,易于分辨;D项,乙醇、乙醛和乙酸分别与含氢氧化钠的氢氧化铜悬浊液混合的现象为无现象、砖红色沉淀、蓝色溶液,现象不同可鉴别。 6.除去下列物质中的杂质选用的试剂和方法最合理的是 ( ) 选项 物质 杂质 试剂 方法 A 乙烷 乙烯 溴的四氯化碳溶液 洗气 B 氯化亚铁溶液 氯化铁 过量铁粉 过滤 C 二氧化硅 氧化铝 氢氧化钠溶液 过滤 D 乙酸乙酯 乙酸 饱和碳酸钠溶液 蒸馏 【解析】选B。A项,因乙烷易溶于四氯化碳,不可用溴的四氯化碳溶液除杂应该改用溴水;B项,铁粉可与氯化铁反应生成氯化亚铁,可除去杂质;C项,二者均与氢氧化钠反应,不能除杂,应选盐酸、过滤;D项,乙酸与碳酸钠溶液反应,乙酸乙酯不溶于水,且在饱和碳酸钠溶液上层,不互溶,则分液、干燥、蒸馏可得纯净的乙酸乙酯。 二、非选择题 7.(2020·潍坊模拟)FeCl2是一种常用的还原剂、媒染剂。某化学小组同学在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如表: 物质 C6H5Cl (氯苯) C6H4Cl2 (二氯苯) FeCl3 FeCl2 溶解性 不溶于水,易溶于苯、乙醇 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 熔点/℃ -45 53 易升华 沸点/℃ 132 173 — — 7 请回答下列问题: (1)利用反应2FeCl3+C6H5Cl2FeCl2+ C6H4Cl2+HCl制取无水FeCl2并测定FeCl3的转化率。按图装置连接仪器,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯。打开K1、K2,关闭K3,通一段时间H2后关闭K2,控制三颈烧瓶内反应温度在128~139 ℃,反应一段时间。反应完成后打开K2,再通氢气一段时间。 ①仪器a的名称是________,装置B中盛装的试剂是________。 ②反应后再通入H2的目的是______________________________________。 ③冷却实验装置,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,回收滤液中C6H5Cl的操作方法是 ________________________________。 ④反应后将锥形瓶C中溶液配成250 mL溶液,取25.00 mL所配溶液,用 0.4 mol·L-1 NaOH溶液滴定,消耗NaOH溶液23.60 mL,则氯化铁的转化率为________。 (2)打开K1、K3,关闭K2,通氢气与氯化铁反应制取无水FeCl2。 ①写出反应的化学方程式____________________________________。 ②实验制得FeCl2后并防止氧化的操作是 ______________________。 ③请指出该制备方法的缺点__________________________________。 【解析】(1)①仪器a的名称为球形冷凝管,装置B的作用是防止外界水蒸气进入三颈烧瓶中影响实验进行,其中的干燥剂不能吸收HCl,因为最后的尾气处理中用水吸收氯化氢,还可以得到副产品盐酸,故盛放的试剂可以是无水CaCl2,或其他不与HCl反应的试剂,如P2O5或硅胶; ②反应后再通入H2,可将反应器中的HCl气体全部吹入装置C,使其被充分吸收,操作更规范,同时使后续测量氯化铁转化率更精准; ③由题中表格所给数据可知,C6H5Cl的沸点为132 ℃,C6H4Cl2的沸点为173 ℃,利用沸点不同回收滤液中C6H5Cl可采用蒸馏法,即蒸馏滤液,收集132 ℃的馏分; ④NaOH与HCl按1∶1完全反应,则标准NaOH溶液滴定的盐酸的物质的量= 7 0.4 mol·L-1×23.60×10-3 L=9.44×10-3 mol,则锥形瓶中盐酸的物质的量=×9.44×10-3 mol=9.44×10-2 mol,再根据已知关系式2FeCl3~HCl可知,消耗的FeCl3的物质的量=2×9.44×10-2 mol=0.188 8 mol,故FeCl3的转化率=×100%=×100%=94.4%。 (2)①氢气与氯化铁反应时,氢气作为还原剂,将氯化铁还原为氯化亚铁,其反应的方程式可表示为H2+2FeCl32FeCl2 + 2HCl; ②实验通过氢气与FeCl3反应制得FeCl2后,为防止FeCl2被氧化,先熄灭酒精灯,再继续通入氢气一段时间,以排尽装置中的空气; ③根据表中数据可知,因氯化铁易升华,则用加热的方法制备氯化亚铁,会导致氯化铁转化率降低,且导管易堵塞。 答案:(1)①球形冷凝管 无水CaCl2(或硅胶、P2O5) ②将反应器中的HCl气体全部排入锥形瓶C内,使其被充分吸收 ③蒸馏滤液,并收集132 ℃的馏分 ④94.4% (2)①H2+2FeCl32FeCl2+2HCl ②先熄灭酒精灯,再继续通入氢气一段时间 ③氯化铁易升华,导致FeCl3的转化率低;导管易堵塞 8.(2020·重庆模拟)实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如图: 7 有关物质的物理性质见下表。 物质 沸点(℃) 密度(g·cm-3,20℃) 溶解性 环己醇 161.1(97.8)* 0.96 能溶于 水和醚 环己酮 155.6(95.0)* 0.95 微溶于水, 能溶于醚 水 100.0 1.0 *括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。 实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60 ℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100 ℃的馏分,得到主要含环己酮粗品和水的混合物。 (1)装置D的名称为________。 (2)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。 ①滴加酸性Na2Cr2O7溶液的操作为 _________________________________ ②蒸馏不能分离环己酮和水的原因是 _______________________________。 (3)环己酮的提纯需要经过以下一系列的操作: a.蒸馏、除去乙醚后,收集151~156 ℃馏分 b.水层用乙醚(乙醚沸点34.6 ℃,易燃烧)萃取,萃取液并入有机层 c.过滤 d.往液体中加入NaCl固体至饱和,静置,分液 e.加入无水MgSO4固体,除去有机物中少量的水 ①上述提纯步骤的正确顺序是____________________________________; ②B中水层用乙醚萃取的目的是 __________________________________; ③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有________,操作d中,加入NaC1固体的作用是____________________________。 (4)恢复至室温时,分离得到纯产品体积为6 mL,则环己酮的产率为________。(计算结果精确到0.1%) 【解析】(1)根据装置图可知,装置D是冷凝管; 7 (2)①滴加酸性Na2Cr2O7溶液的方法是打开分液漏斗颈上的玻璃塞,拧开下端的活塞,缓慢滴加;②蒸馏不能分离环己酮和水的原因是环己酮和水形成具有固定组成的恒沸物一起蒸出; (3)①环己酮的提纯需要经过以下一系列的操作:往液体中加入NaCl固体至饱和,静置,分液;水层用乙醚萃取,萃取液并入有机层;加入无水MgSO4固体,除去有机物中少量的水,过滤;蒸馏、除去乙醚后,收集151~156 ℃馏分。所以,提纯步骤的正确顺序是dbeca; ②b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量; ③上述操作c、d(过滤和萃取)中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有漏斗、分液漏斗。操作d中,加入NaCl固体的作用是降低环己酮的溶解度,増加水层的密度,有利于分层; (4)恢复至室温时,分离得到纯产品体积为6 mL,由表中的密度可以算出环己酮的质量为5.7 g,则其物质的量为0.0582 mol。由密度可以算出10 mL环己醇的质量为9.6 g,则其物质的量为0.096 mol,则环己酮的产率为×100%=60.6%。 答案:(1)冷凝管 (2)①打开分液漏斗颈上的玻璃塞,拧开下端的活塞,缓慢滴加 ②环己酮和水形成具有固定组成的恒沸物一起蒸发 (3)①dbeca ②使水层中少量的有机物进一步被提取,提高产品的产量 ③漏斗、分液漏斗 降低环己酮的溶解度,增加水层的密度,有利于分层 (4)60.6% 7查看更多