- 2021-08-24 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
宁夏银川一中2020届高三化学第四次模拟试题(Word版附答案)
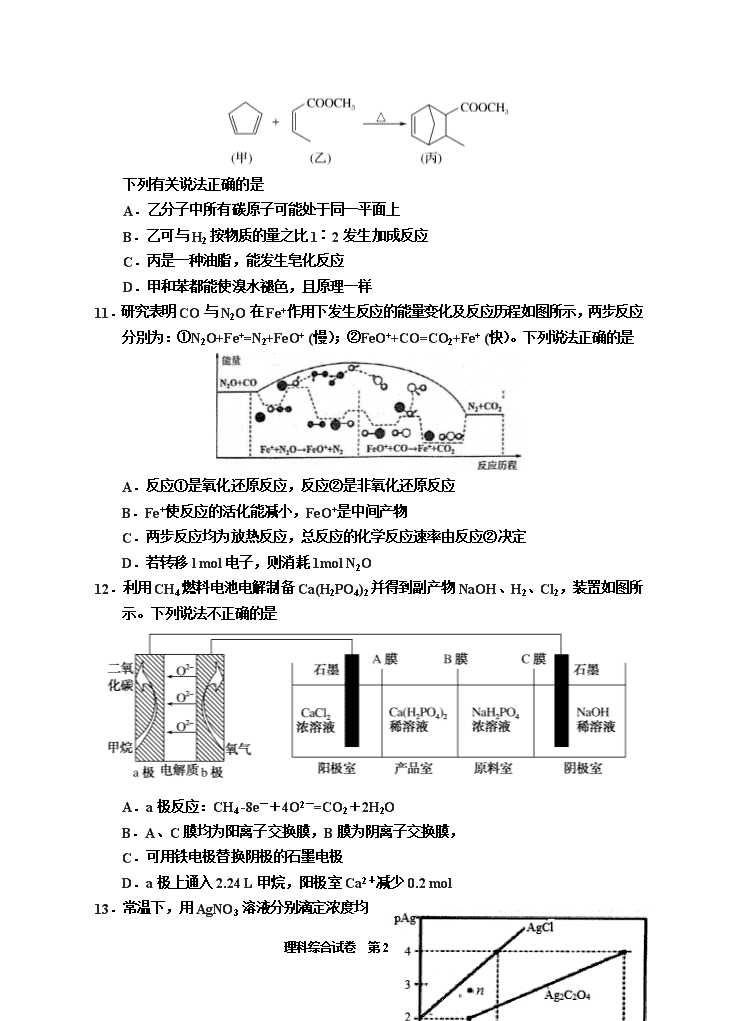
理科综合试卷 第 1页(共 16页) 绝密★启用前 2020 年普通高等学校招生全国统一考试 理科综合能力测试试题卷-化学试题 ( 银川一中第四次模拟考试 ) 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.作答时,务必将答案写在答题卡上。写在本试卷及草稿纸上无效。 3.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cu-64 Ag-108 一、选择题:本题共 13 小题,每小题 6 分,在每小题给出的四个选项中,只有一项是符 合题目要求的。 7.下列说法正确的是 A.2022年冬奥会聚氨酯速滑服是新型无机非金属材料 B.75%酒精可用于消毒杀死新冠病毒,如果用 90%酒精效果更好 C.纳米铁粉和 FeS都可以高效地去除被污染水体中的 Pb2+、Cu2+、Cd2+、Hg2+等重金 属离子,其原理是相同的 D.核酸检测是确认病毒类型的有效手段, 核酸是高分子化合物 8.NA表示阿伏加德罗常数的值。下列叙述正确的是 A.1 mol甲基(—CH3)所含的电子数为 10NA B.64g Cu和足量的硫粉加热,充分反应转移的电子数是 2NA C.在 0℃、101 kPa条件下,11.2L丁烷中含极性共价键数目为 5NA D.1L 0.1 mol· L-1NH4H2PO4溶液中阴阳离子数相等 9.X、Y、Z、M、Q、R为短周期元素, 其原子半径和 最外层电子数之间的关系如图所示。下列说法错误的是 A.R不能把 Q从其盐溶液中置换出来 B.X、R、Q三种元素可以构成离子化合物 C.热稳定性:ZX3<YX4 D.X2M的水溶液露置于空气中易变质 10.化合物丙属于一种桥环化合物,是某些医药的中间体,可以通过以下反应制得: 理科综合试卷 第 2页(共 16页) 下列有关说法正确的是 A.乙分子中所有碳原子可能处于同一平面上 B.乙可与 H2按物质的量之比 1∶2发生加成反应 C.丙是一种油脂,能发生皂化反应 D.甲和苯都能使溴水褪色,且原理一样 11.研究表明 CO与 N2O在 Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应 分別为:①N2O+Fe+=N2+FeO+ (慢);②FeO++CO=CO2+Fe+ (快)。下列说法正确的是 A.反应①是氧化还原反应,反应②是非氧化还原反应 B.Fe+使反应的活化能减小,FeO+是中间产物 C.两步反应均为放热反应,总反应的化学反应速率由反应②决定 D.若转移 l mol电子,则消耗 1mol N2O 12.利用 CH4燃料电池电解制备 Ca(H2PO4)2并得到副产物 NaOH、H2、Cl2,装置如图所 示。下列说法不正确的是 A.a极反应:CH4 -8e-+4O2-=CO2+2H2O B.A、C膜均为阳离子交换膜,B膜为阴离子交换膜, C.可用铁电极替换阴极的石墨电极 D.a极上通入 2.24 L甲烷,阳极室 Ca2+减少 0.2 mol 13.常温下,用 AgNO3溶液分别滴定浓度均 理科综合试卷 第 3页(共 16页) 为 0.01mol/L的 KCl、K2C2O4溶液, 所得的沉淀溶解平衡图像如图所示(不 考虑 C2O42-的水解,pAg= lgc(Ag+)), 下列说法正确的是 A.KspAg2C2O4的数量级等于 10-10 B.n点表示 AgCl的过饱和溶液 C.向 c(Cl-)=c(C2O42-)的混合液中滴入 AgNO3溶液时,先生成 Ag2C2O4沉淀 D.Ag2C2O4+ 2Cl- 2AgCl + C2O42-的平衡常数为 103.29 26.(15分) 一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O,相对分子质量为 246]是一种重要的染料及 农药中间体。常温下该物质可溶于水,难溶于乙醇。某化学兴趣小组通过以下实验制备一 水硫酸四氨合铜晶体并测定其纯度。回答相关问题: I.实验室制取 CuSO4溶液 方案 i:铜与浓硫酸加热制备。 方案 ii:将铜粉在空气中充分加热至完全变黑,再加稀硫酸即可得到硫酸铜溶液。 (1)请写出方案 i 反应的化学方程式________________________________________, 此方法硫酸的利用率较低的原因是___________________________(写 1点)。 (2)实际生产中方案 ii常常有紫红色固体未反应,猜想原因可能是___________。 (3)某同学对实验 ii进行了改进, 其中一种方案 是在硫酸和铜的反应容器中滴加 H2O2 溶液,观察到 的现象是_____________________________________。 H2O2的沸点为 150.2℃。为加快反应需要提高 H2O2 溶液的浓度,可通过右图将 H2O2稀溶液浓缩,增加 减压设备的目的除了加快蒸馏速度,还有可能是 ________________________。 II.一水硫酸四氨合铜晶体的制备 (4)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量 NH3·H2O调节溶液 pH,产生浅 蓝色沉淀,已知其成分为 Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式 ____________________________________________________________________。 (5)继续滴加 NH3·H2O, 会转化成深蓝色溶液。向深蓝色溶液中加入乙醇可析出深 蓝色晶体,滴加乙醇的作用可能是( ) 理科综合试卷 第 4页(共 16页) A.乙醇可以作还原剂 B.乙醇可以降低该晶体在该溶液中的溶解度 C.乙醇可以作萃取剂 Ⅲ.产品纯度的测定 (6)精确称取 mg晶体,加适量水溶解,然后逐滴加入足量 NaOH溶液,通入水蒸气将 氨全部蒸出,用 V1mL0.200mol·L-1的盐酸完全吸收。以甲基橙作指示剂,用 0.200mol·L-1 NaOH标准溶液滴定过剩的 HCl,到终点时消耗 V2mLNaOH溶液。产品纯度的表达式为 ____________。 27.(14分) JohnB.Goodenough等三位科学家因为在锂离子电池研究领域的突出贡献获得 2019年 诺贝尔化学奖。碳酸锂是一种常见的锂离子电池原料,一种以锂辉石为原料制取碳酸锂的 工艺如下图:(锂辉石:LiAl(SiO3)2,也表示为 Li2O·Al2O3·4SiO2,还含微量的钠、钙、镁 等元素) [查阅资料]:Li2CO3为无色单斜晶系结晶体,熔点 618℃,溶于硫酸,微溶于水,在冷水中 的溶解度比热水中大。 (1)在“硫酸浸出”流程,将硫酸加热到 130℃的目的是___________________________。 (2)工业上高温煅烧 FePO4、Li2CO3和草酸晶体(H2C2O4·2H2O)的混合物制取电池材 料磷酸亚铁锂(LiFePO4),反应的化学方程式为__________________________________。 (3)LiFePO4含有 Fe、Li两种金属元素,它们的焰色反应的颜色分别是( ) A.黄色、紫红色 B.绿色、黄色 C.无焰色反应、紫红色 D.黄色、无焰色反应 (4)在“Li2CO3分离、洗涤”流程,用热水洗涤的原因是___________________________。 (5)某浓差电池的原理示意如下图所示,可用该电池从浓缩海水中提取 LiCl溶液。 电池中的 Y电极为________(填“正极”或“负极”或“阳极”或“阴极”)。 理科综合试卷 第 5页(共 16页) X极的电极反应方程式为:________________________________________________。 Y极每生成标况下 22.4LCl2,有_________mol Li+经过离子导体。 28.(14分) CO、CO2是化石燃料燃烧后的主要产物。 (1) 汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大 气循环物质。已知: N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1 2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1 C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 则反应 2NO(g)+2CO(g)===N2(g)+2CO2(g)的ΔH=________ kJ·mol-1。 (2)已知:反应 CO2(g) CO(g)+O(g)在密闭容器中 CO2分解实验的结果如下图 1;反 应 2CO2(g) 2CO(g)+O2(g)中 1molCO2在不同温度下的平衡分解量如下图 2, ①分析图 1,求 2min 内 v(CO2)=_______,5min时达到平衡,平衡时 c(CO)=_______。 ②分析图 2,1500℃时反应达平衡,此时容器体积为 1 L,则反应的平衡常数 K=______(计算结果保留 1位小数)。 (3)为探究不同催化剂对 CO和 H2合成 CH3OH的选择性效果,某实验室控制 CO和 H2的初始投料比为 1:3进行实验,得到如下数据: 选项 T/K 时间/min 催化剂种类 甲醇的含量(%) A 450 10 CuO-ZnO 78 B 450 10 CuO-ZnO-ZrO2 88 C 450 10 ZnO-ZrO2 46 ①由表 1可知,该反应的最佳催化剂为____________(填编号);图 3中 a、b、c、d 四点是该温度下 CO的平衡转化率的是____________。 ②有利于提高 CO转化为 CH3OH的平衡转化率的措施有____________。 理科综合试卷 第 6页(共 16页) A.使用催化剂 CuO-ZnO-ZrO2 B.适当降低反应温度 C.增大 CO和 H2的初始投料比 D.恒容下,再充入 a mol CO和 3a mol H2 35.[化学——选修 3:物质结构与性质](15分) 我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这 些颜料的成分进行了研究,发现其成分主要为 BaCuSi4O10、BaCuSi2O6。 (1)“中国蓝”、“中国紫”中均有 Cun+离子,n=___________,基态时该阳离子的价电 子排布式为___________。 (2)“中国蓝”的发色中心是以 Cun+为中心离子的配位化合物,其中提供孤对电子的是 ____元素。 (3)已知 Cu、Zn的第二电离能分别为 1957.9 kJ·mol-1、1733.3 kJ·mol-1,前者高于后 者的原因是________________________________________。 (4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2 Cu 2CH3CHO+2H2O。 乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为 ___________。 (5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与 铜晶胞类似,银位于顶点,铜位于面心。 ①该铜银合金的化学式是___________________。 ②已知:该铜银晶胞参数为 a cm,晶体密度为ρ g·cm-3。 则阿伏加德罗常数(NA)为_______mol-1(用代数式表示,下同)。 ③若Ag、Cu原子半径分别为b cm、c cm,则该晶胞中原子空间利用率φ为___________。 (提示:晶胞中原子空间利用率= 原子总体积 晶胞体积 ×100%) 36.[化学—选修 5:有机化学基础](15分) 麻黄素M是拟交感神经药。合成M的一种路线如图所示: 已知:I.R—CH2OH 3 + CrO H RCHO 理科综合试卷 第 7页(共 16页) II.R1-CHO+R-C≡CNa H IV. V. 请回答下列问题: (1)D的名称是_______;G中含氧官能团的名称是_______。 (2)反应②的反应类型为_______;A的结构简式为_______。 (3)写出反应⑦的化学方程式:______________________________。 (4)X分子中最多有_______个碳原子共平面。 (5)在 H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共 振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为________________。 (6)已知: 仿照上述流程,设计以苯、乙醛为主 要原料合成某药物中间体 的路线________________。 理科综合试卷 第 8页(共 16页) 银川一中 2020 届高三第四次模拟考试化学参考答案 26.(15分) (1)Cu+2H2SO4(浓) △ CuSO4+ SO2↑+2H2O(2分); 随着反应的进行,浓硫酸被稀释为稀硫酸,稀硫酸不与 Cu反应或者浓硫酸反应生成 SO2,使得硫酸利用率降低(2分)。 (2)表面生成的 CuO 阻止内部铜与 O2接触或反应(2分)。 (3)铜溶解、溶液变蓝(2分); 降低水的沸点,避免 H2O2分解(2分)。 (4)2Cu2++2NH3·H2O+SO42 -=Cu2(OH)2SO4↓+2NH4 + (2分) (5)B(1分) (6) 3 1 20.2( ) 10 246 100% 4 V V m = 1 21.23( )%V V m (2分) 27、(每空 2分,共 14分) (1)温度升高可加快浸出速率 (2)2FePO4+Li2CO3+H2C2O4.2H2O=== 高温 2LiFePO4+3CO2↑+3H2O↑ (3)C (4)Li2CO3在冷水中的溶解度比热水中大,热水洗涤可减少 Li2CO3的溶解度损耗,提高 产率 (5)负极 2H++ 2e- =H2↑ 2 28、(每空 2分,共 14分) (1) -746.5 (2)① 3×10-7 mol/(L·min) 2×10-6 mol/L ②3.2×10-8 (3)① B cd ②BD 35、(15分) (1) 2 (1分) 3d9 (1分) (2) O或氧 (1分) (3) Cu失去一个电子后的价层电子排布式为 3d10,达到全充满稳定结构;Zn 失去一个电子 后的价层电子排布式为 3d104s1,Zn+ 4s1上的电子比 Cu+ 3d10上的电子易失去 (2分) 7 8 9 10 11 12 13 D C C A B D B 理科综合试卷 第 9页(共 16页) (4).sp2、sp3 (2分) 6:1 (2分) (5)①AgCu3或 Cu3Ag (2分) ② 3 300 a (2分) ③ 3 3 3 4 3 100% 3 c b a (2分) 36、 (15分) (1)苯甲醛(1分) 羟基(1分) (2)取代反应或水解反应 (2分) (2分) (3) +CH3NH2 2H O +H2O (2 分) (4)10(2分) (5) (2分) (6) (3分)查看更多