- 2021-08-24 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年浙江省嘉兴市第一中学、湖州中学高一上学期期中联考化学试题
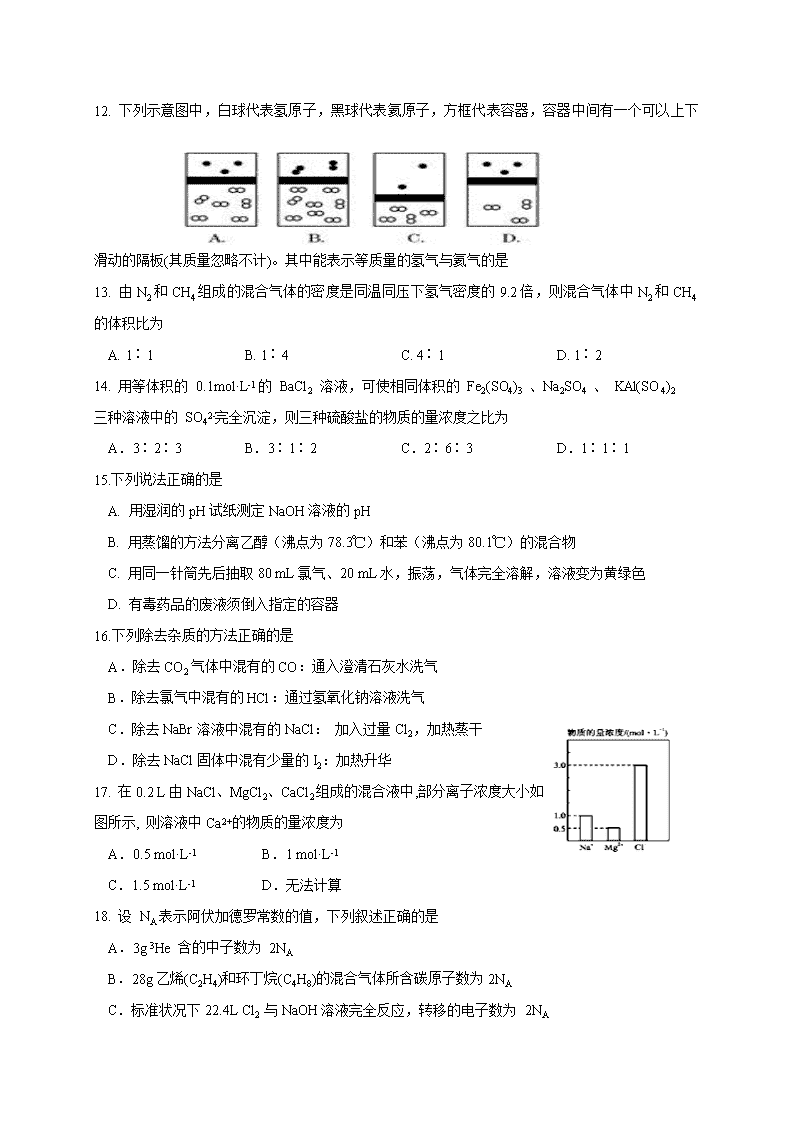
2019-2020学年浙江省嘉兴市第一中学、湖州中学高一上学期期中联考化学试题 考生须知: 1.本卷满分100分,考试时间90分钟; 2.答题前,在答题卷指定区域填写班级、姓名、试场号、座位号; 3.所有答案必须写在答题卷上,写在试卷上无效; 4.考试结束后,只需上交答题卷。 元素相对原子质量: H—1;He—4;C—12;N—14;O—16;Na—23;S—32; Cl—35.5;K-39;Ca—40;Mn—55; Fe—56;Cu-64;Zn-65;Ba—137 选择题部分 一、选择题(共25小题,每小题只有一个正确选项,每小题2分,共50分) 1. 下列物质分类正确的是 A. 雾、氯化铁溶液均为胶体 B.烧碱、纯碱均为碱 C. SiO2、CO2 均为酸性氧化物 D.氨水、冰水混合物均为纯净物 2. 下列实验操作中,不能用于物质分离的是 3. 用化学方法不能实现的是 A.生成一种新分子 B.生成一种新离子 C.生成一种新原子 D.生成一种新单质 4. 下列化学用语正确的是 A. H、H、和是氢元素的四种不同粒子 B. 18O2和16O3互为同位素 C. S2-的结构示意图为: D. 23992U中质子数和中子数相差147 5. 下列实验事实与原子结构模型建立的关系正确的是 A. 阴极射线实验发现电子:道尔顿原子结构模型 B. α粒子散射实验发现原子核:卢瑟福原子结构模型 C. 氢原子光谱发现电子分层排布:卢瑟福原子结构模型 D. α粒子散射实验发现电子:汤姆生原子结构模型 6. 化学与生活密切相关,下列说法不正确的是 A. 食品包装袋内常用铁粉作为脱氧剂以延长食品保存时间 B. FeCl3浓溶液与沸水反应生成Fe(OH)3胶体,可作净水剂 C.漂白粉的有效化学成分是次氯酸钙,能起到杀菌、消毒的作用 D. 活性炭具有除异味和杀菌作用 7. 判断下列化学概念的依据正确的是 A. 溶液与胶体不同的本质原因:是能否发生丁达尔效应 B. 纯净物与混合物:是否仅含有一种元素 C. 氧化还原反应:反应前后元素化合价是否变化 D. 电解质与非电解质:物质本身是否导电 8. 下列变化必需加入还原剂才能实现的是 A.KMnO4→MnO2 B. Cl2→NaCl C. FeCl3→FeCl2 D. CO→CO2 9. 氧化还原反应与基本反应类型的关系如图所示,则下列化学反应属于氧化还原反应但不包含在1,2,4范围内的是 A. Cl2+2KI = I2 +2KCl B. NH4HCO3 == NH3↑+CO2↑+H2O ↓ C. 2FeCl2+ Cl2==2FeCl3 D. 3NO2+H2O==2HNO3 + NO 10. 将足量 CO2气体通入下列物质中,没有明显现象的是 A.CaCl2溶液 B.澄清石灰水 C.Ca(ClO)2溶液 D.CaCO3的悬浊液 11. 标准状况下,气体的体积大小主要取决于 A.分子数目 B.分子间距 C.分子大小 D.分子种类 12. 下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是 13. 由N2和CH4组成的混合气体的密度是同温同压下氢气密度的9.2倍,则混合气体中N2和CH4的体积比为 A. 1∶1 B. 1∶4 C. 4∶1 D. 1∶2 14. 用等体积的 0.1mol·L-1的 BaCl2 溶液,可使相同体积的 Fe2(SO4)3 、Na2SO4 、 KAl(SO4)2 三种溶液中的 SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为 A.3∶2∶3 B.3∶1∶2 C.2∶6∶3 D.1∶1∶1 15.下列说法正确的是 A. 用湿润的pH试纸测定NaOH溶液的pH B. 用蒸馏的方法分离乙醇(沸点为78.3℃)和苯(沸点为80.1℃)的混合物 C. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色 D. 有毒药品的废液须倒入指定的容器 16.下列除去杂质的方法正确的是 A.除去CO2气体中混有的CO:通入澄清石灰水洗气 B.除去氯气中混有的HCl:通过氢氧化钠溶液洗气 C.除去NaBr溶液中混有的NaCl: 加入过量Cl2,加热蒸干 D.除去NaCl固体中混有少量的I2:加热升华 17. 在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示, 则溶液中Ca2+的物质的量浓度为 A.0.5 mol·L-1 B.1 mol·L-1 C.1.5 mol·L-1 D.无法计算 18. 设 NA表示阿伏加德罗常数的值,下列叙述正确的是 A.3g 3He 含的中子数为 2NA B.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体所含碳原子数为2NA C.标准状况下22.4L Cl2 与NaOH溶液完全反应,转移的电子数为 2NA D.1 L 0.4mol/L盐酸与0.1mol MnO2共热后,生成Cl2的分子数为0.1NA 19.在0℃ 1.01×105 Pa下,有关H2、O2、CH4三种气体的叙述正确的是 A.等体积的三种气体,其物质的量之比等于相对分子质量之比 B.三种气体的密度之比等于摩尔质量之比 C.等质量的三种气体,其体积比等于相对分子质量之比 D.等体积、等密度的三种气体物质的量之比等于相对分子质量之比 20.已知在酸性条件下有以下反应关系:①KBrO3能将KI氧化成I2或KIO3,本身被还原为Br2;②Br2能将I-氧化为I2;③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,本身被还原为I2。向KI的硫酸溶液中滴加少量KBrO3溶液后,所得产物除水外还有 A. Br2、Br-、I2 B. Br-、I2、IO3- C、Br-、IO3- D. Br-、I2 21.下列说法正确的是 A. 做焰色反应前铂丝要先在硫酸中洗涤,再在酒精灯上灼烧至无色 B. AgBr是一种重要的感光材料,可用于制作照相底片 C. 新制的氯水应保存在无色广口瓶中,并放在阴凉处 D. 碘是人体必需的微量元素,所以人每天要要适当补充含I2的食盐 22.下列实验操作对应的现象不符合事实的是 A.在某溶液中加入盐酸后无现象,再加BaCl2产生白色沉淀证明有SO42- B.样品中加NaOH溶液加热,蓝色石蕊试纸变红,证明检验样品中有NH4+的存在 C.将混有少量氯化钾的硝酸钾饱和溶液在冰水中冷却,KNO3晶体先析出 D.将灼热的铜丝伸入盛有氯气的集气瓶中,铜丝剧烈燃烧,产生棕黄色的烟 23. 将0.195g锌粉加入到20.0 mL 0.100 mol·L-1 MO2+溶液中,恰好完全反应,则还原产物可能是 A. M B.MO2+ C. M3+ D.M2+ 24. 在标准状况下, 将V L气体A(摩尔质量为M g/mol), 溶于0.1L水中, 所得溶液密度为d g/cm3, 则该溶液的物质的量浓度为 A. mol/L B. mol/L C. mol/L D. mol/L 25. 今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取三份各100 mL该溶液进行如下实验: ①第一份加入硝酸银溶液,有沉淀产生 ②第二份加足量NaOH溶液加热后,收集到气体0.04 mol ③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥,沉淀质量为2.33g 根据上述实验,以下推测不正确的是 A. Cl-可能存在 B. 100mL溶液中含有0.02mol CO32- C. Na+可能存在,要确定需要通过焰色反应 D. Mg2+、Ba2+一定不存在 非选择题部分 二、填空题(本题包括5小题,共50分) 26. (14分)(1)用化学用语表示9个质子, 10个中子的核素: _______________。 (2)写出下列反应方程式 ①足量的NaOH溶液与SO2反应__________________________________________。 ②用氯气制备漂白粉的反应______________________________________________。 (3)下列物质能导电的是 ,属于电解质的是 ,属于非电解质的是 (填序号)。 ①NaCl溶液 ②干冰 ③液态氢化氢 ④铁 ⑤硫酸钡固体 ⑥蔗糖(C12H22O11) ⑦氨气 ⑧硫酸氢钠固体 写出⑧在水溶液中的电离方程式________________________。 27. (12分)(1)标准状况下,与5.6L的CH4气体含相同H原子数的硫化氢的质量为_____g。 (2) 将2 mol·L-1 Al2(SO4)3 和 0.2 mol·L-1 H2SO4 溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中c (SO42-)=_____________ mol·L-1 。若用容量瓶以质量分数为98%、 密度为1.84g/cm3 的浓硫酸,配制480mL浓度成0.2 mol·L-1 稀硫酸,计算需要量取________mL的浓硫酸。 (3) 配平以下方程式 ______K2Cr2O7 + ______HCl == _____KCl + ______CrCl3 + ______Cl2↑+ ______H2O 上述反应中物质氧化性: ______>______ , 每生成lmol Cl2时有 ______ 个电子发生转移, 氧化剂与还原剂的物质的量之比为 ______ 。 27. (10分)(1)有关物质的量浓度的配制下列说法正确的是_______ A. 称取2.0g NaOH固体:先在托盘各放1张滤纸,然后在右盘加2g砝码,左盘加NaOH固体 B. 容量瓶上标有温度和容积使用前要检查是否漏水 C.称取16.0 g CuSO4 固体在500mL容量瓶中加水溶解后定容,可配得0.20 mol/L的CuSO4溶液 D. 配制硫酸溶液时,可先在量筒中加入一定体积的水,再慢慢注入浓硫酸 E. 配制溶液时,俯视容量瓶刻度线造成浓度偏高 F. 溶液转移定容时,溶液未冷却至室温造成浓度偏低 (2) 海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(每一步所加试剂均过量): 现有下列仪器,请按要求填写以下空白: Ⅰ. 步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,右图中还缺少的玻璃仪器是 。 Ⅱ. 如何检验步骤③操作后碘化钠滤液中的碘离子__________, 步骤⑤所需的操作名称是_______。 Ⅲ. 写出步骤④的化学反应方程式_____________________。 28. (8分)ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,如图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。 (1)仪器P的名称是 。 (2)实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应,写出D中发生反应的方程式: 。 (3)B装置中所盛的试剂是 。 (4)F为ClO2收集装置,应选用的装置是 (填序号),其中与E装置导管相连的导管口是 (填接口字母)。 30.(6分)一定量的氢气在氯气中燃烧,所得混合物用 100mL 质量分数为 20%,密度为 1.2g/cm3的 NaOH 溶液吸收,恰好完全吸收,测得溶液中含有 NaClO 的物质的量为 0.1mol。 (1)原 NaOH 溶液的物质的量浓度为______ mol/L; (2)所得溶液中 Cl-的物质的量为_____ mol; (3)原混合气体中氯气和氢气的物质的量之比为__________。 2019学年第一学期高一化学答题卷 选择题部分 一、选择题(共25小题,每小题只有一个正确选项,每小题2分,共50分) 题号 1 2 3 4 5 6 7 8 9 10 答案 题号 11 12 13 14 15 16 17 18 19 20 答案 题号 21 22 23 24 25 答案 非选择题部分 二、填空题(本题包括5小题,共50分) 26. (14分) (1) _______________ (2)①______________________________________________________________ ②_______________________________________________________________ (3) , , (填序号)。 __________________________________________________________________ 27.(12分) (1)_____________g (2)c (SO42-)=_____________ mol·L-1 。____________mL的浓硫酸 (3)配平以下方程式 ______K2Cr2O7 + ______HCl == _____KCl + ______CrCl3 + ______Cl2↑+ ______H2O 氧化性: ___________>___________ , ___________________ 个, ____________________ 。 28.(10分) (1)_____________ (2)Ⅰ. Ⅱ. ____________________________________________________________________________, ___________________ Ⅲ. ____________________________________________________________________________ 29.(8分) (1) (2) (3) (4) (填序号), 。 30. (6分) (1)____________ mol/L (2)____________ mol (3)_____________。 参考答案 一、选择题(共25小题,每小题只有一个正确选项,每小题2分,共50分) 题号 1 2 3 4 5 6 7 8 9 10 答案 C A C A B D C C D A 题号 11 12 13 14 15 16 17 18 19 20 答案 A A B C D D A B B D 题号 21 22 23 24 25 答案 B B D B C 二、填空题(本题包括5小题,共50分) 26、 (每空2分,共14分) (1)199F (2)SO2 + 2NaOH== Na2SO3 + H2O 2Cl2 + 2Ca(OH)2== CaCl2 + Ca(ClO)2 + 2H2O (2) ①④ ③⑤⑧ ②⑥⑦(多选全错,少选1个扣1分) NaHSO4== Na+ + H+ + SO42— 27、(12分,除特别注明的每空2分) (1) 17g (2)3.1mol/L 5.4mL (3)1 K2Cr2O7 + 14HCl == 2 KCl + 2 CrCl3 + 3 Cl2↑+ 7 H2 K2Cr2O7>Cl2(共1分), 1.204×1024或2NA,(1分) 1:6 28、(每空2分,共10分) (1)BE(多选全错,少选1个扣1分) (2)Ⅰ. 冷凝管、温度计 Ⅱ. ①取少量滤液于试管中,加入HNO3酸化的AgNO3溶液,若产生不溶于酸的黄色沉淀证明有I- ②取少量滤液于试管中,加入新制氯水和CCl4充分振荡,若溶液分层下层呈紫红色证明有I-③ 取少量滤液于试管中,加入新制氯水溶液变为棕黄色,再加入淀粉溶液变蓝证明有I- (其它合理答案也可以),萃取分液 Ⅲ. 2NaI + MnO2 + 2H2SO4 == MnSO4 + I2 + Na2SO4 + 2H2O 29、 (除特别注明的每空2分,共8分) (1)分液漏斗 (2)2NaClO2+Cl2═2ClO2+2NaCl (3)饱和食盐水 (4) ② d (每空1分) 30.(每空2分,共6分)(1)6 (2)0.5 (3)3:2 查看更多