2020届高考化学二轮复习化学反应中能量变化、反应速率和化学平衡课件(216张)
题型
九 化学反应中能量变化、反应速率和化学平衡的综合题
-
2
-
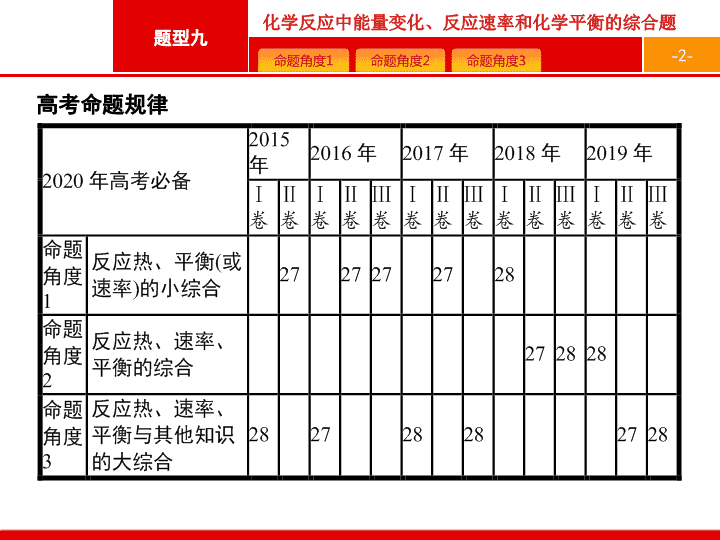
高考命题
规律
-
3
-
高考真题体验
典题演练提能
反应热、平衡
(
或速率
)
的小综合
1
.(2018
全国
Ⅰ
,28)
采用
N
2
O
5
为硝化剂是一种新型的绿色硝化技术
,
在含能材料、医药等工业中得到广泛应用。回答下列问题
:
(1)1840
年
Devil
用干燥的氯气通过干燥的硝酸银
,
得到
N
2
O
5
。该反应的氧化产物是一种气体
,
其分子式为
。
(2)F.Daniels
等曾利用测压法在刚性反应器中研究了
25
℃
时
N
2
O
5
(g)
分解反应
:
其中
NO
2
二聚为
N
2
O
4
的反应可以迅速达到平衡。体系的总压强
p
随时间
t
的变化如下表所示
[
t
=∞
时
,N
2
O
5
(g)
完全分解
]:
-
4
-
高考真题体验
典题演练提能
③
若提高反应温度至
35
℃
,
则
N
2
O
5
(g)
完全分解后体系压强
p
∞
(35
℃
)
63.1 kPa(
填
“
大于
”“
等于
”
或
“
小于
”),
原因是
。
④
25
℃
时
N
2
O
4
(g
) 2NO
2
(g
)
反应的平衡常数
K
p
=
kPa(
K
p
为以分压表示的平衡常数
,
计算结果保留
1
位小数
)
。
-
5
-
高考真题体验
典题演练提能
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是
(
填标号
)
。
A.
v
(
第一步的逆反应
)>
v
(
第二步反应
)
B.
反应的中间产物只有
NO
3
C.
第二步中
NO
2
与
NO
3
的碰撞仅部分有效
D.
第三步反应活化能较高
-
6
-
高考真题体验
典题演练提能
答案
:
(1)O
2
(2)
①
53.1
②
30.0
6.0×10
-2
③
大于 温度提高
,
体积不变
,
总压强提高
;NO
2
二聚为放热反应
,
温度提高
,
平衡左移
,
体系物质的量增加
,
总压强提高
④
13.4
(3)AC
解析
:
(1)
干燥的氯气与干燥的
AgNO
3
之间发生氧化还原反应时
,
氯气作氧化剂
,
而
AgNO
3
中
Ag
、
N
元素都处于最高价
,
所以被氧化的只能为氧元素
,
则得到的气体为氧气。
-
7
-
高考真题体验
典题演练提能
-
8
-
高考真题体验
典题演练提能
-
9
-
高考真题体验
典题演练提能
2
.(2017
全国
Ⅱ
,27)
丁烯是一种重要的化工原料
,
可由丁烷催化脱氢制备。回答下列问题
:
反应
①
的
Δ
H
1
为
kJ·mol
-1
。图
(a)
是反应
①
平衡转化率与反应温度及压强的关系图
,
x
0.1(
填
“
大于
”
或
“
小于
”);
欲使丁烯的平衡产率提高
,
应采取的措施是
(
填标号
)
。
A.
升高温度
B.
降低温度
C.
增大压强
D.
降低压强
-
10
-
高考真题体验
典题演练提能
(2)
丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器
(
氢气的作用是活化催化剂
),
出口气中含有丁烯、丁烷、氢气等。图
(b)
为丁烯产率与进料气中
n
(
氢气
)/
n
(
丁烷
)
的关系。图中曲线呈现先升高后降低的变化趋势
,
其降低的原因是
。
-
11
-
高考真题体验
典题演练提能
(3)
图
(c)
为反应产率和反应温度的关系曲线
,
副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在
590
℃
之前随温度升高而增大的原因可能是
、
;590
℃
之后
,
丁烯产率快速降低的主要原因可能是
。
答案
:
(1)+123
小于
AD
(2)
原料中过量
H
2
会使反应
①
平衡逆向移动
,
所以丁烯转化率下降
(3)590
℃
前升高温度
,
反应
①
平衡正向移动 升高温度时
,
反应速率加快
,
单位时间产生丁烯更多 更高温度导致
C
4
H
10
裂解生成更多的短碳链烃
,
故丁烯产率快速降低
-
12
-
高考真题体验
典题演练提能
解析
:
(1)
根据盖斯定律
,
②
式
-
③
式可得
①
式
,
因此
Δ
H
1
=Δ
H
2
-Δ
H
3
=-119
kJ·mol
-1
+242
kJ·mol
-1
=+123
kJ·mol
-1
。由图
(a)
可以看出
,
温度相同时
,
由
0.1
MPa
变化到
x
MPa,
丁烷的转化率增大
,
即平衡正向移动
,
由于反应
①
是气体物质的量增大的反应
,
压强越小平衡转化率越大
,
所以
x
的压强更小
,
x
<0.1
。由于反应
①
为吸热反应
,
所以温度升高时
,
平衡正向移动
,
丁烯的平衡产率增大
,
因此
A
正确
,B
错误。由于反应
①
是气体物质的量增大的反应
,
加压时平衡逆向移动
,
丁烯的平衡产率减小
,
因此
C
错误
,D
正确
。
(3)590
℃
之前
,
随温度升高
,
反应速率增大
,
反应
①
是吸热反应
,
升高温度平衡正向移动
,
生成的丁烯会更多。温度超过
590
℃
,
更多的丁烷裂解生成短链烃类
,
导致丁烯产率快速降低。
-
13
-
高考真题体验
典题演练提能
3
.(2016
全国
Ⅱ
,27)
丙烯腈
(CH
2
=CHCN)
是一种重要的化工原料
,
工业上可用
“
丙烯氨氧化法
”
生产
,
主要副产物有丙烯醛
(CH
2
=CHCHO)
和乙腈
(CH
3
CN)
等。回答下列问题
:
(1)
以丙烯、氨、氧气为原料
,
在催化剂存在下生成丙烯腈
(C
3
H
3
N)
和副产物丙烯醛
(C
3
H
4
O)
的热化学方程式如下
:
两个反应在热力学上趋势均很大
,
其原因是
;
有利于提高丙烯腈平衡产率的反应条件是
;
提高丙烯腈反应选择性的关键因素是
。
-
14
-
高考真题体验
典题演练提能
(2)
图
(a)
为丙烯腈产率与反应温度的关系曲线
,
最高产率对应的温度为
460
℃
。低于
460
℃
时
,
丙烯腈的产率
(
填
“
是
”
或
“
不是
”)
对应温度下的平衡产率
,
判断理由
是
;
高于
460
℃
时
,
丙烯腈产率降低的可能原因是
(
双选
,
填标号
)
。
A.
催化剂活性降低
B.
平衡常数变大
C.
副反应增多
D.
反应活化能增大
图
(a
)
图
(b)
-
15
-
高考真题体验
典题演练提能
(3)
丙烯腈和丙烯醛的产率与
n
(
氨
)
/n
(
丙烯
)
的关系如图
(b)
所示。由图可知
,
最佳
n
(
氨
)/n(
丙烯
)
约为
,
理由是
。进料气氨、空气、丙烯的理论体积比约为
。
答案
:
(1)
两个反应均为放热量大的反应 降低温度、降低压强 催化剂
(2)
不是 该反应为放热反应
,
平衡产率应随温度升高而降低
AC
(3)1.0
该比例下丙烯腈产率最高
,
而副产物丙烯醛产率最低
1
∶
7.5
∶
1
解析
:
(1)
从反应的焓变可看出这两个反应都为放热反应
,
且
“1
mol
反应
”
放出的热量大
,
故两个反应在热力学上的趋势很大。由于生成丙烯腈的反应为气体体积增大的放热反应
,
故要提高丙烯腈的产率可采取的措施为降温、降压。提高丙烯腈反应选择性的关键因素是使用合适的催化剂。
-
16
-
高考真题体验
典题演练提能
(
2)
图
(a)
中
,
低于
460
℃
时的曲线不表示丙烯腈的产率
,
因为合成丙烯腈的反应为放热反应
,
温度降低时
,
丙烯腈的产率应增大
,
而非减小。高于
460
℃
时
,
丙烯腈产率降低的原因分析
:
催化剂活性降低
,
合成丙烯腈的反应速率减小
,
而副反应可能更多地发生
,A
项符合题意
;
平衡常数增大
,
丙烯腈的产率增大
,B
项不符合题意
;
副反应增多
,
可能导致丙烯腈产率降低
,C
项符合题意
;
反应活化能增大
,
并不影响平衡的移动
,
不会导致丙烯腈的产率变化
,D
项不符合题意。
(3)
由图
(b)
可知
,
当
n
(
氨
)/
n
(
丙烯
)
在
1.0
左右时丙烯腈的产率达最大值
,
而副产物丙烯醛的产率达最小值。由反应
①
知
,
V
(NH
3
)
∶
V
(O
2
)
∶
V
(C
3
H
6
)=2
∶
3
∶
2,
而
V
(O
2
)
∶
V
(
空气
)≈1
∶
5,
则进料气的理论体积比约为
V
(NH
3
)
∶
V
(
空气
)
∶
V
(C
3
H
6
)=2
∶
15
∶
2,
即
1
∶
7.5
∶
1
。
-
17
-
高考真题体验
典题演练提能
4
.(2016
全国
Ⅲ
,27)
煤燃烧排放的烟气含有
SO
2
和
NO
x
,
形成酸雨、污染大气
,
采用
NaClO
2
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题
:
(1)NaClO
2
的化学名称为
。
(2)
在鼓泡反应器中通入含有
SO
2
和
NO
的烟气
,
反应温度
323 K,NaClO
2
溶液浓度为
5×10
-3
mol·L
-1
。反应一段时间后溶液中离子浓度的分析结果如下表
。
-
18
-
高考真题体验
典题演练提能
①
写出
NaClO
2
溶液脱硝过程中主要反应的离子方程式
。增加压强
,NO
的转化率
(
填
“
提高
”“
不变
”
或
“
降低
”)
。
②
随着吸收反应的进行
,
吸收剂溶液的
pH
逐渐
(
填
“
增大
”“
不变
”
或
“
减小
”)
。
③
由实验结果可知
,
脱硫反应速率
脱硝反应速率
(
填
“
大于
”
或
“
小于
”)
。原因是除了
SO
2
和
NO
在烟气中的初始浓度不同
,
还可能是
。
-
19
-
高考真题体验
典题演练提能
(3)
在不同温度下
,NaClO
2
溶液脱硫、脱硝的反应中
SO
2
和
NO
的平衡分压
p
c
如图所示。
①
由图分析可知
,
反应温度升高
,
脱硫、脱硝反应的平衡常数均
(
填
“
增大
”“
不变
”
或
“
减小
”)
。
-
20
-
高考真题体验
典题演练提能
(4)
如果采用
NaClO
、
Ca(ClO)
2
替代
NaClO
2
,
也能得到较好的烟气脱硫效果。
①
从化学平衡原理分析
,Ca(ClO)
2
相比
NaClO
具有的优点是
。
②
已知下列反应
:
-
21
-
高考真题体验
典题演练提能
-
22
-
高考真题体验
典题演练提能
-
23
-
高考真题体验
典题演练提能
-
24
-
高考真题体验
典题演练提能
5
.(2015
全国
Ⅱ
,27)
甲醇既是重要的化工原料
,
又可作为燃料。利用合成气
(
主要成分为
CO
、
CO
2
和
H
2
)
在催化剂作用下合成甲醇
,
发生的主要反应如下
:
回答下列问题
:
(1)
已知反应
①
中相关的化学键键能数据如下
:
由此计算
Δ
H
1
=
kJ·mol
-1
;
已知
Δ
H
2
=-58 kJ·mol
-1
,
则
Δ
H
3
=
kJ·mol
-1
。
-
25
-
高考真题体验
典题演练提能
(2)
反应
①
的化学平衡常数
K
表达式为
;
图
1
中能正确反映平衡常数
K
随温度变化关系的曲线为
(
填曲线标记字母
),
其判断理由是
。
图
1
-
26
-
高考真题体验
典题演练提能
(3)
合成气
组成
=
2.60
时
,
体系中的
CO
平衡转化率
(
α
)
与温度和压强的关系如图
2
所示
,
α
(CO)
值随温度升高而
(
填
“
增大
”
或
“
减小
”),
其原因是
;
图
2
中的压强由大到小为
,
其判断理由是
。
图
2
-
27
-
高考真题体验
典题演练提能
答案
:
(1)-99
+41
a
反应
①
为放热反应
,
平衡常数数值应随温度升高变小
(3)
减小 升高温度时
,
反应
①
为放热反应
,
平衡向左移动
,
使得体系中
CO
的量增大
;
反应
③
为吸热反应
,
平衡向右移动
,
又使产生
CO
的量增大
;
总结果
,
随温度升高
,
使
CO
的转化率降低
p
3
>p
2
>p
1
相同温度下
,
由于反应
①
为气体分子数减小的反应
,
加压有利于提升
CO
的转化率
;
而反应
③
为气体分子数不变的反应
,
产生
CO
的量不受压强影响。故增大压强时
,
有利于
CO
的转化率升高
-
28
-
高考真题体验
典题演练提能
解析
:
(1)
由反应
①
Δ
H
1
=
∑
(
反应物键能
)-
∑
(
产物键能
)
代入求得
Δ
H
1
=(1
076+2×436-3×413-343-465)
kJ·mol
-1
=-99
kJ·mol
-1
。
由盖斯定律
,Δ
H
3
=Δ
H
2
-Δ
H
1
=-58
kJ·mol
-1
+99
kJ·mol
-1
=+41
kJ·mol
-1
。
因
反应
①
为放热反应
,
所以平衡常数应随温度升高而变小
,
所以选
a
。
(3)
升高温度
,
反应
①
平衡向左移动
,
使体系中
n
(CO)
增大
;
反应
③
为吸热反应
,
平衡向右移动
,
又使产生
n
(CO)
增大
;
总结果是随温度升高
,CO
的转化率降低。
因为相同温度下
,
由于反应
①
为气体分子数减小的反应
,
加压有利于增大
CO
的转化率
;
反应
③
为气体分子数不变的反应
,
压强改变对平衡不产生影响。所以压强增大
,CO
转化率升高
,
在图
2
中
,
同一温度下
,CO
转化率高的对应压强大
,
则
p
3
>p
2
>p
1
。
-
29
-
高考真题体验
典题演练提能
1
.(2019
湖北黄冈质量检测
)
近年来环境问题突出
,
大气污染更为严重。回答下面问题
:
(1)
下列选项中属于重点城市空气质量日报主要污染物的是
。
A.CO
2
B.SO
2
C.
可吸入颗粒物
D.H
2
S
(2)
汽车尾气常含有
CO
、
NO
等有毒气体
,
汽车气缸中生成
NO
的化学方程式是
。
-
30
-
高考真题体验
典题演练提能
(3)
汽车排气管安装三元催化装置
,
可以消除
CO
、
NO
的污染
,
反应机理如下
(
以
Pt
催化剂为例
):
-
31
-
高考真题体验
典题演练提能
尾气中反应物及生成物浓度随温度的变化关系如下图
。
反应物浓度
(ppm)
随温度的变化
关系
反应物浓度
(ppm)
随温度的变化
关系
[EXP]:
指数
曲线
-
32
-
高考真题体验
典题演练提能
回答下面问题
:
①
消除汽车尾气污染反应最适宜的温度是
。
A.250
℃
B.300
℃
C.330
℃
D.400
℃
②
330
℃
以下的低温区发生的主要反应的化学方程式是
。
③
低温区
N
2
O
选择性高于
N
2
,
由此可推断出
:
Ⅴ
反应的活化能
Ⅵ
反应的活化能
(
填
“<”“>”
或
“=”),
理由是
。
④
结合反应机理和图像分析
,
温度位于
330~400
℃
时
,
升高温度
,
反应
Ⅴ
的反应速率
(
填
“
增大
”“
减小
”
或
“
不变
”,
下同
),
反应
Ⅳ
的反应速率
。
-
33
-
高考真题体验
典题演练提能
③
>
反应的活化能小
,
化学反应速率大
,
选择性高
④
增大 增大
-
34
-
高考真题体验
典题演练提能
解析
:
(1)
属于重点城市空气质量日报主要污染物的有硫的氧化物、氮的氧化物、可吸入颗粒物
。
④
不管是哪一种化学反应
,
升高温度化学反应速率均增大。
-
35
-
高考真题体验
典题演练提能
2
.(2019
湖北四地七校联盟
2
月联考
)
氢气作为清洁能源有着广泛的应用前景
,
利用含硫天然气制备氢气的流程如下
:
请回答下列问题
:
Ⅰ
.
转化脱硫
:
将天然气压入吸收塔
,30
℃
时
,
在
T.F
菌作用下
,
酸性环境中脱硫过程示意图如下。
-
36
-
高考真题体验
典题演练提能
(1)
过程
ⅰ
的离子反应方程式为
。
(2)
已知
:
①
Fe
3+
在
pH=1.9
时开始沉淀
,pH=3.2
时沉淀完全。
②
30
℃
时
,
在
T.F
菌作用下
,
不同
pH
的
FeSO
4
溶液中
Fe
2+
的氧化速率如下表
:
在转化脱硫中
,
最佳
pH
范围是
”“<”
或
“=”)
。
③
在一定温度和一定压强下的体积可变的密闭容器中充入
1 mol CH
4
和
1 mol
的水蒸气
,
充分反应达平衡后
,
测得起始时混合气的密度是平衡时混合气密度的
1.4
倍
,
若此时容器的体积为
2 L,
则该反应的平衡常数为
(
结果保留
2
位有效数字
)
。
Ⅲ
.CO
变换
:500
℃
时
,CO
进一步与水反应生成
CO
2
和
H
2
。
Ⅳ
.H
2
提纯
:
将
CO
2
和
H
2
分离得到
H
2
的过程如下图所示
。
(4)
吸收池中发生反应的离子方程式是
。
-
39
-
高考真题体验
典题演练提能
-
40
-
高考真题体验
典题演练提能
解析
:
(1)
由图可知
,
过程中
H
2
S
与
Fe
2
(SO
4
)
3
溶液反应生成
FeSO
4
和
S,
根据电子得失守恒
,
过程
ⅰ
的离子反应方程式为
H
2
S+2Fe
3
+
===
2Fe
2
+
+S↓+2H
+
。
(2)
由已知
①
可知
,Fe
3+
在
pH=1.9
时开始沉淀
,
故
pH
应小于
1.9;
由已知
②
可知
,pH
在
1.5
的时候的氧化速率较大
,
故
pH
的取值范围是
1.5”“=”
或
“<”)
T
2
。当温度为
T
1
、
起始
压强为
p
0
时
,
反应至
t
1
min
时
,
体系
压强
p
=
(
用
p
0
表示
)
。
-
56
-
高考真题体验
典题演练提能
(2)1 112.5
(3)
①
1.0×10
-3
②
20.0%
③
>
1.25
p
0
(4)AC
-
57
-
高考真题体验
典题演练提能
-
58
-
高考真题体验
典题演练提能
(4)
温度升高
,
化学反应速率增大
,
因
v
=
k
·
c
(N
2
O)·[
c
(I
2
)]
0.5
,
则温度升高
,
k
值增大
,
故
A
正确
;
化学反应速率由反应最慢的反应决定
,
则第二步对总反应速率起决定作用
,
故
B
错误
;
第二步反应为慢反应
,
第三步反应为快反应
,
所以第二步活化能比第三步大
,
故
C
正确
;
含碘时
NO
分解速率方程
v=k
·
c
(N
2
O)·[
c
(I
2
)]
0.5
,
所以
N
2
O
分解速率与
I
2
的浓度有关
,
故
D
错误。
-
59
-
高考真题体验
典题演练提能
6
.(2019
重庆巴蜀中学高三三诊考试
)
乙二醛
(OHC—CHO)
是一种重要的精细化工产品。
(1)
乙醛
(CH
3
CHO)
液相硝酸氧化法
在
Cu(NO
3
)
2
催化下
,
用稀硝酸氧化乙醛制取乙二醛
,
反应的化学方程式为
,
该
法具有原料易得、反应条件温和等优点
,
但也存在比较明显的缺点是
。
乙二醇气相氧化反应
HOCH
2
CH
2
OH(g)+O
2
(g)OHC—CHO(g)+2H
2
O(g)
的
Δ
H
=
kJ· mol
-1
。相同温度下
,
该反应的化学平衡常数
K
=
(
用含
K
1
、
K
2
的代数式表示
)
。
-
60
-
高考真题体验
典题演练提能
②
氢气与氧气反应生成水在热力学上趋势很大
,
其原因是
。
③
当原料气中氧醇比为
1.35
时
,
乙二醛和副产物
CO
2
的产率与反应温度的关系如下图所示。反应温度在
450~495
℃
之间和超过
495
℃
时
,
乙二醛产率降低的主要原因分别是
、
。
④
在恒温恒容下
,
如果从反应物出发建立平衡
,
能说明乙二醇气相氧化反应达到平衡状态的是
(
填选项字母
)
。
A.
体系压强不再变化
B.
氧醇比保持不变
C.
混合气体的密度保持不变
D.
气体平均相对分子质量保持不变
-
61
-
高考真题体验
典题演练提能
-
62
-
高考真题体验
典题演练提能
-
63
-
高考真题体验
典题演练提能
和发生变化的反应
,
因此体系压强不再变化
,
能够说明反应达到平衡状态
,
所以正确
;B
选项
,
根据乙二醇的气相氧化反应
,
当起始时氧醇比为
1
∶
1
时
,
反应过程中氧醇比始终保持不变
,
不能说明乙二醇气相氧化反应达到平衡状态
,
所以错误
;C
选项
,
该反应的气体质量和体积均不变
,
混合气体的密度始终保持不变
,
不能说明乙二醇气相氧化反应达到平衡状态
,
所以错误
;D
选项
,
该反应属于气体化学计量数和发生变化的反应
,
气体平均相对分子质量保持不变
,
说明气体的物质的量不变
,
因此能够说明乙二醇气相氧化反应达到平衡状态
,
所以正确。
-
64
-
高考真题体验
典题演练提能
7
.(2019
陕西二模
)
催化剂作用下甲醇直接脱氢可以得到无水甲醛
,
同时生成氢气。
(1)
已知下列三个热化学方程式
:
则可逆反应甲醇蒸气脱氢制取甲醛的热化学方程式为
。
(2)
关于上述甲醇脱氢反应的下列说法正确的是
。
A.HCHO
和
H
2
的体积分数相等能说明该可逆反应已经达到化学平衡
B.
增大甲醇浓度可提高活化分子百分数
,
增大反应速率
C.
高温高压更有利于提高甲醛的产率
D.
该反应在较高温度下更易自发进行
-
65
-
高考真题体验
典题演练提能
(3)
在
t
℃
时
,
向
2 L
恒容密闭容器中充入
3.0 mol CH
3
OH,
平衡后
H
2
的体积分数是
25%,
则此温度下的化学平衡常数是
;
升温到
t
2
℃
,
K
是
t
1
℃
的
8
倍
,
平衡后
HCHO
的体积分数是
;
若在此容器中
,
t
2
℃
条件下加入三种气体
,
某时刻测得
CH
3
OH
、
HCHO
、
H
2
的物质的量分别是
1 mol
、
1 mol
、
2 mol,
此时是否处于平衡态
(
填
“
是
”
或
“
否
”),
正、逆反应速率的关系是
。
-
66
-
高考真题体验
典题演练提能
(4)
由下面图示分析
,
温度高于
550
℃
甲醛的产率反而下降的原因是
,
化学方程式为
。
反应温度与甲醇
转化率
和
甲醛选择性的
关系
反应温度与甲醇
脱氢
副产物
的分布
关系
-
67
-
高考真题体验
典题演练提能
Δ
H
=+86.80 kJ·mol
-1
(2)D
(3)0.25
40%
否
v
正
>
v
逆
(4)
生成甲醛的反应为吸热反应
,
升高温度平衡正向移动
,
且甲醛的选择性变大
,
甲醛产率升高
;
温度高于
550
℃
,
甲醛产率下降是因为分解
-
68
-
高考真题体验
典题演练提能
-
69
-
高考真题体验
典题演练提能
(2)
起始时生成物物质的量为
0,
反应过程中和平衡状态下
HCHO
和
H
2
的体积分数均相等
,A
项不能说明该可逆反应已经达到化学平衡态
,A
项错误
;
增大反应物浓度
,
单位体积内活化分子数增加
,
但活化分子百分数不变
,
升高温度或加入催化剂能提高活化分子百分数
,B
项错误
;
反应为气体物质的量增大的吸热反应
,
高温低压有利于平衡正向移动
,C
项错误
;
反应为吸热反应
,Δ
H
>0,Δ
S
>0,
根据
Δ
H
-
T
Δ
S
<0
时反应自发进行
,
可知该反应在较高温度下更易自发进行
,D
项正确。
-
70
-
高考真题体验
典题演练提能
(3)
在
t
℃
时
,
向
2
L
恒容密闭容器中充入
3.0
mol
CH
3
OH,
平衡后
H
2
的体积分数是
25%,
设消耗甲醇物质的量为
x
,
-
71
-
高考真题体验
典题演练提能
-
72
-
高考真题体验
典题演练提能
-
73
-
高考真题体验
典题演练提能
反应热、速率、平衡的综合
1
.(2019
全国
Ⅰ
,28)
水煤气变换
[CO(g)+H
2
O(g
) CO
2
(g
)+H
2
(g)]
是重要的化工过程
,
主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题
:
(1)Shibata
曾做过下列实验
:
①
使纯
H
2
缓慢地通过处于
721
℃
下的过量氧化钴
CoO(s),
氧化钴部分被还原为金属钴
Co(s),
平衡后气体中
H
2
的物质的量分数为
0.025 0
。
②
在同一温度下用
CO
还原
CoO(s),
平衡后气体中
CO
的物质的量分数为
0.019 2
。
根据上述实验结果判断
,
还原
CoO(s)
为
Co(s)
的倾向是
CO
H
2
(
填
“
大于
”
或
“
小于
”)
。
-
74
-
高考真题体验
典题演练提能
(2)721
℃
时
,
在密闭容器中将等物质的量的
CO(g)
和
H
2
O(g)
混合
,
采用适当的催化剂进行反应
,
则平衡时体系中
H
2
的物质的量分数为
(
填标号
)
。
A.<0.25 B.0.25
C.0.25~0.50 D.0.50
E.>
0.50
-
75
-
高考真题体验
典题演练提能
(3)
我国学者结合实验与计算机模拟结果
,
研究了在金催化剂表面上水煤气变换的反应历程
,
如图所示
,
其中吸附在金催化剂表面上的物种用
*
标注。
可知水煤气变换的
Δ
H
0(
填
“
大于
”“
等于
”
或
“
小于
”),
该历程中最大能垒
(
活化能
)
E
正
=
eV,
写出该步骤的化学方程式
。
-
76
-
高考真题体验
典题演练提能
(4)Shoichi
研究了
467
℃
、
489
℃
时水煤气变换中
CO
和
H
2
分压随时间变化关系
(
如下图所示
),
催化剂为氧化铁
,
实验初始时体系中
的
-
77
-
高考真题体验
典题演练提能
解析
:
(1)
因平衡后气体
CO
的物质的量分数小于氢气的物质的量分数
,
因此
CO
还原
CoO(s)
为
Co(s)
的能力强于氢气还原
CoO(s)
为
Co(s)
的能力。
-
78
-
高考真题体验
典题演练提能
-
79
-
高考真题体验
典题演练提能
当
x
=0.5
mol
时
,
氢气的物质的量分数为
0.25,
当完全反应时
,
氢气的物质的量分数为
0.5,
因此平衡时氢气的物质的量分数应介于
0.25
和
0.5
之间
,
所以
C
项正确。
(3)
由图示可知
,
最终生成物的相对能量低于反应物的相对能量
,
所以该反应为放热反应
,
即
Δ
H
<0
。由图示可知
,
该历程中最大相对能量差为
2.02
eV,
即最大能垒为
2.02
eV
。由图示给出参加反应的微粒和生成的微粒可知
,
该步骤的化学方程式为
-
80
-
高考真题体验
典题演练提能
-
81
-
高考真题体验
典题演练提能
2
.(2018
全国
Ⅱ
,27)CH
4
-CO
2
催化重整不仅可以得到合成气
(CO
和
H
2
),
还对温室气体的减排具有重要意义。回答下列问题
:
该催化重整反应的
Δ
H
=
kJ·mol
-1
,
有利于提高
CH
4
平衡转化率的条件是
(
填标号
)
。
A.
高温低压
B.
低温
高压
C
.
高温高压
D.
低温低压
某温度下
,
在体积为
2 L
的容器中加入
2 mol CH
4
、
1 mol CO
2
以及催化剂进行重整反应
,
达到平衡时
CO
2
的转化率是
50%,
其平衡常数为
mol
2
·L
-2
。
-
82
-
高考真题体验
典题演练提能
(2)
反应中催化剂活性会因积碳反应而降低
,
同时存在的消碳反应则使积碳量减少
,
相关数据如下表
:
-
83
-
高考真题体验
典题演练提能
①
由上表判断
,
催化剂
X
Y(
填
“
优于
”
或
“
劣于
”),
理由是
。在反应进料气组成、压强及反应时间相同的情况下
,
某催化剂表面的积碳量随温度的变化关系如下图所示
,
升高温度时
,
下列关于积碳反应、消碳反应的平衡常数
(
K
)
和速率
(
v
)
的叙述正确的是
(
填标号
)
。
A.
K
积
、
K
消
均增加
B.
v
积
减小、
v
消
增加
C.
K
积
减小、
K
消
增加
D.
v
消
增加的倍数比
v
积
增加的倍数大
-
84
-
高考真题体验
典题演练提能
②
在一定温度下
,
测得某催化剂上沉积碳的生成速率方程为
v=k
·
p
(CH
4
)·[
p
(CO
2
)]
-0.5
(
k
为速率常数
),
在
p
(CH
4
)
一定时
,
不同
p
(CO
2
)
下积碳量随时间的变化趋势如下图所示
,
则
p
a
(CO
2
)
、
p
b
(CO
2
)
、
p
c
(CO
2
)
从大到小的顺序为
。
-
85
-
高考真题体验
典题演练提能
答案
:
(1)247
A
(2)
①
劣于 相对于催化剂
X,
催化剂
Y
积碳反应的活化能大
,
积碳反应的速率小
;
而消碳反应活化能相对较小
,
消碳反应速率大
AD
②
p
c
(CO
2
)
、
p
b
(CO
2
)
、
p
a
(CO
2
)
解析
:
(1)
将已知热化学方程式依次编号为
①②③
,
根据盖斯定律
,
③
×2-
①
-
②
,
得到
CH
4
-
CO
2
催化重整反应的
Δ
H
=+247
kJ·mol
-1
。由于该反应是正反应气体体积增大的吸热反应
,
所以有利于提高
CH
4
平衡转化率的条件是高温低压
,A
项正确。某温度下
,
在体积为
2
L
的容器中加入
2
mol
CH
4
,1
mol
CO
2
,
达到平衡时
CO
2
的转化率是
50%,
则平衡时各物质的物质的量浓度分别为
c
(CH
4
)=0.75
mol·L
-1
、
c
(CO
2
)=0.25
mol·L
-1
、
c
(CO)=0.5
mol·L
-1
、
c
(H
2
)=0.5
mol·L
-1
,
根据
-
86
-
高考真题体验
典题演练提能
(2)
①
根据表格中活化能数据分析
,
催化剂
X
劣于催化剂
Y
。因为相对于催化剂
X,
催化剂
Y
积碳反应的活化能大
,
积碳反应的速率小
,
而消碳反应活化能相对较小
,
消碳反应速率大。由于积碳反应和消碳反应均为吸热反应
,
所以升高温度平衡正向移动
,
K
积
、
K
消
均增加
;
温度高于
600
℃
时
,
积碳量随温度的升高而下降
,
说明
v
消
增加的倍数比
v
积
增加的倍数大
,A
、
D
两项正确。
②
根据
v
=
k
·
p
(CH
4
)·[
p
(CO
2
)]
-0.5
,
当
p
(CH
4
)
一定时
,
积碳量随
p
(CO
2
)
的增大而减小
,
故
p
c
(CO
2
)>
p
b
(CO
2
)>
p
a
(CO
2
)
。
-
87
-
高考真题体验
典题演练提能
3
.(2018
全国
Ⅲ
,28)
三氯氢硅
(SiHCl
3
)
是制备硅烷、多晶硅的重要原料。回答下列问题
:
(1)SiHCl
3
在常温常压下为易挥发的无色透明液体
,
遇潮气时发烟生成
(HSiO)
2
O
等
,
写出该反应的化学方程式
。
-
88
-
高考真题体验
典题演练提能
(3)
对于反应
2SiHCl
3
(g
)
==
SiH
2
Cl
2
(g
)+SiCl
4
(g),
采用大孔弱碱性阴离子交换树脂催化剂
,
在
323 K
和
343 K
时
SiHCl
3
的转化率随时间变化的结果如图所示
。
①
343 K
时反应的平衡转化率
α
=
%
。
平衡常数
K
343 K
=
(
保留
2
位小数
)
。
②
在
343 K
下
:
要提高
SiHCl
3
转化率
,
可采取的措施是
;
要缩短反应达到平衡的时间
,
可采取的措施有
、
。
-
89
-
高考真题体验
典题演练提能
-
90
-
高考真题体验
典题演练提能
-
91
-
高考真题体验
典题演练提能
-
92
-
高考真题体验
典题演练提能
1
.(2019
河北石家庄教学质量检测
)
甲烷是一种重要的化工原料和清洁能源
,
研究其再生及合理利用有重要意义。
请回答
:
将一定量的
CO
2
(g)
和
H
2
O(g)
充入
10 L
密闭容器中
,
分别在催化剂
M
、
N
的作用下发生上述反应
,CH
4
(g)
的产量
(
n
)
与光照时间
(
t
)
和温度
(
T
)
变化的关系如图
1
所示
。
-
93
-
高考真题体验
典题演练提能
①
若甲烷的燃烧热
(Δ
H
')
为
-890 kJ· mol
-1
,
则水的汽化热
Δ
H
″
=
(
汽化热指
1 mol
液体转化为气体时吸收的热量
)
。
②
T
1
℃
、催化剂
M
作用下
,0~20 h
内该反应速率
v
(H
2
O)=
。
③
根据图
1
判断
,
T
1
T
2
(
填
“>”“<”
或
“=”),
理由为
。催化剂的催化效果
:M
N(
填
“
优于
”
或
“
劣于
”)
。
-
94
-
高考真题体验
典题演练提能
(2)
甲烷可用于制备合成气
:CH
4
(g)+H
2
O(g
) CO(g
)+3H
2
(g)
Δ
H
。将
CH
4
(g)
和
H
2
O(g)
以物质的量之比为
1
∶
3
充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得
CO
的体积分数
(
φ
)
与温度
(
T
)
的关系如图
2
所示。
①
T
0
℃
时
,CO
的体积分数最大的原因为
。
②
若
T
0
℃
时
,
容器内起始压强为
p
0
,CO
的平衡体积分数为
10%,
则反应的平衡常数
K
p
=
(
用平衡分压代替平衡浓度计算
,
分压
=
总压
×
物质的量分数
)
。
-
95
-
高考真题体验
典题演练提能
答案
:
(1)
①
+44 kJ·mol
-1
②
0.006 mol·L
-1
·h
-1
③
>
该反应为吸热反应
,
温度升高
,CH
4
的产量增大 劣于
(2)
①
低于
T
0
℃
时
,
相同时间段内温度越高反应速率越大
,CO
的体积分数越大
;
高于
T
0
℃
时
,
反应达到平衡
;
由于该反应为放热反应
,
平衡后随温度升高平衡逆向移动
,CO
的体积分数减小
-
96
-
高考真题体验
典题演练提能
③
该反应为吸热反应
,
温度升高
,
平衡右移
,CH
4
的产量增大
,
根据图像可知
,
温度为
T
1
条件下
,
平衡时甲烷的物质的量较大
,
则
T
1
>T
2
;
已知温度
T
1
>T
2
,
若不使用催化剂
,
应该在温度
T
1
条件下优先达到平衡状态
,
根据图像可知
,
使用催化剂
N
的曲线优先达到平衡状态
,
说明催化剂的催化效果
:M
劣于
N
。
(2)
①
在温度低于
T
0
℃
时
,
反应未达平衡
,
随温度升高反应速率增大
,
导致
CO
的体积分数增大
;
在温度为
T
0
℃
时
,
反应达到平衡
,
由于该反应为放热反应
,
温度升高使平衡逆向移动
,
故
CO
的体积分数减小。
-
97
-
高考真题体验
典题演练提能
②
CH
4
(g)
和
H
2
O(g)
的物质的量之比为
1
∶
3,
设
CH
4
物质的量为
1
mol,H
2
O
为
3
mol,
平衡时生成的
CO
物质的量为
y
mol,CO
的平衡体积分数为
10%
-
98
-
高考真题体验
典题演练提能
2
.(2019
华中师大第一附中高三期中
)
工业上可通过煤的液化合成甲醇
,
主反应为
CO(g)+2H
2
(g
)
===
CH
3
OH(l
)
Δ
H
=
x
。
(1)
已知常温下
CH
3
OH
、
H
2
和
CO
的燃烧热
Δ
H
分别为
-726.5 kJ·mol
-1
、
-285.5 kJ·mol
-1
、
-283.0 kJ·mol
-1
,
则
x
=
。为提高合成甲醇反应的选择性
,
关键因素是
。
(2)
T
K
下
,
在容积为
1.00 L
的某密闭容器中进行上述反应
(CH
3
OH
为气体
),
相关数据如图。
-
99
-
高考真题体验
典题演练提能
①
该反应
0~10 min
的平均速率
v
(H
2
)=
,M
和
N
点的逆反应速率较大的是
(
填
“
v
逆
(M)”“
v
逆
(N)”
或
“
不能确定
”)
。
②
10 min
时容器内
CO
的体积分数为
。相同条件下
,
若起始投料加倍
,
达平衡时
,CO
的体积分数将
(
填
“
增大
”“
减小
”
或
“
不变
”)
。
-
100
-
高考真题体验
典题演练提能
③
对于气相反应
,
常用某组分
(B)
的平衡压强
(
p
B
)
代替物质的量浓度
(
c
B
)
表示平衡常数
(
以
K
p
表示
),
其中
,
p
B
=
p
总
×B
的体积分数。若在
T
K
下平衡气体总压强为
x
atm,
则该反应的
K
p
=
(
计算表达式
)
。实验测得不同温度下的
ln
K
(
化学平衡常数
K
的自然对数
)
如图
,
请分析
ln
K
随
T
呈现上述变化趋势的原因是
。
-
101
-
高考真题体验
典题演练提能
-
102
-
高考真题体验
典题演练提能
-
103
-
高考真题体验
典题演练提能
①
Δ
H
0(
填
“>”
或
“<”)
。
②
乙容器在
160 min
时
,
v
正
v
逆
(
填
“>”“<”
或
“=”)
。
-
104
-
高考真题体验
典题演练提能
-
105
-
高考真题体验
典题演练提能
答案
:
(1)
①
<
②
>
(2)
①
②
<
解析
:
(1)
①
容器甲和丙中
NO
的初始量相同
,
丙优先达到平衡
,
说明丙的温度较高
;
达到平衡时丙中
NO
的物质的量大于甲
,
说明升高温度平衡逆向移动
,
则该反应的正反应为放热反应
,
即
Δ
H
<0
。
-
106
-
高考真题体验
典题演练提能
-
107
-
高考真题体验
典题演练提能
4
.(2019
云南昆明模拟
)
开发新能源是解决环境污染的重要举措
,
工业上常用
CH
4
与
CO
2
反应制备
H
2
和
CO,
再用
H
2
和
CO
合成甲醇。
-
108
-
高考真题体验
典题演练提能
则
:
①
该反应的
Δ
H
0(
填
“<”“=”
或
“>”)
。
②
压强
p
1
、
p
2
、
p
3
、
p
4
由大到小的关系为
,
压强为
p
4
时
,
在
b
点
:
v
(
正
)
v
(
逆
)(
填
“<”“=”
或
“>”)
。
-
109
-
高考真题体验
典题演练提能
③
对于气相反应
,
用某组分
(B)
的平衡压强
p
(B)
代替物质的量浓度
c
(B)
也可表示平衡常数
(
记作
K
p
),
则该反应的平衡常数的表达式
K
p
=
;
如果
p
4
=0.36 MPa,
求
1 100
℃
时的平衡常数
K
p
=
(
保留
3
位有效数字
,
用平衡分压代替平衡浓度计算
,
分压
=
总压
×
物质的量分数
)
。
-
110
-
高考真题体验
典题演练提能
④
为探究速率与浓度的关系
,
该实验中
,
根据相关实验数据
,
粗略绘制出了
2
条速率
-
浓度关系曲线
:
v
正
~
c
(CH
4
)
和
v
逆
~
c
(CO)
。
则
:a.
与曲线
v
正
~
c
(CH
4
)
相对应的是上图中曲线
(
填
“
甲
”
或
“
乙
”)
。
b.
当降低到某一温度时
,
反应重新达到平衡
,
相应的平衡点分别为
(
填字母
)
。
-
111
-
高考真题体验
典题演练提能
(2)
①
根据图示
,
压强不变时
,
升高温度
,CH
4
的平衡转化率增大
,
说明正反应为吸热反应
,Δ
H
>0
。
②
正反应为气体分子数增大的反应
,
温度不变时
,
降低压强
,
平衡向正反应方向移动
,CH
4
的平衡转化率增大
,
故
p
4
>
p
3
>
p
2
>
p
1
。压强为
p
4
时
,
b
点时反应尚未达到平衡
,
反应正向进行
,
故
v
(
正
)>
v
(
逆
)
。
-
112
-
高考真题体验
典题演练提能
④
a.CH
4
的浓度由
1.0
mol·L
-1
逐渐减小
,
而
CO
的浓度由
0
逐渐增加
,
故与
v
(
正
)~
c
(CH
4
)
相对应的曲线为乙。
b.
降低温度
,
正、逆反应速率均减小
,
平衡向逆反应方向移动
,
则
CH
4
的浓度增大
,
而
CO
的浓度减小
,
故相应的平衡点分别为
B
、
F
。
-
113
-
高考真题体验
典题演练提能
5
.(2019
安徽合肥高三上学期调研
)
氨作为重要的化工原料
,
被大量应用于工业生产。氨在不同催化剂条件下可发生下列两个反应
:
(1)
写出
NO
分解生成
N
2
与
O
2
的热化学方程式
:
。
-
114
-
高考真题体验
典题演练提能
(2)
反应
Ⅰ
在容积固定的密闭容器中进行
,
容器内部分物质的物质的量浓度如下表
:
①
反应从开始到第
2 min
时
,
v
(H
2
O)=
。
②
在第
3 min
时
,
改变的反应条件可能是
(
填选项字母
)
。
A.
使用催化剂
B.
减小压强
C.
升高温度
D.
增加
O
2
的浓度
-
115
-
高考真题体验
典题演练提能
③
该反应达到平衡状态的标志是
(
填选项字母
)
。
A.
在恒温恒容的容器中
,
混合气体的密度不再变化
B.
单位时间内消耗
n
mol NO
的同时消耗
n
mol NH
3
C.
百分含量
w
(NH
3
)=
w
(NO)
D.
反应速率
v
(NH
3
)
∶
v
(O
2
)
∶
v
(NO)
∶
v
(H
2
O)=4
∶
5
∶
4
∶
6
(3)
①
若在容积为
2 L
的密闭容器中充入
8 mol NH
3
(g)
和
6 mol O
2
(g)
发生反应
Ⅱ
。保持其他条件不变
,
在相同时间内测得
c
(N
2
)
与温度的关系如图所示。则
T
1
℃
下
,NH
3
的平衡转化率为
。
②
图中
a
、
c
两点对应的容器内部压强
p
a
p
c
(
填
“>”“<”
或
“=”)
。
-
116
-
高考真题体验
典题演练提能
Δ
H
=-180.8 kJ·mol
-1
(2)
①
0.375 mol·(L·min)
-1
②
C
③
B
(3)
①
60%
②
<
-
117
-
高考真题体验
典题演练提能
(2)
①
反应从开始到第
2
min
时
,
v
(H
2
O
)= =
0.375
mol·(L·min)
-1
;
②
在第
3
min
后到
4
min,
根据数据可知反应按比例向逆反应方向进行
,
因为该反应为气体体积增大的放热反应
,
故使用催化剂不能使平衡移动
,
选项
A
不选
;
减小压强平衡向气体体积增大的正反应方向移动
,
不符合
,
选项
B
不选
;
升高温度平衡向逆反应方向移动
,
选项
C
符合题意
;
增加
O
2
的浓度平衡向正反应方向移动
,
不符合题意
,
选项
D
不选
;
③
恒容条件下
,
气体的总质量不变
,
则混合气体的密度一直不变
,
密度不变不能作为达到平衡状态的标志
,
选项
A
错误
;
单位时间内消耗
n
mol
NO
的同时消耗
n
mol
NH
3
,
符合正逆反应速率相等
,
可作为达到平衡状态的标志
,
选项
B
正确
;
物质的百分含量
w
(NH
3
)=
w
(NO)
不一定是平衡状态
,
所以不能作为达到平衡状态的标志
,
选项
C
错误
;
用
NH
3
、
O
2
、
NO
、
H
2
O
的物质的量浓度变化表示的反应速率的比为
4
∶
5
∶
4
∶
6
的状态
,
不一定是平衡状态
,
所以不能作为达到平衡状态的标志
,
选项
D
错误。
-
118
-
高考真题体验
典题演练提能
-
119
-
高考真题体验
典题演练提能
6
.(2019
广东肇庆第三次统一检测
)
氢能是人们公认的清洁能源
,
作为低碳和零碳能源正在脱颖而出。氢的获得及以氢为原料的工业生产工艺成为科技工作者研究的重要课题。
(1)
工业生产中可利用
H
2
还原
CO
2
制备清洁能源甲醇。
①
已知
CO(g)
和
H
2
(g)
的燃烧热
(Δ
H
)
分别为
-283.0 kJ·mol
-1
、
-285.8 kJ·mol
-1
。
CO
与
H
2
合成甲醇的能量变化如图甲所示
:
甲
乙
-
120
-
高考真题体验
典题演练提能
则用
CO
2
和
H
2
(g)
制备甲醇同时生成液态水的热化学方程式为
。
②
将一定量的
CO
2
和
H
2
充入到某恒容密闭容器中
,
测得在不同催化剂作用下
,
相同时间内
CO
2
的转化率与温度的变化如图乙所示
;
催化效果最好的是催化剂
(
选填
“
Ⅰ
”“
Ⅱ
”
或
“
Ⅲ
”);
该反应在
a
点达到平衡状态
,a
点的转化率比
b
点的高
,
其原因是
。
-
121
-
高考真题体验
典题演练提能
①
该反应的正反应为
反应
(
选填
“
放热
”
或
“
吸热
”)
。
②
900
℃
时
,
从开始到达到平衡时的反应速率
v
(H
2
O)=
,
达到平衡时
c
(H
2
)=
(
保留
2
位小数
)
。
-
122
-
高考真题体验
典题演练提能
(3)
利用废弃
H
2
S
的热分解反应可生产
H
2
:2H
2
S(g
) 2H
2
(g
)+S
2
(g)
。现将
0.20 mol H
2
S(g)
通入到某恒压
(
压强
p
=
a
MPa)
密闭容器中
,
在不同温度下测得
H
2
S
的平衡转化率如图所示。已知
:
对于气相反应
,
用某组分
(B)
的平衡压强
p
(B)
代替物质的量浓度
c
(B)
也可表示平衡常数。温度为
T
4
℃
时
,
该反应的平衡常数
K
p
=
(
用含
a
的代数式表示
)
。
-
123
-
高考真题体验
典题演练提能
②
从图像可知
,
在相同温度、相同时间内
,
催化剂
Ⅰ
作用下的反应速率是最高
,
所以催化剂
Ⅰ
的催化效果是最好的
;
该反应在
a
点达到平衡状态
,a
点的转化率比
b
点的高
,
是由于该反应为放热反应
,
温度升高
,
平衡逆向移动。
-
124
-
高考真题体验
典题演练提能
-
125
-
高考真题体验
典题演练提能
-
126
-
高考真题体验
典题演练提能
反应热、速率、平衡与其他知识的大综合
-
127
-
高考真题体验
典题演练提能
(2)
某温度下
,
等物质的量的碘和环戊烯
( )
在刚性容器内发生反应
③
,
起始总压为
10
5
Pa,
平衡时总压增加了
20%,
环戊烯的转化率为
,
该反应的平衡常数
K
p
=
Pa
。达到平衡后
,
欲增加环戊烯的平衡转化率
,
可采取的措施有
(
填标号
)
。
A.
通入惰性气体
B.
提高温度
C.
增加环戊烯浓度
D.
增加碘浓度
-
128
-
高考真题体验
典题演练提能
(3)
环戊二烯容易发生聚合生成二聚体
,
该反应为可逆反应。不同温度下
,
溶液中环戊二烯浓度与反应时间的关系如图所示
,
下列说法正确的是
(
填标号
)
。
A.
T
1
>T
2
B.a
点的反应速率小于
c
点的反应速率
C.a
点的正反应速率大于
b
点的逆反应速率
D.b
点时二聚体的浓度为
0.45 mol·L
-1
-
129
-
高考真题体验
典题演练提能
(4)
环戊二烯可用于制备二茂铁
[Fe(C
5
H
5
)
2
],
结构简式
为
,
后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如右图所示
,
其中电解液为溶解有溴化钠
(
电解质
)
和环戊二烯的
DMF
溶液
(DMF
为惰性有机溶剂
)
。该
电解池的阳极为
,
总反应为
。电解制备需要在无水条件下进行
,
原因为
。
-
130
-
高考真题体验
典题演练提能
解析
:
(1)
根据盖斯定律
,
将反应
①
和
②
叠加可得反应
③
,
故
Δ
H
3
=Δ
H
1
+Δ
H
2
=100.3
kJ·mol
-1
+(-11.0
kJ·mol
-1
)=89.3
kJ·mol
-1
。
(2)
温度、体积一定
,
压强与物质的量成正比
,
则起始状态碘和环戊烯的分压分别为
5×10
4
Pa,
设环戊烯的转化率为
x
,
根据反应
:
起始
/Pa
5×10
4
5×10
4
0
0
转化
/Pa
5×10
4
x
5×10
4
x
5×10
4
x
1×10
5
x
平衡
/Pa
5×10
4
(1-
x
)
5×10
4
(1-
x
)
5×10
4
x
1×10
5
x
-
131
-
高考真题体验
典题演练提能
根据平衡时总压增加了
20%,
则
5×10
4
(1-
x
)
Pa+5×10
4
(1-
x
)
Pa+5×10
4
x
Pa+1×10
5
x
Pa=1.2×10
5
Pa
解得
x
=0.4,
即环戊烯的转化率为
40%
。平衡时各物质的分压为
p
(
环戊烯
)=3×10
4
Pa,
p
(I
2
)=3×10
4
Pa,
p
(
环戊二烯
)=2×10
4
Pa,
p
(HI)=4×10
4
Pa,
则该反应的
平衡常数
通
入惰性气体
,
不会引起各物质的浓度的变化
,
反应速率不变
,
平衡不移动
,
环戊烯的平衡转化率不变
,A
项不符合题意
;
由于该反应为吸热反应
,
故升高温度使平衡向右移动
,
环戊烯的平衡转化率增大
,B
项符合题意
;
增加一种物质的量
,
自身的转化率减少
,
而另一种反应物的转化率增大
,
增加环戊烯浓度
,
环戊烯的平衡转化率减小
,
增加碘浓度
,
环戊烯的平衡转化率增大
,C
项不符合题意
,D
项符合题意。
-
132
-
高考真题体验
典题演练提能
(3)
根据曲线的变化趋势可知
,
T
2
温度下首先达到平衡
,
反应速率大
,
因此
T
2
大于
T
1
,A
项错误
;a
点、
c
点对应的反应物的浓度、温度都不同
,
无法比较
a
、
c
两点的反应速率的大小
,B
项错误
;a
点的正反应速率大于
b
点的正反应速率
,
而
b
点还没有达到平衡
,
因此
b
点的正反应速率大于其逆反应速率
,
则
a
点的正反应速率大于
b
点的逆反应速率
,C
项正确
;
根据曲线可知
,
环戊二烯的初始浓度为
1.5
mol·L
-1
,b
点环戊二烯的浓度为
0.6
mol·L
-1
,
环戊二烯的浓度变化量为
0.9
mol·L
-1
,
因此
b
点二聚体的浓度为
0.45
mol·L
-1
,D
项正确。
(4)
根据
Fe
的化合价升高为
+2
价可知
,Fe
发生氧化反应
,
故
Fe
作阳极
;
根据二茂铁的分子式可知
,
两个环戊二烯去掉
2
个
H
原子
,
再结
-
133
-
高考真题体验
典题演练提能
2
.(2019
全国
Ⅲ
,28)
近年来
,
随着聚酯工业的快速发展
,
氯气的需求量和氯化氢的产出量也随之迅速增长。因此
,
将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题
:
2Cl
2
(g)+2H
2
O(g)
。下图为刚性容器中
,
进料浓度比
c
(HCl)
∶
c
(O
2
)
分别等于
1
∶
1
、
4
∶
1
、
7
∶
1
时
HCl
平衡转化率随温度变化的关系
:
可知反应平衡常数
K
(300
℃
)
K
(400
℃
)(
填
“
大于
”
或
“
小于
”)
。设
HCl
初始浓度为
c
0
,
根据进料浓度比
c
(HCl)
∶
c
(O
2
)=1
∶
1
的数据计算
K
(400
℃
)=
(
列出计算式
)
。按化学计量比进料可以保持反应物高转化率
,
同时降低产物分离的能耗。进料浓度比
c
(HCl)
∶
c
(O
2
)
过低、过高的不利影响分别是
。
-
134
-
高考真题体验
典题演练提能
-
135
-
高考真题体验
典题演练提能
(3)
在一定温度的条件下
,
进一步提高
HCl
的转化率的方法是
。
(
写出
2
种
)
(
4)
在传统的电解氯化氢回收氯气技术的基础上
,
科学家最近采用碳基电极材料设计了一种新的工艺方案
,
主要包括电化学过程和化学过程
,
如右图所示
:
负极区发生的反应有
(
写反应方程式
)
。电路中转移
1 mol
电子
,
需消耗氧气
L(
标准状况
)
。
-
136
-
高考真题体验
典题演练提能
解析
:
本题为热化学、电化学与化学平衡的综合题
,
难度中等。
(1)
分析任意一条平衡曲线可知
,
在进料浓度比固定的条件下
,
随着温度的升高
,HCl
的平衡转化率降低
,
说明正反应为放热反应
,
由于
K
只与温度有关
,
升高温度
,
平衡逆向移动
,
平衡常数
K
减小
,
即
K
(300
℃
)
大于
K
(400
℃
)
。
-
137
-
高考真题体验
典题演练提能
根据进料浓度比及
HCl
的平衡转化率间的关系可知
,
c
(HCl)
∶
c
(O
2
)=1
∶
1
的曲线为最上面的那条曲线
,
由该曲线可知
:
温度为
400
℃
时
HCl
的平衡转化率为
84%
。
根据条件可列三段式如下
:
-
138
-
高考真题体验
典题演练提能
进料浓度比
c
(HCl)
∶
c
(O
2
)
过低
,
导致产品
Cl
2
混有大量
O
2
,
则分离两气体时导致能耗较高。而进料浓度比
c
(HCl)
∶
c
(O
2
)
过高
,
则导致
HCl
的转化率过低
,
浪费原料
。
(3)
在温度一定时
,
要增大
HCl
的平衡转化率
,
可采取的措施有
:
及时移走部分产物、增大体系压强等。
-
139
-
高考真题体验
典题演练提能
3
.(2019
北京理综
,27)
氢能源是最具有应用前景的能源之一
,
高纯氢的制备是目前的研究热点。
(1)
甲烷水蒸气催化重整是制高纯氢的方法之一。
①
反应器中初始反应的生成物为
H
2
和
CO
2
,
其物质的量之比为
4
∶
1,
甲烷和水蒸气反应的方程式是
。
②
已知反应器中还存在如下反应
:
……
ⅲ
为积碳反应
,
利用
Δ
H
1
和
Δ
H
2
计算
Δ
H
3
时
,
还需要利用
反应的
Δ
H
。
-
140
-
高考真题体验
典题演练提能
③
反应物投料比采用
n
(H
2
O)
∶
n
(CH
4
)=4
∶
1,
大于初始反应的化学计量数之比
,
目的是
(
选填字母序号
)
。
a.
促进
CH
4
转化
b.
促进
CO
转化为
CO
2
c.
减少积碳生成
④
用
CaO
可以去除
CO
2
。
H
2
体积
分数和
CaO
消耗率随时间变化关系如下图所示。
从
t
1
时开始
,H
2
体积分数显著降低
,
单位时间
CaO
消耗率
(
填
“
升高
”“
降低
”
或
“
不变
”)
。此时
CaO
消耗率约为
35%,
但已失效
,
结合化学方程式解释原因
:
。
-
141
-
高考真题体验
典题演练提能
(2)
可利用太阳能光伏电池电解水制高纯氢
,
工作示意图如下。通过控制开关连接
K
1
或
K
2
,
可交替得到
H
2
和
O
2
。
①
制
H
2
时
,
连接
。
产生
H
2
的电极方程式是
。
②
改变开关连接方式
,
可得
O
2
。
③
结合
①
和
②
中电极
3
的电极反应式
,
说明电极
3
的作用
:
。
-
142
-
高考真题体验
典题演练提能
-
143
-
高考真题体验
典题演练提能
-
144
-
高考真题体验
典题演练提能
4
.(2017
全国
Ⅰ
,28)
近期发现
,H
2
S
是继
NO
、
CO
之后的第三个生命体系气体信号分子
,
它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题
:
(1)
下列事实中
,
不能比较氢硫酸与亚硫酸的酸性强弱的是
(
填标号
)
。
A.
氢硫酸不能与碳酸氢钠溶液反应
,
而亚硫酸可以
B.
氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L
-1
的氢硫酸和亚硫酸的
pH
分别为
4.5
和
2.1
D.
氢硫酸的还原性强于亚硫酸
-
145
-
高考真题体验
典题演练提能
(2)
下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理
。
通过计算
,
可知系统
(
Ⅰ
)
和系统
(
Ⅱ
)
制氢的热化学方程式分别为
、
,
制得等量
H
2
所需能量较少的是
。
-
146
-
高考真题体验
典题演练提能
(3)H
2
S
与
CO
2
在高温下发生反应
:H
2
S(g)+CO
2
(g
) COS(g
)+H
2
O(g)
。在
610 K
时
,
将
0.10 mol CO
2
与
0.40 mol H
2
S
充入
2.5 L
的空钢瓶中
,
反应平衡后水的物质的量分数为
0.02
。
①
H
2
S
的平衡转化率
α
1
=
%,
反应平衡常数
K
=
。
②
在
620 K
重复实验
,
平衡后水的物质的量分数为
0.03,H
2
S
的转化率
α
2
α
1
,
该反应的
Δ
H
0(
填
“>”“<”
或
“=”)
。
③
向反应器中再分别充入下列气体
,
能使
H
2
S
转化率增大的是
(
填标号
)
。
A.H
2
S B.CO
2
C.COS D.N
2
-
147
-
高考真题体验
典题演练提能
解析
:
(1)
酸性强弱与酸的电离程度有关。
A
项利用强酸制弱酸反应原理
,
可知
H
2
SO
3
的酸性强于
H
2
CO
3
,
而
H
2
CO
3
的酸性强于
H
2
S,A
项可以比较氢硫酸和亚硫酸的酸性强弱
;
由
B
项可知同浓度的
H
2
SO
3
的电离程度大于
H
2
S
的
,B
项可以比较氢硫酸和亚硫酸的酸性强弱
;
由
C
项可知同浓度的亚硫酸和氢硫酸中
,
前者的
c
(H
+
)
大于后者的
c
(H
+
),C
项可以比较氢硫酸和亚硫酸的酸性强弱
;
而酸性强弱与酸的还原性无关
,
故
D
项不可以比较氢硫酸和亚硫酸的酸性强弱。
-
148
-
高考真题体验
典题演练提能
(2)
热化学方程式的书写应注意标明各物质的聚集状态和
Δ
H
的单位。将题中热化学方程式依次编号为
①②③④
,
依据盖斯定律
,
①
+
②
+
③
可得
:
由两个热化学方程式比较可知
,
制得等量
H
2
系统
(
Ⅱ
)
所需热量较少。
-
149
-
高考真题体验
典题演练提能
-
150
-
高考真题体验
典题演练提能
②
升高温度
,
平衡后水的物质的量分数增大
,
即平衡正向移动
,
则
H
2
S
的转化率增大。升高温度
,
平衡向吸热反应方向移动
,
则正反应为吸热反应
,Δ
H
>0
。
③
增大反应物中一种物质的百分含量
,
其自身的转化率降低
,
而另外一种反应物的转化率增大
,
因此选
B
。加入
COS
时
,
平衡逆向移动
,H
2
S
的转化率减小
;
加入
N
2
,
平衡不移动
,H
2
S
的转化率不变。
-
151
-
高考真题体验
典题演练提能
5
.(2017
全国
Ⅲ
,28)
砷
(As)
是第四周期
ⅤA
族元素
,
可以形成
As
2
S
3
、
As
2
O
5
、
H
3
AsO
3
、
H
3
AsO
4
等化合物
,
有着广泛的用途。回答下列问题
:
(1)
画出砷的原子结构示意图
。
(2)
工业上常将含砷废渣
(
主要成分为
As
2
S
3
)
制成浆状
,
通入
O
2
氧化
,
生成
H
3
AsO
4
和单质硫。写出发生反应的化学方程式
。该反应需要在加压下进行
,
原因是
。
-
152
-
高考真题体验
典题演练提能
-
153
-
高考真题体验
典题演练提能
①
下列可判断反应达到平衡的是
(
填标号
)
。
a.
溶液的
pH
不再变化
d.
c
(I
-
)=
y
mol·L
-1
②
t
m
时
,
v
正
v
逆
(
填
“
大于
”“
小于
”
或
“
等于
”)
。
③
t
m
时
v
逆
t
n
时
v
逆
(
填
“
大于
”“
小于
”
或
“
等于
”),
理由是
。
④
若平衡时溶液的
pH=14,
则该反应的平衡常数
K
为
。
-
154
-
高考真题体验
典题演练提能
-
155
-
高考真题体验
典题演练提能
(2)
由题中信息知
,As
2
S
3
被
O
2
氧化生成
H
3
AsO
4
和
S,
根据
As
、
S
和
O
的得失电子守恒可配平该反应的化学方程式。加压条件下进行反应
,
相当于增加了
O
2
的浓度
,
可以提高反应物
As
2
S
3
的转化速率。
(3)
将题给热化学方程式依次编号为
①②③
,
根据盖斯定律
,
①
×2-
②
×3-
③
可得目标热化学方程式
,
则
Δ
H
=2Δ
H
1
-3Δ
H
2
-Δ
H
3
。
(4)
①
a
项
,
反应中消耗
OH
-
,
若
pH
不变
,
则说明反应已达平衡
,
正确
;b
项
,
反应中
I
-
与
的
计量数之比为
2
∶
1,
所以两者反应速率之比始终为
2
∶
1,
则不能说明反应已达平衡
,
错误
;c
项
,
离子浓度比值不变
,
即说明反应已达平衡
,
正确
;d
项
,
由图知
,
反应达平衡时
,
c
( )=
y
mol·L
-1
,
此时
c
(I
-
)=2
y
mol·L
-1
,
则
c
(I
-
)=
y
mol·L
-1
时
,
不能说明反应达到平衡
,
错误。
-
156
-
高考真题体验
典题演练提能
-
157
-
高考真题体验
典题演练提能
-
158
-
高考真题体验
典题演练提能
-
159
-
高考真题体验
典题演练提能
-
160
-
高考真题体验
典题演练提能
-
161
-
高考真题体验
典题演练提能
-
162
-
高考真题体验
典题演练提能
7
.(2015
全国
Ⅰ
,28)
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题
:
(1)
大量的碘富集在海藻中
,
用水浸取后浓缩
,
再向浓缩液中加
MnO
2
和
H
2
SO
4
,
即可得到
I
2
。该反应的还原产物为
。
-
163
-
高考真题体验
典题演练提能
①
根据上述实验结果
,
该反应的平衡常数
K
的计算式为
。
②
上述反应中
,
正反应速率为
v
正
=
k
正
x
2
(HI),
逆反应速率为
v
逆
=
k
逆
x
(H
2
)
x
(I
2
),
其中
k
正
、
k
逆
为速率常数
,
则
k
逆
为
(
以
K
和
k
正
表示
)
。若
k
正
=0.002 7 min
-1
,
在
t
=40 min
时
,
v
正
=
min
-1
。
-
164
-
高考真题体验
典题演练提能
③
由上述实验数据计算得到
v
正
~
x
(HI)
和
v
逆
~
x
(H
2
)
的关系可用下图表示。当升高到某一温度时
,
反应重新达到平衡
,
相应的点分别为
(
填字母
)
。
-
165
-
高考真题体验
典题演练提能
(3)
由键能求反应热的公式为
Δ
H
=
反应物的键能总和
-
生成物的键能总和
,
则
Δ
H
=2
E
H—I
-436
kJ·mol
-1
-151
kJ·mol
-1
=11
kJ,
则
E
H—I
=299
kJ·mol
-1
。
-
166
-
高考真题体验
典题演练提能
-
167
-
高考真题体验
典题演练提能
1
.(2019
河南开封一模
)
研究氮氧化物的反应机理
,
对于消除其对环境的污染有重要意义。
-
168
-
高考真题体验
典题演练提能
-
169
-
高考真题体验
典题演练提能
(2)
通过如图所示装置
,
可将汽车尾气中的
NO
、
NO
2
转化为重要的化工原料
HNO
3
,
其中
A
、
B
为多孔惰性电极。该装置的负极是
(
填
“A”
或
“B”),B
电极的电极反应式为
。
(3)
实验室可用
NaOH
溶液吸收
NO
2
,
反应为
2NO
2
+2NaOH
===
NaNO
3
+NaNO
2
+H
2
O
。含
0.2 mol NaOH
的水溶液与
0.2 mol NO
2
恰好完全反应得
1 L
溶液甲
;
溶液乙为
0.1 mol·L
-1
的
CH
3
COONa
溶液
,
则两溶液中
c
( )
、
c
( )
和
c
(CH
3
COO
-
)
由大到小的顺序为
(
已知
HNO
2
的电离常数
K
a
=7.1×10
-4
,CH
3
COOH
的电离常数
K
a
=1.7×10
-5
)
。可使溶液甲和溶液乙的
pH
相等的方法是
。
a.
向溶液甲中加适量
水
b
.
向溶液甲中加适量
NaOH
c.
向溶液乙中加适量
水
d
.
向溶液乙中加适量
NaOH
-
170
-
高考真题体验
典题演练提能
-
171
-
高考真题体验
典题演练提能
-
172
-
高考真题体验
典题演练提能
-
173
-
高考真题体验
典题演练提能
2
.(2019
安徽六校教育研究会第二次联考
)
氮的氧化物是严重的大气污染物
,
可以通过以下方法处理
:
Ⅰ
.
催化还原法
:
如在汽车排气管上安装一个催化转化器
,
发生如下反应
:
-
174
-
高考真题体验
典题演练提能
-
175
-
高考真题体验
典题演练提能
①
该反应的平衡常数
K
的计算式为
;
前
10 min
内用氮气表示的反应速率为
。
②
若保持温度不变
,15 min
时再向该容器中充入
1.6 mol NO
、
0.4 mol CO
2
,
则此时反应的
v
正
v
逆
(
填
“>”“=”
或
“<”)
。
③
若保持其他条件不变
,15 min
时压缩容器的体积至
0.5 L,20 min
时反应重新达到平衡
,NO
的浓度对应的点应是图
1
中的
(
填字母
)
。
④
某科研小组研究发现以
Ag-ZSM-5
为催化剂
,NO
转化为
N
2
的转化率随温度变化情况如图
2
所示。若不使用
CO,
温度超过
775 K,
发现
NO
的分解率降低
,
其可能的原因是
。
-
176
-
高考真题体验
典题演练提能
Ⅱ
.
利用电化学原理
,
将
NO
2
、
O
2
和熔融
KNO
3
制成燃料电池
,
其原理如图
3
所示
,
该电池在工作过程中
,NO
2
转变成绿色硝化剂
Y,Y
是一种氧化物
,
可循环使用
,
石墨
Ⅱ
是电池的
极
,
石墨
Ⅰ
附近发生反应的电极反应式为
;
相同条件下
,
消耗的
O
2
和
NO
2
的体积比为
。
-
177
-
高考真题体验
典题演练提能
-
178
-
高考真题体验
典题演练提能
-
179
-
高考真题体验
典题演练提能
③
若保持其条件不变
,15
min
时压缩容器至
0.5
L
时反应重新达到平衡
,
加压平衡正向移动
,
依据可逆反应特点
,
利用极值可知当
CO
全部反应
,
则平衡后一氧化氮浓度为
2
mol·L
-1
,
所以一氧化氮浓度应介于
2
mol·L
-1
和
3.2
mol·L
-1
之间。
-
180
-
高考真题体验
典题演练提能
-
181
-
高考真题体验
典题演练提能
3
.(2019
安徽淮南二模
)
合成氨工业在国民经济中占有举足轻重的地位
,
是化学工业的支柱。
(1)20
年代初
,
化学家哈伯利用氢气和氮气在固体催化剂铁触媒的作用下突破了合成氨工艺
,
反应方程式为
:N
2
(g)+3H
2
(g
) 2NH
3
(g
),
根据表中数据计算
298 K
时该反应
Δ
H
=
。
-
182
-
高考真题体验
典题演练提能
(2)
在一密闭容器内
,
以起始原料比
n
(N
2
)
∶
n
(H
2
)=1
∶
3
投料
,
在不同温度和压强条件下反应
,
达到平衡时产物中氨气的体积分数变化如图所示
:
①
下列说法错误的是
。
A.
图中温度的关系是
T
1
>T
2
>T
3
>T
4
B.
在投料相同的条件下
,X
、
Y
、
Z
三点达到平衡所用的时间
:Y”
或
“<”)
。
-
191
-
高考真题体验
典题演练提能
(3)
①
已知在一定温度下
,
反应
2NH
3
(g)+CO
2
(g
) H
2
NCOONH
4
(s
)
Δ
H
=-159.5 kJ·mol
-1
在
2 L
恒容密闭容器中充入
2 mol NH
3
和
1 mol CO
2
,
到达平衡时放出
127.6 kJ
的热量
,
此时
,
c
(NH
3
)
为
。
②
室温下
,0.1 mol·L
-1
NaHCO
3
溶液的
pH
0.1 mol·L
-1
Na
2
SO
3
溶液的
pH(
填
“>”“<”
或
“=”)
。
已知
:(25
℃
)
③
有一种可充电电池
Na-Al/FeS,
电池工作时
Na
+
的物质的量保持不变
,
并且是用含
Na
+
的导电固体作为电解质
,
已知该电池负极电极反
-
192
-
高考真题体验
典题演练提能
-
193
-
高考真题体验
典题演练提能
②
适当缩小容器的体积
,
由于反应前后气体体积不变
,
平衡时各物质浓度同比例增大
,A
项正确
;
催化剂只改变化学反应速率
,
不影响化学平衡
,B
项错误
;
加入一定量的活性炭
,
碳是固体对平衡无影响
,
平衡不移动
,C
项错误
;
通入一定量的
NO,
达到新平衡状态时各物质平衡浓度均增大
,D
项正确。
③
若
30
min
后升高温度至
t
2
℃
,
达到平衡时
,
容器中
NO
、
N
2
、
CO
2
的浓度之比从原来的约为
4
∶
3
∶
3
变为
5
∶
3
∶
3,
说明平衡向逆反应方向移动
,
达到新平衡时
NO
的转化率降低
,
故逆反应是吸热反应
,
则正反应是放热反应。
-
194
-
高考真题体验
典题演练提能
-
195
-
高考真题体验
典题演练提能
5
.(2019
湖南益阳模拟
)
随着低碳钢等洁净钢技术的发展
,Al
2
O
3
-C
耐火材料和钢水之间的相互作用已成为当前的一个研究重点。
请回答下列问题
:
(1)
日常生活中铝用品比铁器件更耐腐蚀
,
原因是
。
(2)
在埋炭实验条件下
,
不同碳素材料的
Al
2
O
3
-C
耐火材料与钢水之间的可能反应如下
:
-
196
-
高考真题体验
典题演练提能
(3)
实验温度下
,(Al
2
O
3
-C)/Fe
系统中存在着相互反应
,
如
Al
2
O
3
溶入钢水中
,
导致钢水中平衡的铝的百分含量的对数
(lg[Al])
和平衡氧
(O
2
)
的百分含量的对数
(lg[O
2
])
关系如图所示
,
图中温度
T
1
1 973 K(
填
“>”
或
“<”)
。
-
197
-
高考真题体验
典题演练提能
(4)
在埋炭情况下
,
碳过剩时
,
碳的氧化反应主要考虑
:C(s)+CO
2
(g
) 2CO(g
)
。在实验室研究该反应
,
一定温度下
,
向某体积可变的恒压密闭容器
(
总压强为
p
总
)
加入足量的碳和
1 mol CO
2
,
平衡时体系中气体体积分数与温度的关系如图
2
所示
:
图
2
-
198
-
高考真题体验
典题演练提能
①
650
℃
时
,
该反应达到平衡后吸收热量是
,
消耗碳的质量为
。
②
T
℃
时
,
若向平衡体系中再充入一定量
V
(CO
2
)
∶
V
(CO)=5
∶
4
的混合气体
,
平衡
(
填
“
向正反应方向
”“
向逆反应方向
”
或
“
不
”)
移动。
③
925
℃
时
,
用平衡分压代替平衡浓度表示的化学平衡常数
K
p
=
[
用含
p
总
的代数式表示
,
气体分压
(
p
分
)=
气体总压
(
p
总
)×
体积分数
]
。
(5)CO
可用作某熔融盐电池的燃料
,
电解质为
Li
2
CO
3
和
Na
2
CO
3
的熔融盐混合物
,
空气与
CO
2
的混合气为助燃气
,
电池在
650
℃
下工作时
,
负极的电极反应式为
。
-
199
-
高考真题体验
典题演练提能
答案
:
(1)
铝用品表面为一层致密的
Al
2
O
3
薄膜
,
阻止铝的进一步氧化
(2)-681.5
(3)<
(4)
①
43.125 kJ
3.0 g
②
向正反应方向
③
23.04
p
总
-
200
-
高考真题体验
典题演练提能
解析
:
(1)
日常生活中铝用品比铁器件更耐腐蚀
,
主要原因是因为铝制品表面有一层致密的
Al
2
O
3
薄膜
,
可阻止铝的进一步氧化。
(2)
将已知反应式进行编号
,
利用盖斯定律找出目标反应式与已知反应式的关系
:
-
201
-
高考真题体验
典题演练提能
-
202
-
高考真题体验
典题演练提能
-
203
-
高考真题体验
典题演练提能
6
.(2019
陕西宝鸡模拟检测二
)CO
2
和
CO
可作为工业合成甲醇
(CH
3
OH)
的直接碳源
,
还可利用
CO
2
依据电化学原理制备塑料
,
既减少工业生产对乙烯的依赖
,
又达到减少
CO
2
排放的目的。
(1)
利用
CO
2
和
H
2
合成甲醇的反应原理为
:CO
2
(g)+3H
2
(g
) CH
3
OH(g
)+H
2
O(g)
。
上述反应常用
CuO
和
ZnO
的混合物作催化剂
,
相同的温度和时间段内
,
催化剂中
CuO
的质量分数影响
CO
2
的转化率和
CH
3
OH
的产率的实验数据如下表所示
:
由表可知
,CuO
的质量分数为
时催化效果最佳。
-
204
-
高考真题体验
典题演练提能
(2)
利用
CO
和
H
2
在一定条件下可合成甲醇
,
发生如下反应
:CO(g)+2H
2
(g
) CH
3
OH(g
),
该反应在不同条件下的能量变化曲线如下图
a
、
b
所示
,
下列说法正确的是
(
)
A.
上述反应的
Δ
H
=-91 kJ·mol
-1
B.a
反应正反应的活化能为
510 kJ·mol
-1
C.b
过程中第
Ⅰ
阶段为吸热反应
,
第
Ⅱ
阶段为放热反应
D.b
过程使用催化剂后降低了反应的活化能和
Δ
H
E.b
过程的反应速率
:
第
Ⅱ
阶段
>
第
Ⅰ
阶段
-
205
-
高考真题体验
典题演练提能
(3)
①
在
1 L
的恒定密闭容器中按物质的量之比
1
∶
2
充入
CO
和
H
2
,
测得平衡混合物中
CH
3
OH
的体积分数在不同压强下随温度的变化情况如图
1
所示
,
则压强
p
2
p
1
(
填
“>”“<”
或
“=”);
平衡由
A
点移至
C
点、
D
点移至
B
点
,
分别可采取的具体措施为
、
;
在
C
点时
,CO
的转化率为
。
②
甲和乙两个恒容密闭容器的体积相同
,
向甲中加入
1 mol CO
和
2 mol H
2
,
向乙中加入
2 mol CO
和
4 mol H
2
,
测得不同温度下
CO
的平衡转化率如图
2
所示
,
则
L
、
M
两点容器内压强
:
p
(M)
2
p
(L);
平衡常数
:
K
(M)
K
(L)(
填
“>”“<”
或
“=”)
。
-
206
-
高考真题体验
典题演练提能
(4)
以纳米二氧化钛膜为工作电极
,
稀硫酸为电解质溶液
,
在一定条件下通入
CO
2
进行电解
,
在阴极可制得低密度聚乙烯