- 2021-08-24 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版氧化还原反应的概念作业
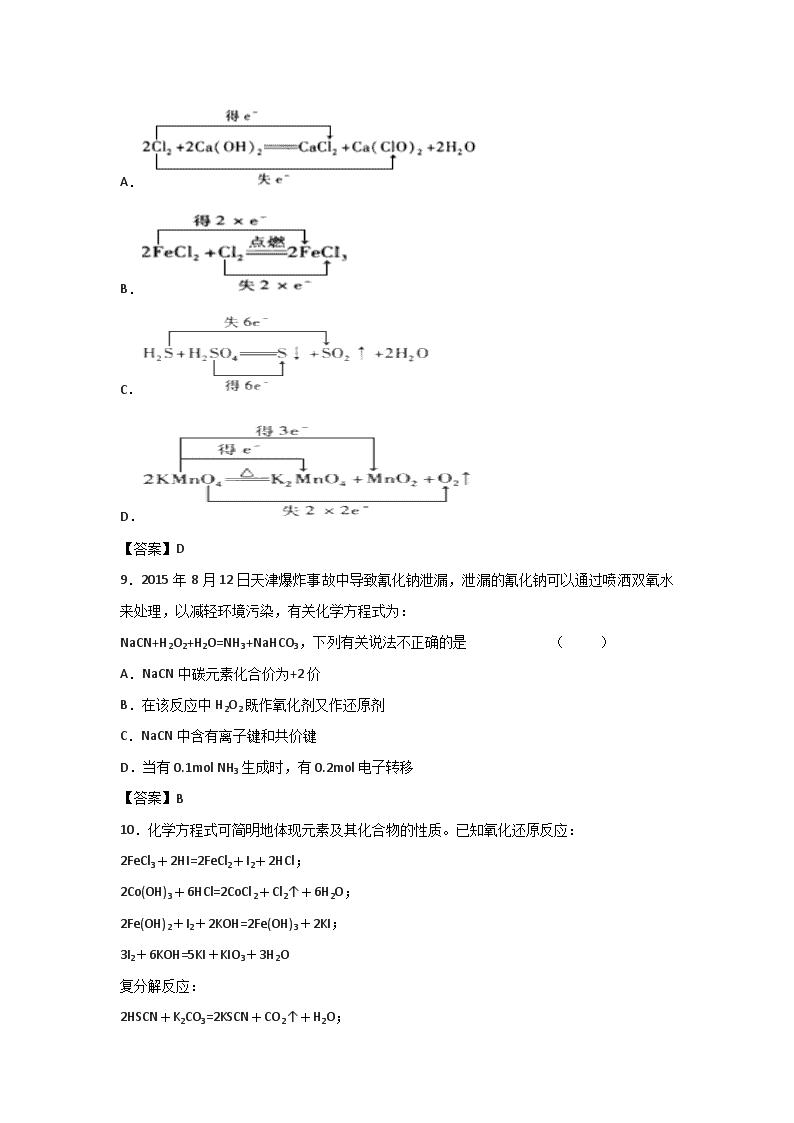
氧化还原反应的概念 一、选择题(本题包括10小题,每小题5分,共50分) 1.下列化工生产过程中,未涉及氧化还原反应的是 ( ) A.侯式制碱法制纯碱 B.海带提碘 C.电解饱和食盐水制烧碱 D.工业上合成氨 【答案】A 2.某同学设计完成了以下两个实验: ①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色(生成了HIO3)。 ②向盛有KBr溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成红棕色。继续向试管中滴加氯水,振荡,CCl4层的颜色没有变化。 下列说法不正确的是 ( ) A.实验①生成HIO3时发生的反应为:I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl B.实验②中当CCl4层变成红棕色时可通过分液的方法获得Br2的CCl4溶液 C.由上述实验得出Cl2、Br2、I2的氧化性由强到弱的顺序是:Cl2 > Br2 > I2 D.由上述实验得出Cl2、HIO3、HBrO3氧化性由强到弱的顺序是:HBrO3 > Cl2 > HIO3 【答案】C 3.用Pt极电解含有Ag+、Cu2+和X3+各0.1 mol的溶液,阴极析出固体物质的质量m (g)与回路中通过电子的物质的量n (mol)关系如图所示。则下列氧化性强弱的判断正确的是 ( ) A.Ag+>X3+>Cu2+>H+>X2+ B.Ag+>Cu2+>X3+>H+>X2+ C.Cu2+>X3十>Ag十>X2+ >H+ D.Cu2+>Ag+>X3+>H+>X2+ 【答案】A 4.实验室常用NaNO2与NH4Cl两种物质的浓溶液混合共热制取少量N2。下列关于该反应的说法中不正确的是 ( ) A.该反应产物除N2外还有NaCl和H2O B.NaNO2是氧化剂,NH4Cl是还原剂 C.每生成2.24L标况下N2转移0.6mol电子 D.氧化产物和还原产物均为N2 【答案】C 5.已知NH4 CuSO3与足量的10 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是 ( ) A.反应中硫酸作氧化剂 B.NH4 CuSO3中硫元素被氧化 C.刺激性气味的气体是氨气 D.1 mol NH4 CuSO3完全反应转移0.5 mol电子 【答案】D 6.常温下,在溶液中可发生以下反应: ①H++Z-+XO=X2++Z2+H2O(未配平), ②2M2++R2=2M3++2R-, ③2R-+Z2=R2+2Z-。由此判断下列说法正确的是 ( ) A.常温下反应2M2++Z2 = 2M3++2Z-不可以自发进行 B.R元素在反应②中被氧化,在③中被还原 C.反应①配平后,H2O的化学计量数为8 D.还原性强弱顺序为:X2+>Z->R->M2+ 【答案】C 7.O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是 ( ) A.氧气是还原产物 B.O2F2既是氧化剂又是还原剂 C.若生成4.48LHF,则转移0.8mol电子 D.还原剂与氧化剂的物质的量之比为4:1 【答案】A 8.下列表示反应中电子转移的方向和数目正确的是 ( ) A. B. C. D. 【答案】D 9.2015年8月12日天津爆炸事故中导致氰化钠泄漏,泄漏的氰化钠可以通过喷洒双氧水来处理,以减轻环境污染,有关化学方程式为: NaCN+H2O2+H2O=NH3+NaHCO3,下列有关说法不正确的是 ( ) A.NaCN中碳元素化合价为+2价 B.在该反应中H2O2既作氧化剂又作还原剂 C.NaCN中含有离子键和共价键 D.当有0.1mol NH3生成时,有0.2mol电子转移 【答案】B 10.化学方程式可简明地体现元素及其化合物的性质。已知氧化还原反应: 2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O; 2Fe(OH)2+I2+2KOH=2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O 复分解反应: 2HSCN+K2CO3=2KSCN+CO2↑+H2O; KCN+CO2+H2O=HCN+KHCO3 热分解反应: 4NaClO3NaCl+NaClO4;NaClO4NaCl+2O2↑ 下列说法不正确的是 ( ) A.热稳定性:NaCl>NaClO4>NaClO B.还原性(碱性溶液):Fe(OH)2>I2>KIO3 C.氧化性(酸性溶液):FeCl3>Co(OH)3>I2 D.酸性(水溶液):HSCN>H2CO3>HCN 【答案】B 二、填空题(四小题,共50分) 11.(16分) Ⅰ.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu.根据以上信息,结合自己所掌握的化学知识,回答下列问题: (1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作________(填“氧化剂”或“还原剂”). (2)写出CuH在氯气中燃烧的化学反应方程式:___________________________________ (3)CuH溶解在稀盐酸中生成的气体是______(填化学式). (4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:__________________________________________________. Ⅱ.某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1 mol X在该反应中失去3.01×1023个电子。 (1)写出该反应的化学方程式:________________________________________________; (2)若有9.8 g H2SO4参加反应,则转移电子的物质的量为________; (3)本反应体系中,若用浓盐酸代替硫酸,用离子方程式表示后果:_____________________。 【答案】Ⅰ.(1)还原剂 (1分)(2)2CuH+3Cl22CuCl2+2HCl(3分) (3)H2(1分)(4)CuH+3H++NO3- = Cu2++2H2O+NO↑(3分) Ⅱ.(1)5PbO2+2MnSO4+2H2SO4===Pb (MnO4)2+4PbSO4+2H2O(3分) (2)0.5 mol(2分) (3)PbO2+4H++2Cl-===Pb2++Cl2↑+2H2O(3分) 12.(13分)硫酸亚铁晶体俗称绿矾(FeSO4 • 7H2O),重铬酸钠晶体俗称红矾钠(Na2Cr2O7·2H2O),它们都是重要的化工产品。工业上以铬铁矿[主要成分是[Fe(CrO2)2]为原料制备绿矾和红矾钠的工艺流程如图所示。 请回答下列问题: (1)已知Fe(CrO2)2中铬元素的化合价为+3价,则Fe(CrO2)中铁元素的化合价为______________。 (2)化学上可将某些盐写成氧化物的形式,如Na2SiO3写成Na2O·SiO2,则Fe(CrO2)2可写成__________。 (3)煅烧铬铁矿时,矿石中的Fe(CrO2)2转变成可溶于水的Na2CrO4,反应的化学方程式如下: 4Fe(CrO2)2+8Na2CO3+7O22Fe2O3+8Na2CrO4+8CO2 ①该反应中还原剂与氧化剂的物质的量之比为________________。 ②为了加快该反应的反应速率,可采取的措施是_________________(填一种即可)。 ⑷己知CrO42-在氢离子浓度不同的酸性溶液中有不同的反应。如: 2CrO42-+2H+=Cr2O72-+H2O 3CrO42-+4H+=Cr3O102-+2H2O ①往混合溶液甲中加入硫酸必须适量的原因是________________。 ②混合溶液乙中溶质的化学式为______________________。 (5)写出Fe与混合溶液丙反应的主要离子方程式_________________。检验溶液丁中无Fe3+的方法是:_____________。从溶液丁到绿巩的实验操作为蒸发浓缩、___________、过滤、洗涤、干燥。 【答案】 (1) +2 价(1分) (2) FeO·Cr2O3 (1分) (3)①4:7(2分) ②粉碎矿石(或升高温度)(1分) (4)①H2SO4量少时不能除尽Na2CO3杂质,H2SO4量多时又会生成新的杂质(Cr3O10-2),所以H2SO4必须适量(2分) ②Na2Cr2O7、Na2SO4(2分) (5)Fe+2Fe3+=3Fe2+ (1分) 取少量丁溶液于试管中,向其中加入KSCN溶液,不显红色则说明丁溶液中不含Fe3+ (2分) 冷却结晶(1分) 13.(11分)根据下列反应方程式填写有关内容:5K2SO3 + 2KMnO4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3H2O (1)该反应中,氧化剂是 ,还原剂是 ,氧化产物是 。(均填化学式) (2)氧化产物与还原产物的物质的量之比是 ;若有0.5 mol K2SO3参与反应,则转移的电子的物质的量为 mol,产生的H2O的质量为 g 。 (3)把该反应方程式改写为离子方程式 【答案】(1)KMnO4 (1分) K2SO3(1分) K2SO4 (1分) (2)5:2(2分) 1 (2分) 5.4(2分) (3)(2分) 14.(10分)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空: (1)写出CCl4层由紫色变成无色的化学反应方程式(已知氧化产物为HIO3): (2)把KI换成KBr,则CCl4层变为_ _色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。 (3)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。 【答案】 (1)I2+5Cl2+6H2O=2HIO3+10HCl (3分) (2)橙红色(2分) HBrO3>Cl2>HIO3 (2分) (3)10.58(3分)查看更多