- 2021-08-24 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】辽宁省葫芦岛市2020届高三下学期第一次模拟考试
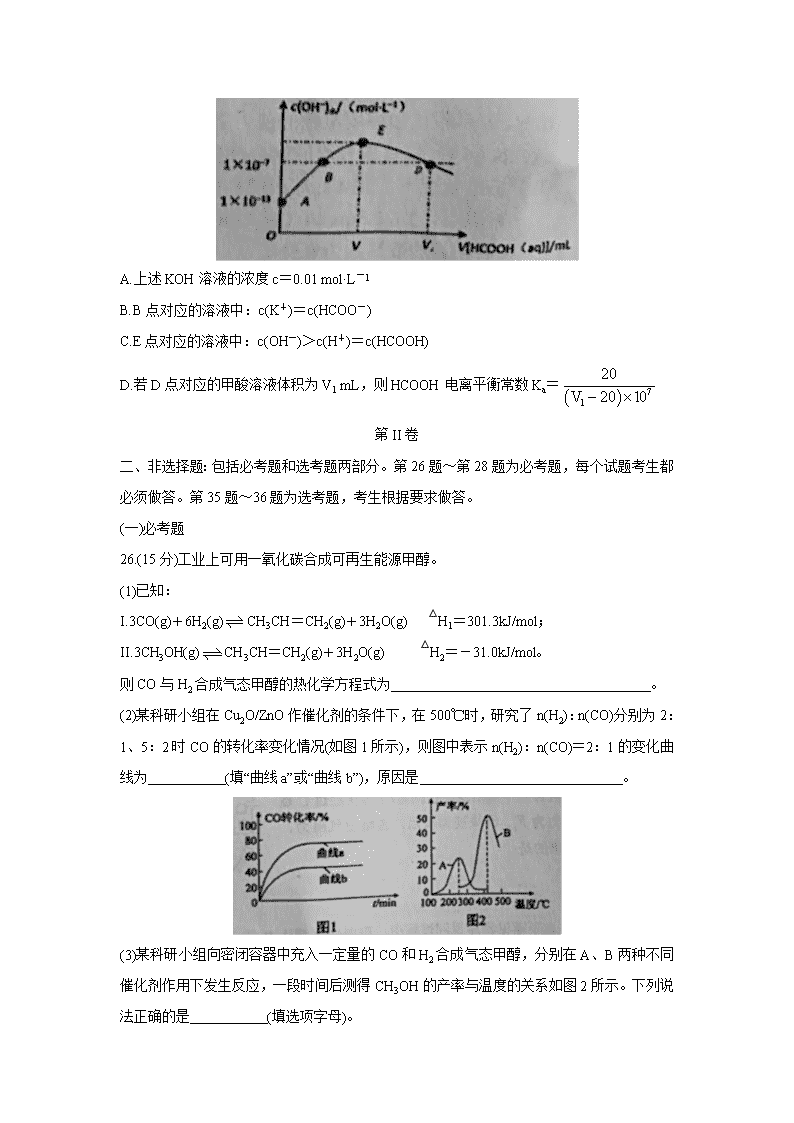
辽宁省葫芦岛市2020届高三下学期第一次模拟考试 可能用到的相对原子质量H1 C12 N14 O16 Na23 Mg24 Al27 S32 Cl35.5 Fe56 Cu64 Zn65 Ba137 第I卷 一、选择题:本题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.在2020年抗击新型冠状病毒肺炎的战役中,化学品发挥了重要作用。下列说法中错误的是( ) A.医用消毒酒精中乙醇的浓度为75% B.“84”消毒液、二氧化氯泡腾片可用作环境消毒 C.生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料 D.洗手液都能够杀死病毒起到消毒作用 8.已知有机物M在一定条件下可转化为N。下列说法正确的是( ) A.该反应类型为取代反应 B.N分子中所有碳原子共平面 C.可用溴水鉴别M和N D.M的一氯代物共7种 9.设NA表示阿伏加德罗常数的值。下列说法正确的是( ) A.Na2S2O3与H2SO4溶液混合产生22.4 L气体时转移电子数为2NA B.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA C.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA D.50 g质量分数为46%的乙醇溶液与足量的钠反应,放出H2的分子数目为0.25NA 10.已知A、B、C、D、E是短周期中原子序数依次增大的五种元素,A、B形成的简单化合物常用作制冷剂,D原子最外层电子数与最内层电子数相等,化合物DC中两种离子的电子层结构相同,A、B、C、D的原子序数之和是E的两倍。下列说法正确的是( ) A.原子半径:C>B>A B.气态氢化物的热稳定性:E>C C.最高价氧化对应的水化物的酸性:B>E D.化合物DC与EC2中化学键类型相同 11.下列实验的现象与结论相对应的是( ) 12.磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4。某磷酸铁锂电池的切面如下图所示。下列说法错误的是( ) A.放电时Li+脱离石墨,经电解质嵌入正极 B.充电时电子从电源经铝箔流入正极材料 C.隔膜在反应过程中只允许Li+通过 D.充电时电池正极上发生的反应为:LiFePO4-xe-=Li1-xFePO4+xLi+ 13.298K时,向20 mL c mol·L-1 KOH溶液中滴加0.1 mol·L-1 HCOOH溶液,混合溶液中水电离的氢氧根离子浓度与滴加甲酸(弱酸)溶液体积(V)的关系如图所示。下列说法正确的是( ) A.上述KOH溶液的浓度c=0.01 mol·L-1 B.B点对应的溶液中:c(K+)=c(HCOO-) C.E点对应的溶液中:c(OH-)>c(H+)=c(HCOOH) D.若D点对应的甲酸溶液体积为V1 mL,则HCOOH电离平衡常数Ka= 第II卷 二、非选择题:包括必考题和选考题两部分。第26题~第28题为必考题,每个试题考生都必须做答。第35题~36题为选考题,考生根据要求做答。 (一)必考题 26.(15分)工业上可用一氧化碳合成可再生能源甲醇。 (1)已知: I.3CO(g)+6H2(g)CH3CH=CH2(g)+3H2O(g) △H1=301.3kJ/mol; II.3CH3OH(g)CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。 则CO与H2合成气态甲醇的热化学方程式为 。 (2)某科研小组在Cu2O/ZnO作催化剂的条件下,在500℃时,研究了n(H2):n(CO)分别为2:1、5:2时CO的转化率变化情况(如图1所示),则图中表示n(H2):n(CO)=2:1的变化曲线为 (填“曲线a”或“曲线b”),原因是 。 (3)某科研小组向密闭容器中充入一定量的CO和H2合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH3OH的产率与温度的关系如图2所示。下列说法正确的是 (填选项字母)。 a使用催化剂A能加快相关化学反应速率,但催化剂A并未参与反应 b.在恒温恒压的平衡体系中充入氨气,CH3OH的产率降低 c.当2v(CO)正=v(H2)逆时,反应达到平衡状态 (4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。 若甲容器平衡后气体的压强为开始时的,则该温度下,该反应的平衡常数K= ,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为 。 (5)CO与日常生产生活相关。 ①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。则负极的电极反应式为 。 ②碳酸二甲酯[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为4CH3OH+2CO+O22(CH3O)2CO+2H2O,装置如图3所示: 图3 写出阳极的电极反应式: 。 27.(12分)2019年诺贝尔化学奖颁给了为锂电池发展作出突出贡献的三位科学家。某废旧锂电池正极主要由LiFePO4、铝箔、炭黑等组成,Fe、Li、P具有极高的回收价值,具体流程如下: (1)过程i生成NaAlO2溶液的离子方程式是 。 (2)过程ii中HCl/H2O2的作用是 。 (3)浸出液X的主要成分为Li+、Fe3+、H2PO4-等。过程iii控制碳酸钠溶液浓度20%、温度85℃、反应时间3h条件下,探究pH对磷酸铁沉淀的影响,如图所示。 ①合考虑铁和磷沉淀率,最佳pH为 。 ②结合平衡移动原理,解释过程iii中pH增大,铁和磷沉淀率增大的原因 。 ③当pH>2.5后,随pH增加,磷沉淀率出现了减小的趋势,解释其原因 。 (4)LiFePO4可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应制取,其沉淀反应的化学方程式为 。 28.(16分)二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发黏、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质: (1)制取少量S2Cl2 实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。 ①仪器m的名称为 ,装置F中试剂的作用是 。 ②装置连接顺序:A→ → → →E→D。 ③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是 。 ④为了提高S2Cl2的纯度,实验的关键是控制好温度和 。 (2)少量S2Cl2泄漏时应喷水减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是 。 (3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。 ①W溶液可以是 (填标号)。 a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水 ②该混合气体中二氧化硫的体积分数为 (用含V、m的式子表示)。 (二)选做题 35.[化学——选修3:物质结构与性质](15分) 锌及锌的化合物应用广泛。例如,测定铜合金中的铅、锌时要利用锌配离子的下列反应: [Zn(CN)4]2-+4HCHO+4H2O=Zn2++4HOCH2CN+4OH- 回答下列问题: (1)基态Zn2+的电子排布式为 ,基态C原子核外电子占据 个不同原子轨道。 (2)C、N、O三种元素的第一电离能由大到小的顺序为 ,HOCH2CN分子中含有的σ键与π键数目之比为 。 (3)HCHO分子中碳原子轨道的杂化类型是 ,福尔马林是HCHO的水溶液,HCHO极易与水互溶的主要原因是 。 (4)[Zn(CN)4]2-中Zn2+与CN-之间的化学键称为 ,提供孤电子对的成键原子是 。 (5)Zn与S形成某种化合物的晶胞如下图所示。 ①Zn2+填入S2-组成的 空隙中; ②已知晶体密度为d g/cm3,该晶胞的边长表达式为 pm(写计算表达式)。 36.[化学——有机化学基础](15分) 用于汽车刹车片的聚合物Y是一种聚酰胺纤维,合成路线如图: 已知: (1)生成A的反应类型是 。 (2)试剂a是 。 (3)B中所含的官能团的名称是 。 (4)W、D均为芳香化合物,分子中均只含两种不同化学环境的氢原子。 ①F的结构简式是 。 ②生成聚合物Y的化学方程式是 。 (5)Q是W的同系物且相对分子质量比W大14,则Q有 种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的为 (写一种结构简式即可)。 (6)试写出由1,3-丁二烯和乙炔为原料(无机试剂及催化剂任用)合成的合成路线 。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。 【参考答案】 一、选择题(每小题6分,共42分) 7.D 8.C 9.B 10.C 11.A 12.B 13.D 二、非选择题(共58分) 26.(15分) (1) CO(g)+2H2(g) CH3OH(g) △H=-90.1kJ/mol(2分) (2) 曲线b(1分);H2的含量越低,CO的转化率越低(2分) (3)bc(2分) ; (4) 0.25(2分) ;1﹤c﹤2(2分) (5) ①CO-2e-+O2-==CO2(2分);②2CH3OH+CO-2e-==(CH3O)2CO+2H+(2分) 27.(12分) (1) 2Al+2OH-+2H2O=2AlO2-+3H2↑ (2分) (2) 溶解LiFePO4,将Fe2+氧化为Fe3+(2Fe2++H2O2+2H+=2Fe3++2H2O)(2分) (3) ① 2.5 (2分) ② H2PO4-HPO42-+H+,HPO42-PO43-+H+,加入Na2CO3后,CO32-结合H+使c(H+)减小,促进上述电离平衡正向移动,c(PO43−)增大,与Fe3+结合形成磷酸铁沉淀(或者:H2PO4-HPO42-+H+,HPO42-PO43-+H+,溶液pH增大,c(H+)减小,促进上述电离平衡正向移动,c(PO43-)增大,与Fe3+结合形成磷酸铁沉淀 (2分) ③ pH>2.5时,沉淀中的磷酸铁会有部分开始转变生成Fe(OH)3,使得部分PO43-释放,导致磷沉淀率下降 (2分) (4) (NH4)2Fe(SO4)2+H3PO4+LiOH=2NH4HSO4+LiFePO4↓+H2O或 (NH4)2Fe(SO4)2+H3PO4+3LiOH=(NH4)2SO4+Li2SO4+LiFePO4↓+3H2O(2分) 28.(16分) (1)①直形冷凝管(或冷凝管) (2分) 除去Cl2中混有的HCl杂质(2分) ②F C B(2分) ③将装置内的氯气排入D内吸收以免污染空气,并将B中残留的S2Cl2排入E中收集(2分) ④滴入浓盐酸的速率(或B中通入氯气的量,其他合理答案均得分) (2分) (2)S2Cl2遇水会分解放热,放出腐蚀性烟气(2分) (3)①ac(多选,漏选不给分) (2分) ②×100%或%或%或%(2分) 35.(15分) (1)1s22s22p63s23p63d10(或[Ar] 3d10)(2分) ; 4(1分) (2)N>O>C(2分) ;3:1(2分) (3)sp2(1分); HCHO与水分子间存在氢键(2分) (4)配位键(1分); C(1分) (5)①正四面体(1分);② (2分) 36.(15分) (1) 取代反应 (1分) (2) 浓硝酸、浓硫酸 (2分) (3) 氯原子、硝基(2分) (4)① (2分) ② (2分) (5) 10(2分); 或 (2分) (6)(2分)查看更多