- 2021-08-24 发布 |
- 37.5 KB |
- 25页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版纯碱的生产课时作业
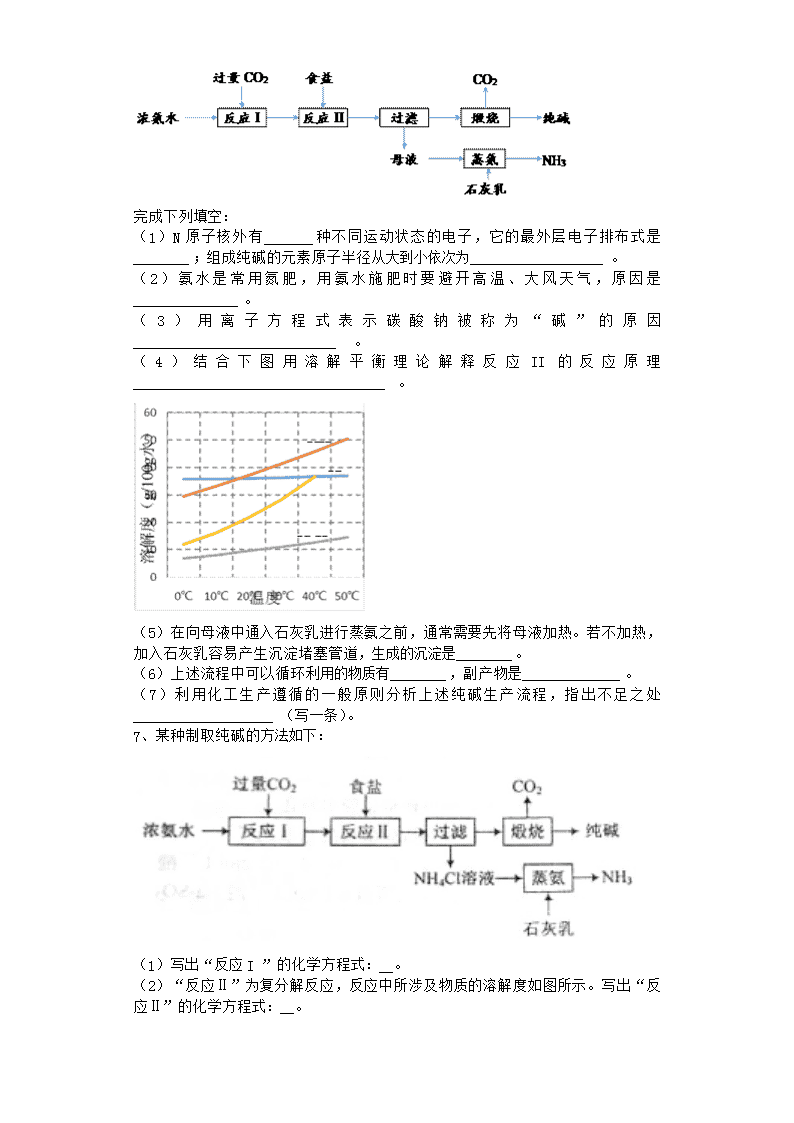
2020届一轮复习人教版 纯碱的生产 课时作业 1、侯氏制碱法制造纯碱同时副产氯化铵。在母液处理上,有关说法错误的是 A.水浴加热,有利于NH4Cl更多地析出 B.加入食盐,增大Cl-的浓度,使NH4Cl更多地析出 C.通入氨气,增大NH4+的浓度,使NH4Cl更多地析出 D.通入氨气,使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度 2、某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下: 下列推断不合理的是( ) A.往甲中通适量CO2有利于(NH4)2SO4生成 B.生成1 mol(NH4)2SO4至少消耗2 molNH3 C.CO2可被循环利用 D.NH3、CO2的通入顺序可以互换 3、中国历史悠久,很早就把化学技术应用到生产生活中。下列与化学有关的说法不正确的是( ) A、闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 B、四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 C、侯氏制碱法的工艺过程中应用了物质溶解度的差异 D、由于中国大部分地区都缺碘,而缺碘就会引起碘缺乏病,80年代国家强制给食用的氯化钠食盐中加入碘单质 4、从海水中制得的氯化钠除食用外,还可用作T业原料,生成多种含钠或氯的化工产品,利用CO2+NH3+HO2+NaCl═NaHCO3↓+NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图. 饱和食盐水溶液悬浊液晶体纯碱 则相关的说法错误的是( ) A.通入的气体:A是CO2,B是NH3 B.NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小 C.步骤(3)的操作为过滤,滤液可作化学肥料 D.步骤(4)中,将晶体加热分解可以得到纯碱 5、饱和食盐水中加入碳酸氢铵可制备小苏打,滤出小苏打后,向母液中通入氨,再冷却、加食盐,过滤,得到氯化铵固体.下列分析错误的是( ) A.该制备小苏打的方程式为:NaCl+NH4HCO3→NaHCO3↓+NH4Cl B.母液中通入的氨气与HCO3﹣反应:NH3+HCO3﹣→CO32﹣+NH4+ C.加食盐是为增大溶液中Cl﹣的浓度 D.由题可知温度较低时,氯化铵的溶解度比氯化钠的大 6、某种制取纯碱的生产流程如下图所示: 完成下列填空: (1)N原子核外有_______种不同运动状态的电子,它的最外层电子排布式是________;组成纯碱的元素原子半径从大到小依次为___________________。 (2)氨水是常用氮肥,用氨水施肥时要避开高温、大风天气,原因是_______________。 (3)用离子方程式表示碳酸钠被称为“碱”的原因_____________________________ 。 (4)结合下图用溶解平衡理论解释反应II的反应原理____________________________________。 (5)在向母液中通入石灰乳进行蒸氨之前,通常需要先将母液加热。若不加热,加入石灰乳容易产生沉淀堵塞管道,生成的沉淀是________。 (6)上述流程中可以循环利用的物质有________,副产物是______________。 (7)利用化工生产遵循的一般原则分析上述纯碱生产流程,指出不足之处____________________(写一条)。 7、某种制取纯碱的方法如下: (1)写出“反应I ”的化学方程式:__。 (2)“反应Ⅱ”为复分解反应,反应中所涉及物质的溶解度如图所示。写出“反应Ⅱ”的化学方程式:__。 (3)写出“煅烧”反应的化学方程式:__。 (4) “蒸氨”时需要加热,写出“蒸氨”时反应的化学方程式:___。 (5)写出将“蒸氨”产生的氨气通入Al2(SO4)3溶液中时反应的离子方程式: __。 8、我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图: (1)上述生产纯碱的方法称 ,副产品的一种用途为 . (2)沉淀池中发生的化学反应方程式是 ;从沉淀池中取出沉淀的操作是 . 9、纯碱是造纸、玻璃、纺织、制革等行业的重要原料. (1)路布兰法制备纯碱:①食盐与硫酸反应生成硫酸钠;②将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成.第②步反应的化学方程式为 . (2) ①原盐水中含少量Mg2和Ca2,结合生产实际,精制盐水需要的试剂时 、 .(填化学式) ②步骤 II保持在30﹣35℃进行,反应的化学方程式为 ,该反应能发生的原因是 .该工艺中循环利用的物质是 . ③索尔维制纯碱不需要用到的一种设备是 (填正确答案标号). A.吸氨塔 B.蒸氨塔 C.碳酸化塔 D.沸腾炉 E.石灰窑 ④该工艺中食盐利用率大约只有70%,食盐损失的主要原因是 .我国科学家侯德榜将合成氨工业得到的NH3和CO2引入纯碱的生产,向上述工艺的“母液”中通入NH3并加入食盐固体,降温结晶得到副产品 (填化学式),剩余母液返回“吸氨”步骤,大大提高了食盐的利用率. (3)纯碱产品中可能含有碳酸氢钠.用热重分析的方法测定纯碱中碳酸氢钠的质量分数为ω(NAHCO3)= (列出算式,所需数据用字母表示,并说明各字母的含义). 10、工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题: (1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱. ①食盐和浓硫酸反应的化学方程式为 ; ②硫酸钠和焦炭、石灰石反应的化学方程式为 (已知产物之一为CaS); (2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱. ①图中的中间产物C是 ,D是 (写化学式); ②装置乙中发生反应的化学方程式为 ; (3)联合制碱法是对氨碱法的改进,其优点是 ; (4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾.请结合如图2的溶解度(S)随温度变化曲线,分析说明是否可行? . 11、工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题: (1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱. ①食盐和浓硫酸反应的化学方程式为 ; ②硫酸钠和焦炭、石灰石反应的化学方程式为 (已知产物之一为CaS); (2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱. ①图中的中间产物C是 ,D是 (写化学式); ②装置乙中发生反应的化学方程式为 ; (3)联合制碱法是对氨碱法的改进,其优点是 ; (4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾.请结合如图2的溶解度(S)随温度变化曲线,分析说明是否可行? . 12、NaCl是价廉且应用广泛的化工业原料,例如应用于纯碱工业、氯碱工业、氯酸钾工业、肥皂工业等. (1)19世纪60年代氨碱法是纯碱工业广泛使用的方法,20世纪20年代以后被联合制碱法逐渐取代. ①请写出以NaCl为原料利用氨碱法生产纯碱的化学方程式 . ②在联合制碱法中,纯碱工厂与 工厂进行联合生产,以方便的获得原料 . ③在联合制碱法中循环使用,而在氨碱法中循环使用率不高的物质是 . (2)氯酸钾是重要的化工业产品,在火柴、炸药、雷管、焰火等制造中有重要应用,工业中首先通过电解热食盐水制得氯酸钠,再加入一定量的氯化钾即可得到氯酸钾沉淀. ①在火柴、炸药、雷管、焰火的制造过程中大量使用氯酸钾,主要应用氯酸钾的 性. ②请写出电解食盐水生产氯酸钠的化学方程式 .该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有 (请答出两点). (3)在肥皂的工业生成过程中,也要使用NaCl的目的是 . 13、我国化学家侯德榜创立了著名“侯氏制碱法”,促进了世界制碱技术的发展。已知图1表示其工业流程,图2表示各物质的溶解度曲线。 回答下列问题: (1)图中X的化学式为______________________; (2)沉淀池中发生反应的化学方程式为______________________,该反应先向饱和食盐水中通入_________(填化学式)至饱和,再通入另一种气体,若顺序颠倒,后果是______________________; (3)沉淀池的反应温度控制在30~35℃,原因是______________________; (4)母液中加入CaO后生成Y的化学方程式为______________________________; (5)若在煅烧炉中反应的时间较短,NaHCO3将分解不完全,欲测定某份煅烧了一段时间的样品的组成及原NaHCO3的分解率。称取2.960g样品完全溶于水制成溶液,然后向此溶液中缓慢加稀盐酸,并不断搅拌,溶液中有关离子的物质的量随盐酸加入的变化如图所示。 则曲线a、d对应的离子分别是___________、___________(填离子符号),该样品中Na2CO3的质量分数为_________________,原NaHCO3的分解率为________________。 14、工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题: (1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱. ①食盐和浓硫酸反应的化学方程式为 ; ②硫酸钠和焦炭、石灰石反应的化学方程式为 (已知产物之一为CaS); (2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱. ①图中的中间产物C是 ,D是 (写化学式); ②装置乙中发生反应的化学方程式为 ; (3)联合制碱法是对氨碱法的改进,其优点是 ; (4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾.请结合如图2的溶解度(S)随温度变化曲线,分析说明是否可行? . 15、工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题: (1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱. ①食盐和浓硫酸反应的化学方程式为 ; ②硫酸钠和焦炭、石灰石反应的化学方程式为 (已知产物之一为CaS); (2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱. ①图中的中间产物C是 ,D是 (写化学式); ②装置乙中发生反应的化学方程式为 ; (3)联合制碱法是对氨碱法的改进,其优点是 ; (4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾.请结合如图2的溶解度(S)随温度变化曲线,分析说明是否可行? . 16、如图是找国科技工作者研制的以尿素为原料生产三聚氰胺(C3N6H6)的工艺﹣﹣“常压气相一步法联产纯玻新技术”: 已知:①尿素的熔点是132.7℃,常压下超过160℃即可分解;②三聚氰胺的熔点是354℃,加热易升华,微溶于水. 请回答下列问题: (1)以尿素为原料生产三聚氮胺的原理是: CO(NH2)2 C3N6H6+ NH3↑+ CO2↑(配平化学方程式,在横线上填上相应物质的化学计量数),在实验室使尿素熔化的容器的名称为 . (2)写出下列物质中主要成分的化学式:产品2 、X . (3)联氨系统沉淀池中发生反应的化学方程式为 . (4)为了使母液中析出更多的产品2,常用的方法是 ; A.加人NaCl固体 B.加入NaHCO3固体 C.通人CO2 D.通人NH3. 17、纯碱一直以来都是工业生产的重要原料,很长一段时间纯碱的制法都被欧美国家所垄断.20世纪初我国著名的工业化学家侯德榜先生,经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法),并在天津建造了我国独立研发的第一家制碱厂.其制碱原理的流程如下: (1)侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明) 、 . (2)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是: 、 (填化学式).这两种气体在使用过程中是否需要考虑添加的顺序 (填“是”或“否”),原因是: . (3)在沉淀池中发生的反应的化学方程式是 . (4)使原料水中溶质的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环.从母液中可以提取的副产品的应用是 (举一例). 18、焦亚硫酸钠常用作食品漂白剂.其制备工艺流程如图: 已知:反应II包含2NaHSO3═Na2S2O5+H2O等多步反应. (1)反应I的总化学方程式为 ,反应I进行时应先通入的气体是 ,反应I产生的NH4Cl可用作 . (2)灼烧时发生反应的化学方程式为 ,若灼烧时生成SO21.12×l06 L,则转移电子 mol. (3)己知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为 . (4)副产品X的化学式是 ,在上述流程中可循环使用的物质是 . (5)为了减少产品Na2S205中杂质含量,需控制反应II中气体与固体的物质的量之比约为 ,检验产品中含有碳酸钠杂质所需试剂 . ①澄清石灰水 ②饱和碳酸氢钠溶液 ③氢氧化钠 ④酸性高锰酸钾 ⑤稀硫酸. 19、碳酸钠是一种重要的化学基本工业产品.比利时人索尔维发明了氨碱法生产碳酸钠,氨碱法生产原理示意图如下: 我国化工专家设计了联合制碱法,联合制碱法生产原理示意图如下: 请回答下列问题: (1)从索尔维制碱法生产原理示意图可知,氨碱法的总反应方程式为 .按照绿色化学原则,理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,实现废弃物的零排放.计算索尔维制碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比) ; (2)试列举出索尔维制碱法的两大缺点. ① ; ② . (3)设计联合制碱法的我国化工专家是 ; (4)从联合制碱法生产原理示意图可知,原料Ⅲ中的CO2来自合成氨,指出步骤名称,并写产生CO2化学方程式. 步骤Ⅰ: ,化学方程式 步骤Ⅱ: ,化学方程式 . 20、侯氏制碱法的生产流程可表示如下,请回答下列问题: (1)沉淀池中加入(或通入)有关物质的顺序为 → → (2)写出上述流程中X、Y的化学式:X Y (3)写出沉淀池中发生的化学反应方程式 (4)侯氏制碱法的生产流程中可以循环使用的物质主要为 、 (5)从沉淀池中取出沉淀的操作是 ,为了进一步提纯NaHCO3晶体,可采用 法。 (6)若在煅烧炉中燃烧的时间较短,NaHCO3将化解不完全.现若取10.5g NaHCO3固体,加热一定时间后,剩余固体的质量为7.1g,如果把此剩余固体全部加入到200mL 1mol/L的盐酸中,充分反应后溶液中H+的物质的量浓度为 mol/L(溶液体积变化忽不计)。 参考答案 1、答案:A A、从母液中获得NH4Cl晶体,采用的时降温结晶的方法,故A说法错误;B、加入食盐,增加 c(Cl-),使NH4Cl更多析出,故B说法正确;C、通入NH3,NH3+H2O=NH3·H2O,NH3·H2ONH4++ OH-,c(NH4+)增大,使NH4Cl更多地析出,故C说法正确;D、通入氨气,NH3·H2O与NaHCO3反应生成 Na2CO3,溶解度小的转化成溶解度大的,c(NH4+)增大,提高析出NH4Cl的纯度,故D说法正确。 2、答案:D 解:往甲中通适量CO2,生成碳酸钙沉淀,有利于(NH4)2SO4生成,故A项错误;根据元素守恒,生成1 mol(NH4)2SO4至少消耗2 molNH3,故B正确;碳酸钙分解生成二氧化碳可被循环利用,故C正确;二氧化碳的溶解度小,NH3、CO2的通入顺序互换后,不利于二氧化碳的吸收,故D错误。 3、答案:D 解:A.烧制陶瓷的原理是以粘土为主要原料以及各种天然矿物经过粉碎混炼成型和煅烧制得的材料以及各种制品,有新物质生成,属于化学工艺,酿酒是在酒化酶的作用下将葡萄糖转化成乙醇的过程,属于化学工艺,造纸其中应用了将打碎的纤维漂白这一环节,有新物质生成,属于化学工艺,A项正确;B. 黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成,B项正确;C. 侯氏制碱法的工艺流程是将氨气通入饱和的NaCl溶液中,再通入过量的CO2,NaHCO3的溶解度小于NH4Cl的溶解度,NaHCO3 结晶析出,C项正确;D.食盐加碘加的是KIO3 ,D项错误;答案选D。 4、答案:A 解:A、氨气极易溶于水,二氧化碳能溶于水,为增大气体吸收先通入足量气体为氨气,通入的气体:AB是A是NH3,B为CO2,故A错误; B、碳酸氢钠溶解度小,在氨化的饱和食盐水中通入二氧化碳气体反应生成碳酸氢钠晶体析出,NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小,故B正确; C、固体和液体的分离方法为过滤,滤液中为氯化铵溶液,步骤(3)的操作为过滤,滤液可作化学肥料,故C正确; D、步骤4是碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,将晶体加热分解可以得到纯碱,故D正确; 故选A. 5、答案:D A、根据侯氏制碱法①NH3+CO2+H2O=NH4HCO3②NH4HCO3+NaCl=NaHCO3↓+NH4Cl ③2NaHCO3=Na2CO3+H2O+CO2↑可知,该制备小苏打的方程式为:NaCl+NH4HCO3→NaHCO3↓+NH4Cl,故A正确; B、滤出小苏打后,母液中含少量的NaHCO3和NH4Cl,故加入氨水后能发生反应:NH3+HCO3﹣→CO32﹣+NH4+,故B正确; C、加食盐增大溶液中Cl﹣的浓度,能降低NH4Cl的溶解度,有助于NH4Cl的析出,故C正确; D、NH4HCO3+NaCl=NaHCO3↓+NH4Cl的发生是由于NaHCO3的溶解度小于NaCl的溶解度,NaHCO3更易析出,故D错误. 故选D. 6、答案: (1). 7 (2). 2s22p3 (3). Na > C >O (4). 氨水易挥发,大风高温天气加速氨气挥发从而失去肥效 (5). CO32- + H2O HCO3- + OH- (6). 碳酸氢钠溶解度最小;反应I生成高浓度HCO3-,反应II加入大量Na+,造成溶液中HCO3-和Na+的离子浓度超出碳酸氢钠饱和溶液浓度,所以析出碳酸氢钠 (7). CaCO3 (8). CO2,NH3 (9). CaCl2 (10). 有副产物生成,原料没有充分利用(或母液中有大量氯化钠与氯化钙一起排出,原料没有充分利用。) (1)N原子核电荷数为7,核外有7个电子,每一个电子的运动状态都不相同,所以氮原子核外有7种不同运动状态的电子,它的最外层电子排布式是2s22p3;纯碱所含元素分别为:钠、碳、氧,电子层数越多,原子半径越大,同一周期,从左到右,原子半径减小,因此钠、碳、氧三种元素原子半径从大到小依次为Na > C >O (2)氨水是常用氮肥,用氨水施肥时要避开高温、大风天气,原因是氨水易挥发,大风高温天气加速氨气挥发从而失去肥效; (3)碳酸钠在水中发生水解,生成碳酸氢钠和氢氧化钠,离子方程式为CO32- + H2O HCO3- + OH- ; (4)根据图示,碳酸氢钠溶解度最小;反应I生成高浓度HCO3-,反应II加入大量Na+,造成溶液中HCO3-和Na+的离子浓度超出碳酸氢钠饱和溶液浓度,所以析出碳酸氢钠 (5)母液中含有氯化铵和极少量的碳酸氢钠, 碳酸氢钠溶液与石灰乳反应生成碳酸钙沉淀,易堵塞管道, (6)上述流程中,氨气、二氧化碳既是反应物,也是生成物,因此在整个流程中可以循环利用;整个反应中氢氧化钙与氯化铵反应生成了氨气和氯化钙副产物 (7)利用化工生产遵循的一般原则分析上述纯碱生产流程,其不足之处是有副产物生成,原料没有充分利用(或母液中有大量氯化钠与氯化钙一起排出,原料没有充分利用); 7、答案: (1). NH3·H2O+CO2=NH4HCO3 (2). NaCl+NH4HCO3=NaHCO3↓+NH4Cl (3). 2NaHCO3 Na2CO3+CO2↑+H2O (4). 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O (5). Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (1)氨水显碱性,CO2为酸性氧化物,二者反应生成盐,CO2过量时生成酸式盐即碳酸氢铵,故化学方程式为:NH3·H2O+CO2=NH4HCO3。 (2)氨气极易溶于水,氨水的浓度非常大,可以溶解大量的氨气,则反应I得到浓度较大的碳酸氢铵溶液。向碳酸氢铵溶液中加入食盐后,溶液中主要存在四种离子:Na+、NH4+、HCO3-、Cl-,根据溶解度曲线可知,同温度下NaHCO3的溶解度最小,溶液中会析出晶体NaHCO3。反应II为复分解反应,则反应方程式为NaCl+NH4HCO3=NaHCO3↓+NH4Cl。 (3)过滤得到NaHCO3晶体,加热,NaHCO3分解为Na2CO3、H2O、CO2,反应方程式为:2NaHCO3 Na2CO3+CO2↑+H2O; (4)向NH4Cl溶液中加入石灰乳,NH4+与OH-结合为NH3·H2O,加热条件下,促进NH3逸出,即为“蒸氨”,反应方程式为2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O; (5)氨气溶于水得NH3·H2O,NH3·H2O碱性强于Al(OH)3,故将NH3通入Al2(SO4)3溶液中有Al(OH)3沉淀生成,离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。 8、答案:(1)联合制碱法;作化肥; (2)NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;过滤. 解:将二氧化碳和氨气、食盐水加入沉淀池中,发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,得到的沉淀在煅烧炉中发生反应2NaHCO3Na2CO3+H2O+CO2,从而得到Na2CO3,煅烧过程中得到的X为CO2要循环利用,母液中含有的铵根离子和碱反应得到的氨气也能循环利用, (1)上述生产纯碱的方法称联合制碱法,副产品是氯化铵,铵盐可以作化肥, 故答案为:联合制碱法;作化肥; (2)沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体, 反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,分离固体和溶液采用过滤方法,所以从沉淀池中取出沉淀的操作是过滤, 故答案为:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;过滤. 9、答案:(1)Na2SO4+CaCO3+4C Na2CO3+CaS+4CO↑; (2)①Ca(OH)2(或CaO);Na2CO3; ②NH3·H2O+NaCl+CO2=NaHCO3↓+NH4Cl;常温下,NaHCO3、NH4Cl、NH4HCO3、NaCl四种物质中,NaHCO3溶解度最小;CO2、NH3; ③D; ④NaHCO3未完全析出,母液中的Na随废液排出; NH4Cl; (3)( m1是样品质量,m2是样品受热分解后的质量). 解:(1)将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成,S元素发生还原反应,C发生氧化反应生成CO,反应方程式为:Na2SO4+CaCO3+4C Na2CO3+CaS+4CO↑, 故答案为:Na2SO4+CaCO3+4C Na2CO3+CaS+4CO↑; (2)石灰水煅烧得到二氧化碳,食盐水中通入氨气,溶液呈碱性,有利于吸收二氧化碳,增大溶液中HCO3﹣,析出NaHCO3晶体,过滤分离,母液中含有NH4Cl,碳酸氢钠加热分解得到纯碱,同时生成二氧化碳,向母液中加入石灰乳得到氨气,二氧化碳、氨气循环利用. ①精制盐水需要,用氢氧化钙沉淀镁离子,再用碳酸钠沉淀钙离子, 故答案为:Ca(OH)2(或CaO);Na2CO3; ②NaHCO3、NH4Cl、NH4HCO3、NaCl四种物质中,NaHCO3溶解度最小,析出中NaHCO3晶体,同时生成氯化铵,反应方程式为:NH3·H2O+NaCl+CO2=NaHCO3↓+NH4Cl,该工艺中循环利用的物质是氨气与二氧化碳, 故答案为:NH3·H2O+NaCl+CO2=NaHCO3↓+NH4Cl;常温下,NaHCO3、NH4Cl、NH4HCO3、NaCl四种物质中,NaHCO3溶解度最小;CO2、NH3; ③工艺流程中不需要沸腾炉,工业制备硫酸用到沸腾炉,盐水吸收氨气用到吸氨塔,母液中得到氨气用蒸氨塔,铵盐水吸收二氧化碳用到碳酸化塔,石灰水煅烧需要石灰窑, 故答案为:D; ④该工艺中食盐利用率大约只有70%,食盐损失的主要原因是:NaHCO3未完全析出,母液中的Na随废液排出; 母液中含有氯化铵,通入NH3并加入食盐固体,有利于氯化铵析出,降温结晶得到副产品为氯化铵, 故答案为:NaHCO3未完全析出,母液中的Na随废液排出; NH4Cl; (3)称量样品的质量m1,加热分解完成,测定分解后样品质量m2,根据固体质量差可以计算碳酸氢钠的质量,进而计算样品中碳酸氢钠的质量分数. 2NaHCO3Na2CO3+CO2↑+H2O 固体质量建设 168 62 m (m1﹣m2) 则m=, 故样品中碳酸氢钠的质量分数为=, 故答案为:( m1是样品质量,m2是样品受热分解后的质量). 10、答案:(1)①NaCl+H2SO4(浓)NaHSO4+HCl↑或2NaCl+H2SO4(浓)Na2SO4+2HCl↑; ②Na2SO4+4C+CaCO3CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3CaS+Na2CO3+2CO2; (2)①Ca(OH)2;NH3; ②NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl; (3)提高食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物CO2; (4)不可行; 碳酸氢钾的溶解度较大,降温过程中不会析出碳酸氢钾晶体. 解:(1)①利用高沸点酸制备挥发性酸,且HCl极易溶于水,故利用直接使用98%浓硫酸和氯化钠制取氯化氢,反应为:NaCl+H2SO4(浓)NaHSO4+HCl↑或2NaCl+H2SO4(浓)Na2SO4+2HCl↑,故答案为:NaCl+H2SO4(浓)NaHSO4+HCl↑或2NaCl+H2SO4(浓)Na2SO4+2HCl↑; ②由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3 ,根据元素守恒可知,还原C的氧化物CO或CO2生成,故反应方程式为:Na2SO4+4C+CaCO3CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3CaS+Na2CO3+2CO2, 故答案为:Na2SO4+4C+CaCO3CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3CaS+Na2CO3+2CO2; (2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙,故C为Ca(OH)2;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙,故D为NH3, 故答案为:Ca(OH)2;NH3; ②氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl,反应方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl, 故答案为:NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl; (3)该方法能提高原料的利用率,减少废渣的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥;可与合成氨厂联合,可利用合成氨的产物CO2, 故答案为:提高食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物CO2; (4)由溶解曲线图可知KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,由图象可知,降温结晶时会析出较多的KCl,无法大量析出碳酸氢钾; 故答案为:不可行; 碳酸氢钾的溶解度较大,降温过程中不会析出碳酸氢钾晶体. 11、答案:(1)① NaCl+H2SO4(浓)NaHSO4+HCl↑或2NaCl+H2SO4(浓)Na2SO4+2HCl↑; ② Na2SO4+4C+CaCO3CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3CaS+Na2CO3+2CO2; (2)① Ca(OH)2;NH3; ② NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl; (3)提高食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物CO2; (4)不可行; 碳酸氢钾的溶解度较大,降温过程中不会析出碳酸氢钾晶体. 解:本题考查纯碱工业(侯氏制碱法). (1)①利用高沸点酸制备挥发性酸,且HCl极易溶于水,故利用直接使用98%浓硫酸和氯化钠制取氯化氢,反应为:NaCl+H2SO4(浓)NaHSO4+HCl↑或2NaCl+H2SO4(浓)Na2SO4+2HCl↑,故答案为:NaCl+H2SO4(浓)NaHSO4+ HCl↑或2NaCl+H2SO4(浓)Na2SO4+2HCl↑; ②由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成,故反应方程式为:Na2SO4+4C+CaCO3CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3CaS+Na2CO3+2CO2, 故答案为:Na2SO4+4C+CaCO3CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3CaS+Na2CO3+2CO2; (2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙,故C为Ca(OH)2;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙,故D为NH3, 故答案为:Ca(OH)2;NH3; ②氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl,反应方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl, 故答案为:NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl; (3)该方法能提高原料的利用率,减少废渣的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥;可与合成氨厂联合,可利用合成氨的产物CO2, 故答案为:提高食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物CO2; (4)由溶解曲线图可知KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,由图象可知,降温结晶时会析出较多的KCl,无法大量析出碳酸氢钾; 故答案为:不可行; 碳酸氢钾的溶解度较大,降温过程中不会析出碳酸氢钾晶体. 12、答案:(1)① NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+CO2↑+H2O; ② 合成氨;NH3、CO2; ③ CO2、NaCl; (2)① 强氧化; ② NaCl+3H2ONaClO3+3H2↑;需要加热恒温控制、没有离子交换膜; (3)加入食盐使肥皂析出. 解:(1)①氨气溶于水所得氨水呈碱性,比水更易吸收二氧化碳;向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,上述反应的化学方程式分别为:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3,2NaHCO3Na2CO3+CO2↑+H2O, 故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+CO2↑+H2O; ②在联合制碱法中,联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,放出的二氧化碳气体可回收循环使用,其滤液是含有氯化铵和氯化钠的溶液,第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品,纯碱工厂与合成氨工厂进行联合生产,以便获得原料NH3、CO2, 故答案为:合成氨;NH3、CO2; ③氨碱法的最大缺点在于原料食盐的利用率只有72%~74%,联合制碱法最大的优点是使食盐的利用率提高到96%以上,此外氨碱法与联合制碱法相比,CO2循环使用率也不高, 故答案为:CO2、NaCl; (2)①处于高价的元素具有氧化性,氯酸钾中氯元素的化合价为+5价,在火柴、炸药、雷管、焰火的制造过程中分解生成氯化钾和氧气,氯元素化合价降低,表现强氧化性, 故答案为:强氧化; ②化合价升高的氯元素被氧化,化合价由﹣1价升高到+5价,化合价降低的氢元素被还原,化合价由+1价降低到0价,根据氧化还原反应得失电子数相等,反应为:NaCl+3H2ONaClO3+3H2↑,该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有需要加热恒温控制、没有离子交换膜, 故答案为:NaCl+3H2ONaClO3+3H2↑;需要加热恒温控制、没有离子交换膜; (3)工业上制肥皂时,为了使肥皂和甘油充分分离,常向皂化锅中慢慢加入食盐颗粒,将高级脂肪酸钠从混合液中析出, 故答案为:加入食盐使肥皂析出. 13、答案:(1)CO2 (2)CO2+H2O+NH3 +NaClNaHCO3↓+NH4Cl NH3 不能析出NaHCO3晶体 (3)NaHCO3溶解度小,低于30℃反应速率慢,高于35℃NH4HCO3分解,不易于析出NaHCO3晶体 (4)CaO+2NH4ClCaCl2+2NH3↑+2H2O (5)Na+ 71.62% 80% 解:本题考查了侯氏制碱法的工艺流程及有关问题。由图1的工业流程图可知,石灰石煅烧可分解为二氧化碳和氧化钙,在沉淀池中二氧化碳、食盐水和氨气反应生成碳酸氢钠沉淀和氯化铵,碳酸氢钠在煅烧炉中分解为碳酸钠和二氧化碳(X),二氧化碳通过循环进入沉淀池中,沉淀池中过滤出碳酸氢钠,剩余的母液中含有氯化铵和氨水,加入氧化钙可生成氨气(Y)通过循环进入沉淀池中。 (1)由上述分析可知,图中X的化学式为CO2。 (2) 由上述分析可知,沉淀池中发生反应的化学方程式为CO2+H2O+NH3 +NaClNaHCO3↓+NH4 Cl,由于二氧化碳难溶于水而氨气极易溶于水,所以应先向饱和食盐水中通入氨气使溶液呈碱性,在碱性溶液中有利于二氧化碳的吸收,如果顺序颠倒,饱和食盐水中溶解的二氧化碳会很少,则生成碳酸氢钠很少,则不能析出NaHCO3晶体。 (3)由图2可知,NaHCO3溶解度小,低于30℃反应速率慢,高于35℃NH4HCO3分解,不易于析出NaHCO3晶体。 (4)由上述分析可知,母液中含有氯化铵,母液中加入CaO,氧化钙和水反应生成氢氧化钙,并放出大量的热,氢氧化钙与氯化铵反应可生成氯化钙、氨气和水,故反应的化学方程式为CaO+2NH4ClCaCl2+2NH3↑+2H2O。 (5)由图可知,曲线a的物质的量自始至终不变,则曲线a对应的离子为钠离子,物质的量为0.05mol,样品与盐酸反应时,首先碳酸钠与盐酸反应生成碳酸氢钠,碳酸钠反应完后,碳酸氢钠再和盐酸反应生成氯化钠、二氧化碳和水,由曲线b、d可知,d曲线表示的离子的物质的量逐渐的减小,b曲线表示的离子的物质的量逐渐的增大,当d曲线减小为0时,b曲线正好增加到最大,所以d曲线对应的离子为碳酸根离子,b曲线对应的离子为碳酸氢根离子,由图像可知碳酸钠的物质的量为0.02mol,质量为0.02mol106g/mol=2.12g,生成0.02mol碳酸钠需要分解碳酸氢钠的物质的量为0.04mol,质量为0.04mol84g/mol=3.36g,未分解的碳酸氢钠的物质的量为0.01mol,质量为0.01mol84g/mol=0.84g,该样品中Na2CO3的质量分数为=71.62%,原NaHCO3的分解率为= 80%。 14、答案:(1)① NaCl+H2SO4(浓)NaHSO4+HCl↑或2NaCl+H2SO4(浓)Na2SO4+2HCl↑; ② Na2SO4+4C+CaCO3CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3CaS+Na2CO3+2CO2; (2)① Ca(OH)2;NH3; ② NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl; (3)提高食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物CO2; (4)不可行; 碳酸氢钾的溶解度较大,降温过程中不会析出碳酸氢钾晶体. 解:(1)①利用高沸点酸制备挥发性酸,且HCl极易溶于水,故利用直接使用98%浓硫酸和氯化钠制取氯化氢,反应为:NaCl+H2SO4(浓)NaHSO4+HCl↑或2NaCl+H2SO4(浓)Na2SO4+2HCl↑,故答案为:NaCl+H2SO4(浓)NaHSO4+HCl↑或2NaCl+H2SO4(浓)Na2SO4+2HCl↑; ②由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3 ,根据元素守恒可知,还原C的氧化物CO或CO2生成,故反应方程式为:Na2SO4+4C+CaCO3CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3CaS+Na2CO3+2CO2, 故答案为:Na2SO4+4C+CaCO3CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3CaS+Na2CO3+2CO2; (2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙,故C为Ca(OH)2;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙,故D为NH3, 故答案为:Ca(OH)2;NH3; ②氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl,反应方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl, 故答案为:NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl; (3)该方法能提高原料的利用率,减少废渣的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥;可与合成氨厂联合,可利用合成氨的产物CO2, 故答案为:提高食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物CO2; (4)由溶解曲线图可知KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,由图象可知,降温结晶时会析出较多的KCl,无法大量析出碳酸氢钾; 故答案为:不可行; 碳酸氢钾的溶解度较大,降温过程中不会析出碳酸氢钾晶体. 15、答案:(1)① NaCl+H2SO4(浓)NaHSO4+HCl↑或2NaCl+H2SO4(浓)Na2SO4+2HCl↑; ② Na2SO4+4C+CaCO3CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3CaS+Na2CO3+2CO2; (2)① Ca(OH)2;NH3; ② NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl; (3)提高食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物CO2; (4)不可行; 碳酸氢钾的溶解度较大,降温过程中不会析出碳酸氢钾晶体. 解:(1)①利用高沸点酸制备挥发性酸,且HCl极易溶于水,故利用直接使用98%浓硫酸和氯化钠制取氯化氢,反应为:NaCl+H2SO4(浓)NaHSO4+HCl↑或2NaCl+H2SO4(浓)Na2SO4+2HCl↑,故答案为:NaCl+H2SO4(浓)NaHSO4+HCl↑或2NaCl+H2SO4(浓)Na2SO4+2HCl↑; ②由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成,故反应方程式为:Na2SO4+4C+CaCO3 CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3CaS+Na2CO3+2CO2, 故答案为:Na2SO4+4C+CaCO3CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3CaS+Na2CO3+2CO2; (2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙,故C为Ca(OH)2;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙,故D为NH3, 故答案为:Ca(OH)2;NH3; ②氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl,反应方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl, 故答案为:NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl; (3)该方法能提高原料的利用率,减少废渣的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥;可与合成氨厂联合,可利用合成氨的产物CO2, 故答案为:提高食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物CO2; (4)由溶解曲线图可知KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,由图象可知,降温结晶时会析出较多的KCl,无法大量析出碳酸氢钾; 故答案为:不可行; 碳酸氢钾的溶解度较大,降温过程中不会析出碳酸氢钾晶体. 16、答案:(1)6;1;6;3;坩埚; (2)NH4Cl;CO2; (3)CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3; (4)AC. 解:尿素的熔点是132.7℃,常压下超过160℃即可分解,三聚氰胺的熔点是354℃,加热易升华,微溶于水,尿素在一定条件下分解生成三聚氰胺和氨气、二氧化碳,饱和食盐水加入联氨系统沉淀池,所以产品1为三聚氰胺;从联氨系统沉淀池中得到的母液中含有氯化铵,得到的沉淀是碳酸氢钠,煅烧碳酸氢钠得到二氧化碳,所以产品2是NH4Cl、产品3是Na2CO3、X是CO2, (1)根据原子守恒配平方程式为6CO(NH2)2 C3N6H6+6NH3↑+3CO2↑,在实验室使尿素熔化的容器的名称是坩埚,故答案为:6;1;6;3;坩埚; (2)通过以上分析知,产品2是NH4Cl,X是CO2,故答案为:NH4Cl;CO2; (3)联氨系统沉淀池中发生反应生成氯化铵和碳酸氢钠,反应方程式为CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3,故答案为:CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3; (4)要从母液中析出更多的碳酸氢钠,根据反应CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3,可以增大反应物浓度,所以可以向溶液中加入氯化钠或者通入二氧化碳气体, 故选AC. 17、答案:(1)原料丰富;运输方便; (2)CO2;NH3;是;氨气在水中的溶解度大,先通氨气后通二氧化碳产生碳酸氢铵多,有利于碳酸氢钠的析出; (3)NH4HCO3+NaCl═NaHCO3↓+NH4Cl; (4)循环Ⅰ;做肥料. (1)天津位于沿海地区交通发达,而制碱的原料之一NaCl,在海水中含量丰富, 故答案为:原料丰富;运输方便; (2)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是二氧化碳和氨气;二氧化碳在水溶液中溶解度小,生成碳酸氢钠少,不能析出晶体,而氨气在水中的溶解度大,先通氨气后通二氧化碳产生碳酸氢铵多,有利于碳酸氢钠的析出; 故答案为:CO2;NH3;是;氨气在水中的溶解度大,先通氨气后通二氧化碳产生碳酸氢铵多,有利于碳酸氢钠的析出; (3)氨化的饱和氯化钠溶液中通入过量二氧化碳,发生反应二氧化碳和氨水反应生成碳酸氢铵,碳酸氢铵和氯化钠反应,由于碳酸氢钠溶解度小,所以先生成碳酸氢钠晶体析出,反应方程式为:NH4HCO3+NaCl═NaHCO3↓+NH4Cl, 故答案为:NH4HCO3+NaCl═NaHCO3↓+NH4Cl; (4)碳酸氢钠能溶于水,析出晶体后的溶液中还含有较多碳酸氢钠,所以要循环利用,从母液中有NH4Cl可以做肥料, 故答案为:循环Ⅰ;做肥料. 18、答案:(1)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;NH3;氮肥; (2)2CuS+3O22CuO+2SO2;3×l05; (3)S2O52﹣+2H+=2SO2↑+H2O; (4)CuSO4·5H2O;CO2; (5)2:1;①④⑤. 解:(1)流程确定反应物为NaCl、NH3、CO2,产物为NH4Cl和碳酸氢钠,反应Ⅰ的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,反应Ⅰ进行时应先通入氨气,增大HCO3﹣的浓度,便于NaHCO3析出,氯化铵常用作氮肥, 故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;NH3;氮肥; (2)硫化铜灼烧一定生成氧化铜和二氧化硫,反应的化学方程式为:2CuS+3O22CuO+2SO2,在该反应中每产生2mol二氧化硫则转移12mol电子,所以生成SO21.12×l06 L即5×l04 mol,则转移电子3×l05 mol 故答案为:2CuS+3O22CuO+2SO2;3×l05; (3)根椐提示可知生成二氧化硫和水,Na2S2O5与稀硫酸反应放出SO2和水,反应的离子方程式为:S2O52﹣+2H+=2SO2↑+H2O, 故答案为:S2O52﹣+2H+=2SO2↑+H2O; (4)上述分析可知,氧化铜与硫酸反应生成硫酸铜,蒸发浓缩,冷却结晶,过滤洗涤,得出硫酸铜晶体,副产品X的化学式是CuSO4·5H2O,根据流程图可知,可循环使用的物质是CO2, 故答案为:CuSO4·5H2O;CO2; (5)从生产过程可以看出是硫酸铜晶体;从图示中可以看出二氧化碳和水可以再次利用,反应Ⅱ中气体与固体分别是二氧化硫和碳酸钠,这两种物质反应必须生成亚硫酸氢钠:反应Ⅱ中反应应是二氧化硫与碳酸钠反应生成NaHSO3,NaHSO3再生成Na2S2O5,反应方程式为Na2CO3+2SO2+H2O=2NaHSO3+CO2,因此气体与固体的物质的量之比为:2:1,检验产品中含有碳酸钠杂质,需加酸反应检验二氧化碳生成,即用的澄清石灰水,但加酸会生成二氧化硫,二氧化硫也能使澄清石灰水变浑浊,故应先除去,用酸性高锰酸钾溶液根据颜色不褪色确定二氧化硫除净,故选①④⑤, 故答案为:2:1;①④⑤. 19、答案:(1) CaCO3+2NaCl═Na2CO3+CaCl2;0.49; (2) 原子利用率低;产生了不易处理的副产物氯化钙; (3) 侯德榜; (4) 造气;CH4+2H2O=4H2+CO2;净化;CO+H2O=CO2+H2. 解:(1)氨碱法生产过程中,母液中加入氧化钙反应生成氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气; NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;CaCO3═CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;2NaHCO3═Na2CO3+H2O+CO2↑; 合并得到总化学方程式为:CaCO3+2NaCl═Na2CO3+CaCl2; 原子利用率===0.49; 故答案为:CaCO3+2NaCl═Na2CO3+CaCl2;0.49; (2) 根据氨碱法的反应方程式和联合制碱法的反应方程式可知:索尔维制碱法原子利用率低,产生了不易处理的副产物氯化钙, 故答案为:原子利用率低;产生了不易处理的副产物氯化钙; (3)设计联合制碱法的我国化工专家是侯德榜,故答案为:侯德榜; (4)原料Ⅲ中的CO2来自合成氨,分为两个步骤:一造气,其反应方程式为CH4+2H2O=4H2+CO2;二净化,除去CO,其反应方程式为CO+H2O=CO2+H2, 故答案为:造气;CH4+2H2O=4H2+CO2;净化;CO+H2O=CO2+H2. 20、答案:(1)饱和食盐水;NH3;CO2; (2)CO2;NH4Cl; (3)NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3; (4)CO2;NaCl; (5)过滤、重结晶; (6)0.375mol/L. (1)制取碳酸氢钠时先要得到含氨的饱和食盐水,所以应先通入氨气,氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵, 故答案为:饱和食盐水;NH3;CO2; (2)碳酸氢钠加热分解生成二氧化碳气体,即X为二氧化碳,由反应流程得知:母液中主要副产物是氯化铵,故Y是NH4Cl,故答案为:CO2;NH4Cl; (3)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,故答案为:NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3; (4)此流程可知:CO2和NaCl能被重复利用,故答案为:CO2;NaCl; (5)分离固体与液体采用过滤的方法,从溶液中得到固体采用重结晶的方法,故答案为:过滤、重结晶; (6)若取10.5g NaHCO3固体物质的量==0.125mol,加热了t1 min后,剩余固体的质量为7.4g.依据化学方程式存在的质量变化计算: 2NaHCO3=Na2CO3+CO2↑+H2O△m 2 1 62 0.1mol 0.05mol 10.5g﹣7.4g 反应后NaHCO3物质的量=0.125mol﹣0.1mol=0.025mol;NaHCO3+HCl=NaCl+H2O+CO2↑;消耗氯化氢物质的量0.025mol; Na2CO3物质的量=0.05mol,Na2CO3+2HCl=2NaCl+H2O+CO2 ↑,消耗氯化氢物质的量0.1mol; 剩余氯化氢物质的量=0.200L×1mol/L﹣0.025mol﹣0.1mol=0.075mol,剩余溶液中c(H+)==0.375mol/L, 故答案为:0.375mol/L. 查看更多