【化学】河北省辛集中学2020届高三上学期第一次月考(解析版)
河北省辛集中学2020届高三上学期第一次月考
可能用到的相对原子质量:H-1,O-16,Na-23,Cl-35.5,K-39,Fe-56。
一、选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.根据化学反应的实质是旧键断裂新键形成这一现实,下列变化不属于化学反应的是( )
A. 白磷在260℃时转化为红磷 B. 石墨在高温下转化为金刚石
C. NaCl熔化 D. 五氧化二磷吸水
【答案】C
【详解】A.白磷在260℃时转化为红磷,既有旧化学键断裂,又有新化学键形成,A错误;
B.石墨在高温下转化为金刚石,既有旧化学键断裂,又有新化学键形成,B错误;
C.NaCl熔化属于物理过程,只存在旧键的断裂,没有新键生成,C正确;
D.五氧化二磷吸水生成偏磷酸或磷酸,既有旧化学键断裂,又有新化学键形成,D错误;
故选C。
2.设NA为阿伏加德罗常数的数值。下列叙述正确的是( )
A. 0.1mol C2H5OH分子中含C-H键数为0.6NA
B. 由H218O与D216O组成的2.0g物质所含中子数为NA
C. 25℃,1L pH=13的Ba(OH)2溶液中OH-数为0.2NA
D. 密闭容器中,2mol SO2和1mol O2催化反应后分子总数为2NA
【答案】B
【详解】A.1个C2H5OH 中含有5个C-H键,则0.1mol C2H5OH分子中含C-H键数为0.5NA,A错误;
B.H218O与D216O相对分子质量都是20,由H218O与D216O组成的2.0g物质,物质的量为0.1mol,由于每种物质分子中都含有10个中子,所以0.1mol的分子中所含中子数为NA,B正确;
C.pH=13的氢氧化钡溶液中氢氧根的浓度为0.1mol/L,则1L溶液中含有的氢氧根的物质的量为0.1mol,OH-个数为0.1NA个,C错误;
D.SO2和O2催化氧化反应是可逆反应,反应物不能完全转化为生成物,所以密闭容器中,2mol SO2和1mol O2催化反应后分子总数小于2NA,D错误;
故合理选项B。
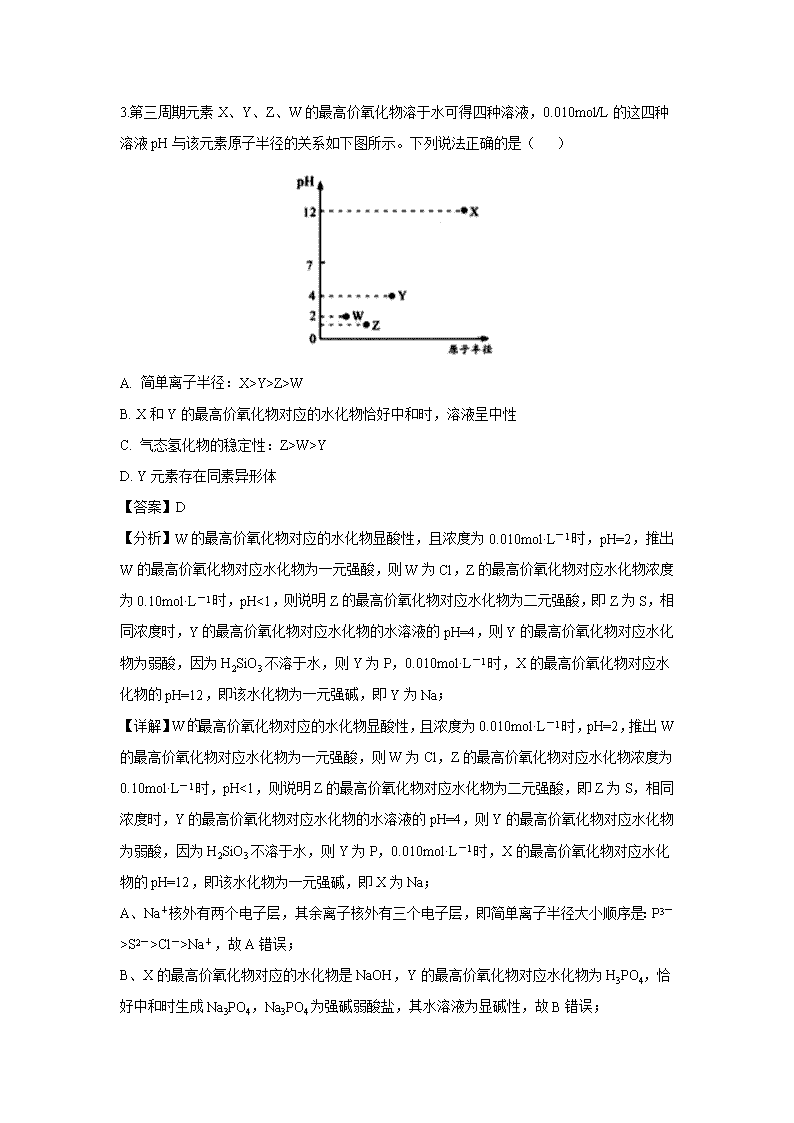
3.第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是( )
A. 简单离子半径:X>Y>Z>W
B. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
C. 气态氢化物的稳定性:Z>W>Y
D. Y元素存在同素异形体
【答案】D
【分析】W的最高价氧化物对应的水化物显酸性,且浓度为0.010mol·L-1时,pH=2,推出W的最高价氧化物对应水化物为一元强酸,则W为Cl,Z的最高价氧化物对应水化物浓度为0.10mol·L-1时,pH<1,则说明Z的最高价氧化物对应水化物为二元强酸,即Z为S,相同浓度时,Y的最高价氧化物对应水化物的水溶液的pH=4,则Y的最高价氧化物对应水化物为弱酸,因为H2SiO3不溶于水,则Y为P,0.010mol·L-1时,X的最高价氧化物对应水化物的pH=12,即该水化物为一元强碱,即Y为Na;
【详解】W最高价氧化物对应的水化物显酸性,且浓度为0.010mol·L-1时,pH=2,推出W的最高价氧化物对应水化物为一元强酸,则W为Cl,Z的最高价氧化物对应水化物浓度为0.10mol·L-1时,pH<1,则说明Z的最高价氧化物对应水化物为二元强酸,即Z为S,相同浓度时,Y的最高价氧化物对应水化物的水溶液的pH=4,则Y的最高价氧化物对应水化物为弱酸,因为H2SiO3不溶于水,则Y为P,0.010mol·L-1时,X的最高价氧化物对应水化物的pH=12,即该水化物为一元强碱,即X为Na;
A、Na+核外有两个电子层,其余离子核外有三个电子层,即简单离子半径大小顺序是:P3->S2->Cl->Na+,故A错误;
B、X的最高价氧化物对应的水化物是NaOH,Y的最高价氧化物对应水化物为H3PO4,恰好中和时生成Na3PO4,Na3PO4为强碱弱酸盐,其水溶液为显碱性,故B错误;
C、非金属性强弱:Cl>S>P,其氢化物的稳定性为HCl>H2S>PH3,故C错误;
D、P的单质有白磷、红磷等,白磷、红磷结构不同,且属于P元素的单质,因此两者互为同素异形体,故D正确。
4.网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构。下列有关辛酸的叙述正确的是( )
A. 辛酸的同分异构体中能水解生成乙醇的酯类同分异构体共有8种
B. 辛酸的同分异构体(CH3)3CCH(CH3)CH2COOH的名称为2,2,3-三甲基戊酸
C. 辛酸和油酸(C17H33COOH)都是一元羧酸,故二者属于同系物
D. 1mol辛酸与足量的Na反应产生11.2L H2
【答案】A
【详解】A.辛酸的分子式为C8H16O2,能水解生成乙醇的同分异构体属于酯类,该同分异构体可写成C5H11-COOC2H5,因戊基(C5H11-)共有8种,所以符合条件的同分异构体共有8种,A项正确;
B.按系统命名法命名时要以包含羧基的最长碳链为主链,以羧基的碳为起点给主链编号,其名称为:3,4,4-三甲基戊酸,B项错误;
C.辛酸(C7H15COOH)的烃基是饱和链烃基,油酸(C17H33COOH)的烃基是不饱和的烯烃基,结构不相似,故二者不属于同系物,C项错误;
D. 1mol辛酸与足量的Na反应产生0.5mol氢气,因题目没有明确是标准状态,无法确定生成氢气的体积,D项错误;
答案选A。
5.在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为( )
A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
【答案】C
【解析】根据氧化性:Fe3+>Cu2+,加入铁后会依次发生氧化还原反应,
Fe+2Fe3+═3Fe2+,②Fe+Cu2+═Cu+Fe2+,
从图象中可知加入2molFe时,发生反应①生成Fe2+物质的量为6mol,反应的Fe3+物质的量为4mol,即FeCl3为4mol;
在加入2molFe的基础上再加入2mol铁发生反应②,此时生成Fe2+物质的量为2mol,原溶液中Cu2+物质的量为2mol,即CuCl2为2mol;同一溶液中浓度之比等于物质的量之比,
所以原溶液中溶液中FeCl3、CuCl2的浓度之比为4mol:2mol=2:1,根据上述分析本题正确答案:故选C.
6.如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是( )
A. 当电路中有1.204×1022个电子转移时,乙烧杯中溶液的c(H+)约为0.1mol•L-1
B. 电池工作时,盐桥中的K+移向甲烧杯
C. 电池工作时,外电路的电子方向是从a到b
D. 乙池中的氧化产物为SO42-
【答案】C
【分析】图中装置为双液原电池,反应中高锰酸钾被还原,在酸性条件下生成Mn2+,甲中电极为原电池的正极,乙中亚氢硫酸钠被氧化,为原电池的负极,被氧化生成SO42-,结合电极方程式解答该题;
【详解】A.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,则当电路中有1.204×1022个电子转移时,即0.02mol电子转移时,乙中生成0.03molH+,c(H+)=0.03mol/0.3L=0.1mol/L,故不选A;
B.甲为正极,电池工作时,阳离子移向正极,故不选B;
C.电池工作时,外电路的电子方向应该从负极到正极,即从b到a,故选C;
D.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,氧化产物为SO42-,故不选D;
答案:C。
【点睛】双液原电池的理解是关键,负极:HSO3--2e-+H2O=SO42-+3H+;正极:MnO4-+8H++5e-=Mn2++4H2O。
7.常温下,现有0.1mol· L-1 NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH 的关系如图所示。下列说法正确的是( )
A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列关系:<1
C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D. 分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
【答案】B
【详解】A、由图像可得,pH=9时,溶液中c(HCO3-)>c(NH3·H2O)>c(CO32-),又因为含氮微粒为NH4+和NH3·H2O,所以NH4+和NH3·H2O分布分数之和应等于1,所以当pH=9时,溶液中存在关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-),故A错误;
B、根据物料守恒,NH4HCO3溶液中存在:①c(NH4+)+c(NH3·H2O)=c(H2CO3)+c(HCO3-)+c(CO32-),又因为0.1mol·L-1NH4HCO3溶液,pH=7.8,所以Kh(NH4+)
c(HCO3-),再结合①式可得:c(NH3·H2O)KN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(4)保持温度不变,在体积为VL恒容容器中以n(H2)∶n(CO2) = 3∶1的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。请在图2中作出容器内混合气体的平均相对分子质量随时间变化的图象_________。
II .利用“ Na—CO2”电池将CO2变废为宝。
我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO22Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
(5)放电时,正极的电极反应式为______________________。
(6)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol e-时,两极的质量差为_________g。
(7)选用髙氯酸钠—四甘醇二甲醚做电解液的优点是___________________________(至少写两点)。
【答案】(1). -127.8 (2). 低温 (3). 根据△G=△H-T△S,△H<0 △S<0,要使反应自发进行使△G<0,需低温下进行。 (4). AC (5).
作图要求:O点坐标(0,12.5),t0平衡时在12.5到20之间,t1时体积瞬间扩大至2VL
时,平衡左移减小,但达到新平衡大于12.5。 (6). 3CO2+4Na++4e-=2Na2CO3+C (7). 15.8 (8). 导电性好、与金属钠不反应、难挥发等特点(合理给分)
【详解】(1)已知H2(g)、C2H4(g)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol,则有:①H2(g)+O2(g)=H2O(l)△H=-285.8kJ/mol;②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;③H2O(g)H2O(1) ΔH = -44.0 kJ/mol,根据盖斯定律 ①×6-②-③×4可得:2CO2(g) +6H2(g)CH2 =CH2(g) +4H2O(g)△H=(-285.8kJ/mol)×6-(-1411.0kJ/mol)-(-44.0 kJ/mol)×4=-127.8kJ/mol;
(2)2CO2(g) +6H2(g)CH2 =CH2(g) +4H2O(g)△H=-127.8 kJ/mol,反应的△H<0,△S<0,根据△G=△H-T△S,需要△G<0,即低温下反应才能自发进行,故答案为低温;根据△G=△H-T△S,△H<0 ,△S<0,要使反应自发进行使△G<0,需低温下进行;
(3)A、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故A正确;
B.使用催化剂,平衡不移动,温度不变,平衡时CO2的平衡转化率不变,故B错误;
C、设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%,
所以有 6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g)
开始(mol/L) 3 1 0 0
转化 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
所以乙烯的体积分数为×100%=7.7%,故C正确;
D.该反应属于气体的物质的量发生变化的反应,当压强不变时表示已经达到平衡状态,反应中 n( H2)/n(CO2)始终不变,不能证明化学反应已达到平衡状态,故D错误;
故选AC;
(4)反应前混合气体的平均相对分子质量==12.5,所以起点坐标为(0,12.5),随着反应进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,若全部转化为CH2=CH2和H2O平均相对分子质量==20,则t0达平衡时应在区间(12.5,20),t1时将容器体积瞬间扩大至2V L,平衡向逆方向移动,t2时重新达平衡,平均相对分子质量减小,t2达平衡时 应大于12.5,所以图象为,故答案为;
(5)“吸入”CO2时是原电池装置,正极发生还原反应,电极反应式为:4Na++3CO2+4e-═2Na2CO3+C;
(6)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,负极溶解0.1mol钠,质量为4.6g,正极生成0.1mol碳酸钠和0.05mol碳,质量为10.6g+0.6g=11.2g,两极的质量差为4.6g +11.2g=15.8 g;
(7)髙氯酸钠—四甘醇二甲醚做电解液的优点有导电性好、与金属钠不反应、难挥发等特点,故答案为导电性好、与金属钠不反应、难挥发等特点。
【点睛】本题考查本题考查了盖斯定律、化学平衡移动的影响因素、化学平衡计算、电极反应式的书写等知识点,注意把握盖斯定律的应用方法、三段式在化学平衡计算中的灵活应用是解题的关键。本题的易错点是图像的绘制。
11.(1)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质
BN
AIN
GaN
熔点/℃
3000
2200
1700
试从结构的角度分析它们熔点不同的原因___________________________________。
(2)N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)铬原子的最高能层符号是_______,其价电子轨道表示式为____________________。
(4)比较第二电离能Cu_______Zn(填“>”、“=”、“<")。
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在。写出Au2Cl6的结构式__________________________.
(6)已知Zn2+、Au+均能与CN-形成配离子, Zn2+与CN-形成的配离子为正四面体形,Au+与CN-形成的配离子为直线形. 工业上常用Au+和CN-形成的配离子与Zn单质反应来提取Au单质,写出该反应的离子方程式________________________________________________。
【答案】(1). 氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低 (2). 7 (3). CCl4(或SiF4等) (4). N (5). (6). > (7). (8). Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2-
【分析】(1)氮化硼、氮化铝、氮化镓都是原子晶体,原子半径越小,共价键的键长越短,键能越大,熔点越高;
(2)N有7 个电子,每一个电子运动状态均不同,基态氮原子的核外共有7种不同运动状态的电子,与PO43-互为等电子体的分子有CCl4(或SiF4等).
(3)铬原子有4个能层,K、L、M、N,最高能层符号是N,其价电子轨道表示式为;
(4)Cu失去1个电子后形成3d10的稳定结构,故第二电离能大;
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在,说明它是分子晶体;
(6)已知Zn2+、Au+均能与CN-形成配离子, Zn2+与CN-形成的配离子为正四面体形,离子符号为:[Zn(CN)4]2-,Au+与CN-形成的配离子为直线形,离子符号为:[Au(CN)2]-。
【详解】(1)由题中信息可知,氮化硼、氮化铝、氮化镓与金刚石类似,都是原子晶体,原子半径B<Al<Ga,键长依次增大,键能依次降低,熔点依次降低;
(2)N有7 个电子,每一个电子运动状态均不同,基态氮原子的核外共有7种不同运动状态的电子,PO43-是5个原子32个电子,与PO43-互为等电子体的分子有CCl4(或SiF4等).
(3)铬原子有4个能层,K、L、M、N,最高能层符号是N,价电子构型3d54s1,其价电子轨道表示式为;
(4)Cu失去1个电子后形成3d10的稳定结构,故第二电离能大。比较第二电离能:Cu>Zn;
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在。说明它是分子晶体,Au2Cl6的结构式;
(6) Zn2+与CN-形成的配离子为正四面体形,离子符号为:[Zn(CN)4]2-,Au+与CN-形成的配离子为直线形,离子符号为:[Au(CN)2]-, 工业上常用Au+和CN-形成的配离子与Zn单质反应来提取Au单质,写出该反应的离子方程式:Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2-。
12.化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
已知:①气态烃A在标准状况下的密度是1.25g/L;
②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:
RCH2-CHO++H2O
请回答下列问题:
(1)F的名称是____________;G中含有的官能团名称是____________________。
(2)写出D→E的化学方程式_______________________________________________。
(3)A→B的反应类型是_______________;M的结构简式是____________________。
(4)同时满足下列条件的K的同分异构体有_______种(不考虑立体异构)。
①遇FeCl3溶液发生显色反应②能发生银镜反应③除苯环以外不再含有其他环状结构
其中核磁共振氢谱为五组峰的结构简式为___________________。
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。_______________________
【答案】(1). 苯甲醛 (2). 碳碳双键和醛基 (3). +NaOH+NaCl (4). 加成反应 (5). (6). 16 (7). (8). CH3CH2OHCH3CHOCH3CH=CHOCH3CH2CH2CH2OHCH3CH2CH=CH2
【分析】根据气态烃A的密度计算相对分子质量为1.25×22.4=28,得出A为CH2=CH2;A与水发生加成反应生成B (CH3CH2OH);B氧化生成C(CH3CHO);甲苯与氯气发生取代反应生成D();D发生水解反应生成E();E催化氧化生成F();F与C发生题干条件②的反应生成G();G发生银镜反应生成H();H酸化生成K();E与K发生酯化反应生成M(),据此分析问题。
【详解】(1)根据上面分析,F为,名称是苯甲醛;G为,含有的官能团名称是碳碳双键和醛基;
(2)D()发生碱性条件下发生水解反应生成E(),化学方程式 +NaOH+NaCl;
(3)A(CH2=CH2)与水发生加成反应生成B (CH3CH2OH);E与K发生酯化反应生成M();
(4)①遇FeCl3溶液发生显色反应,必有酚羟基②能发生银镜反应,必有醛基③除苯环以外不再含有其他环状结构,同时满足下列条件的K()的同分异构体有16种,分别为:(1)三种官能团-OH、-CH=CH2、-CHO连接苯环,共10种;(2)两种官能团-OH、-CH=CHCHO连接苯环,共3种;(3)两种官能团-OH、-C(CHO)=CH2连接苯环,共三种。其中核磁共振氢谱为五组峰的结构简式为;
(5)根据题干信息可知,可利用醛与醛的反应增长碳链,因此设计路线为CH3CH2OHCH3CHOCH3CH=CHOCH3CH2CH2CH2OHCH3CH2CH=CH2。
【点睛】本题解题关键是利用醛与醛的反应起到增长碳链的作用。