- 2021-08-24 发布 |
- 37.5 KB |
- 75页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习无机化学综合课件(75张)(全国通用)
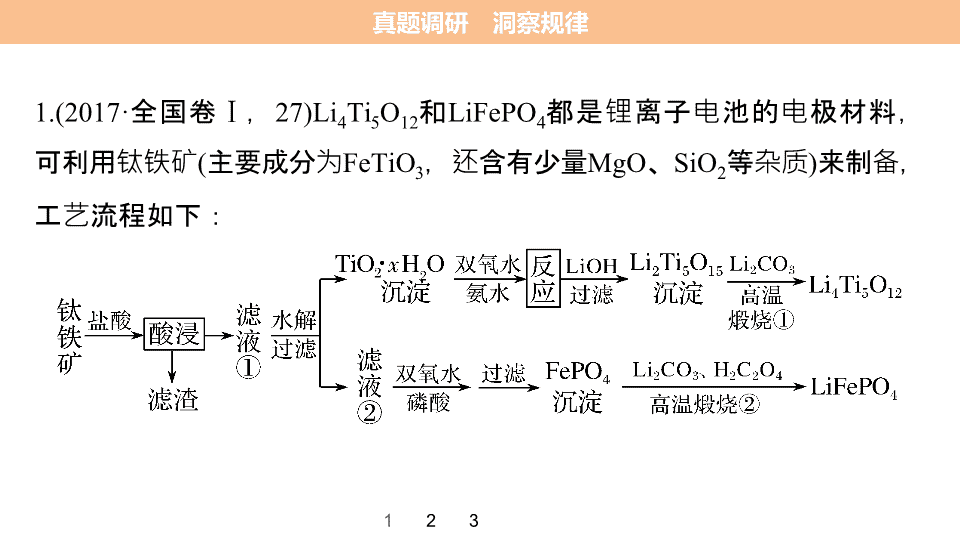
专题一 无机化学综合应用 第二篇 第二部分 高考综合大题 逐题突破 真题调研 洞察规律 热点题型一 以化工流程为载体的综合题 栏目索引 热点题型二 陌生无机物性质的综合考查 真题调研 洞察规律 1.(2017· 全国卷 Ⅰ , 27)Li 4 Ti 5 O 12 和 LiFePO 4 都是锂离子电池的电极材料,可利用钛铁矿 ( 主要成分为 FeTiO 3 ,还含有少量 MgO 、 SiO 2 等杂质 ) 来制备,工艺流程如下: 2 3 1 答案 解析 2 3 1 回答下列问题: (1) “ 酸浸 ” 实验中,铁的浸出率结果如 右 图所示。由图可知,当铁的浸出率为 70% 时,所采用的实验条件为 ___________________ ____ 。 100 ℃ 、 2 h 或 90 ℃ 、 解析 由图示可知,当铁浸出率为 70% 时, 可以采用 100 ℃ 、 2 h ,也可采用 90 ℃ 、 5 h 。 5 h 答案 解析 2 3 1 (2) “ 酸浸 ” 后,钛主要以 形式存在,写出相应反应的离子方程式 ___________________________________________ 。 解析 反应物有 FeTiO 3 ,由生成物有 可知,反应物中还含有 Cl - ,生成物中还有 Fe 2 + ,注意酸性条件,用 H + 平衡电荷,配平。 FeTiO 3 + 4H + + 4Cl - == = Fe 2 + + + 2H 2 O 答案 解析 2 3 1 (3)TiO 2 · x H 2 O 沉淀与双氧水、氨水反应 40 min 所得实验结果如下表所示: 解析 温度低,转化速率慢,单位时间内转化效率低,温度过高, H 2 O 2 分解, NH 3 挥发,导致转化速率慢。注意:取的是相同时间内的转化率。 温度 / ℃ 30 35 40 45 50 TiO 2 · x H 2 O 转化率 /% 92 95 97 93 88 分析 40 ℃ 时 TiO 2 · x H 2 O 转化率最高的原因 ___________________________ __________________________________________________________________________________________ 。 低 于 40 ℃ , TiO 2 · x H 2 O 转化反应 速率随温度升高而增加;超过 40 ℃ ,双氧水分解与氨气逸出导致 TiO 2 · x H 2 O 转化反应速率下降 答案 解析 2 3 1 4 (4)Li 2 Ti 5 O 15 中 Ti 的化合价为+ 4 ,其中过氧键的数目为 ___ 。 解析 由化合物中所有元素化合价代数和为 0 ,有 15 个 O 原子共 22 价,设- 2 价氧原子为 x 个,- 1 价氧原子则为 (15 - x ) 个,有- 2 x - (15 - x ) =- 22 , x = 7 ,则- 1 价 O 原子共 8 个,即有 4 个过氧键。 4 答案 2 3 1 (5) 若 “ 滤液 ②” 中 c (Mg 2 + ) = 0.02 mol·L - 1 ,加入双氧水和磷酸 ( 设溶液体积增加 1 倍 ) ,使 Fe 3 + 恰好沉淀完全即溶液中 c (Fe 3 + ) = 1.0 × 10 - 5 mol·L - 1 ,此时是否有 Mg 3 (PO 4 ) 2 沉淀生成? _______________________________ ____________________________________________________________ ____________________________________________________________ ______________( 列式计算 ) 。 FePO 4 、 Mg 3 (PO 4 ) 2 的 K sp 分别为 1.3 × 10 - 22 、 1.0 × 10 - 24 Fe 3 + 恰好沉淀完全时, = 1.3 × 10 - 17 mol·L - 1 , c 3 (Mg 2 + )· c 2 ( ) 值为 0.01 3 × (1.3 × 10 - 17 ) 2 = 1.7 × 10 - 40 < K sp [ Mg 3 (PO 4 ) 2 ] ,因此不会生成 Mg 3 (PO 4 ) 2 沉淀 答案 解析 2 3 1 (6) 写出 “ 高温煅烧 ②” 中由 FePO 4 制备 LiFePO 4 的化学方程式 _________ ______________________________________________ 。 Li 2 CO 3 + H 2 C 2 O 4 2LiFePO 4 + H 2 O ↑ + 3CO 2 ↑ 解析 反应物为 FePO 4 、 Li 2 CO 3 、 H 2 C 2 O 4 ,生成物有 LiFePO 4 ,铁元素的化合价降低,则 H 2 C 2 O 4 中碳元素的化合价升高,产物为 CO 2 ,配平。 2FePO 4 + 2.(2017· 全国卷 Ⅱ , 26) 水泥是重要的建筑材料。水泥熟料的主要成分为 CaO 、 SiO 2 ,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示: 2 3 1 回答下列问题: (1) 在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是 ________________ ,还可使用 _______ 代替硝酸。 答案 解析 2 3 1 将 Fe 2 + 氧化为 Fe 3 + 双氧水 解析 Fe 3 + 容易在 pH 较小时转化为沉淀,所以需要将 Fe 2 + 氧化为 Fe 3 + 。双氧水可以将 Fe 2 + 氧化为 Fe 3 + 且不会引入杂质。 (2) 沉淀 A 的主要成分是 ______ ,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为 __________________________ 。 答案 解析 2 3 1 SiO 2 + 4HF == =SiF 4 ↑ + 2H 2 O SiO 2 解析 二氧化硅不溶于一般酸性溶液,所以沉淀 A 是二氧化硅。 SiO 2 + 4HF == =SiF 4 ↑ + 2H 2 O 。 (3) 加氨水过程中加热的目的是 _________________________ 。沉淀 B 的主要成分为 ________ 、 ________( 写化学式 ) 。 答案 解析 2 3 1 防止胶体生成,易沉淀分离 解析 加热可以促进 Fe 3 + 、 Al 3 + 水解生成 Fe(OH) 3 、 Al(OH) 3 沉淀。 pH 4 ~ 5 时 Ca 2 + 、 Mg 2 + 不沉淀, Fe 3 + 、 Al 3 + 沉淀,所以沉淀 B 为 Fe(OH) 3 、 Al(OH) 3 。 Fe(OH) 3 Al(OH) 3 (4) 草酸钙沉淀经稀 H 2 SO 4 处理后,用 KMnO 4 标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为 + H + + H 2 C 2 O 4 ― → Mn 2 + + CO 2 + H 2 O 。实验中称取 0.400 g 水泥样品,滴定时消耗了 0.050 0 mol·L - 1 的 KMnO 4 溶液 36.00 mL ,则该水泥样品中钙的质量分数为 ______ 。 答案 解析 2 3 1 45.0% 解析 5Ca 2 + ~ 5H 2 C 2 O 4 ~ 2KMnO 4 , n (KMnO 4 ) = 0.050 0 mol·L - 1 × 36.00 mL × 10 - 3 L·mL - 1 = 1.80 × 10 - 3 mol , n (Ca 2 + ) = 4.50 × 10 - 3 mol , 水泥中钙的 质量分数为 × 100% = 45.0% 。 2 3 1 3.(2017· 天津理综, 7) 某混合物浆液含 Al(OH) 3 、 MnO 2 和少量 Na 2 CrO 4 。考虑到胶体的吸附作用使 Na 2 CrO 4 不易完全被水浸出,某研究小组利用设计的电解分离装置 ( 见下图 ) ,使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答 Ⅰ 和 Ⅱ 中的问题。 Ⅰ . 固体混合物的分离和利用 ( 流程图 中的部分分离操作和反应条件未标明 ) (1) 反应 ① 所加试剂 NaOH 的 电子式为 _______________ , B → C 的反应条件 为 ____________ , C → Al 的制备方法 称为 _______ 。 加热 ( 或煅烧 ) 电解法 答案 解析 2 3 1 解析 由电解装置分析及题目信息可知:阳极电极反应式为 4OH - - 4e - == =2H 2 O + O 2 ↑ ,阴极电极反应式为 4H + + 4e - == =2H 2 ↑ 。混合物浆液中的 Na + 向阴极移动, 向阳极移动,最终混合物浆液中剩余固体混合物为 Al(OH) 3 、 MnO 2 。 由题给流程图知,溶液 A 中含有的溶质为偏铝酸钠、铬酸钠和 NaOH ,通入 CO 2 得到的沉淀 B 为 Al(OH) 3 , Al(OH) 3 受热分解可得到固体 C(Al 2 O 3 ) ,电解熔融的 Al 2 O 3 可得到 Al ;固体 D 为 MnO 2 , MnO 2 可与浓盐酸在加热的条件下生成 Cl 2 。 NaOH 的电子式为 。 B → C 的反应条件为加热 ( 或煅烧 ) , C → Al 的制备方法称为电解法。 2 3 1 (2) 该小组探究反应 ② 发生的条件。 D 与浓盐酸混合,不加热,无变化;加热有 Cl 2 生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生 Cl 2 。由此判断影响该反应有效进行的因素有 ( 填序号 )____ 。 a. 温度 b.Cl - 的浓度 c. 溶液的酸度 答案 解析 2 3 1 ac 解析 由题意 “ 反应 ② 发生的条件。 D 与浓盐酸混合,不加热,无变化,加热有 Cl 2 生成 ” 说明温度对反应有影响;当反应停止后,滴加硫酸,提供 H + ,故反应又开始产生 Cl 2 。由此判断 H + 对反应有影响。综上所述,故选 ac 。 (3)0.1 mol Cl 2 与焦炭、 TiO 2 完全反应,生成一种还原性气体和一种易水解成 TiO 2 · x H 2 O 的液态化合物,放热 4.28 kJ ,该反应的热化学方程式为 ___________________________________________________________ 。 2Cl 2 (g) + TiO 2 (s) + 2C(s) == =TiCl 4 (l) + 2CO(g) Δ H =- 85.6 kJ·mol - 1 答案 解析 2 3 1 解析 由所给数据不难计算,该反应的热化学方程式为 2Cl 2 (g) + TiO 2 (s) + 2C(s) == =TiCl 4 (l) + 2CO(g) Δ H =- 85.6 kJ·mol - 1 。 Ⅱ . 含铬元素溶液的分离和利用 (4) 用惰性电极电解时 , 能 从浆液中分离出来的原因是 ____________ _________________________________________________ , 分离后含铬元素的粒子是 ______________ ;阴极室生成的物质为 __________( 写化学式 ) 。 在直流电场作 用下, 通过阴离子交换膜向阳极室移动 , 脱离浆液 NaOH 和 H 2 答案 解析 2 3 1 热点题型一 以化工流程为载体的综合题 1. 有关化工工艺流程题的考查特点 (1) 围绕核心反应推断陌生物质。 (2) 围绕核心反应或负反应考物质变化及定量关系,陌生方程式与计算是化工流程题的重要组成部分。 (3) 围绕产品纯度考物质的分离提纯 ( 调 pH 、结晶、过滤、洗涤 ) 。 (4) 围绕原料的预处理考影响速率的因素。 (5) 围绕经济原则考循环利用。 高考必备 类型一 物质转化型 2. 解决工业流程题的一般思路 (1) 读题干,找信息和目的。 (2) 看问号,根据具体的问题,找出流程中需重点分析的步骤或环节。 (3) 局部隔离分析,分析加入什么物质,得到什么物质,发生什么反应 ( 或起到什么作用 ) 。 (4) 特别提醒:每个题中基本上都有与流程无关的问题,可直接作答。 典例剖析 明确目的:用什么→制取什么 找准信息:原料、杂质、产品 解题指导 联想碱性氧化物与酸的反应 将 看作金属阳离子 解题指导 解题指导 目标离子存在于溶液中,而 Fe 3+ 、 Al 3+ 则以沉淀形式除去了 电子守恒法计算 阴离子交换, ROH 中的 OH - 被交换下来 解题指导 沉钒煅烧得到 V 2 O 5 ,无化合价的变化,是简单的分解反应 解题指导 经典精练 1. 钼酸钠晶体 (Na 2 MoO 4 ·2H 2 O) 是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿 ( 主要成分是不溶于水的 MoS 2 ) 制备钼酸钠的两种途径如图所示: 答案 2 1 (1)NaClO 的电子式是 ________________ 。 (2) 为了提高焙烧效率,除增大空气的量之外还可以采用的措施是 _______ ______________ 。 答案 2 1 碎 ( 或逆流焙烧 ) 充分粉 (3) 途径 Ⅰ 碱浸时发生反应的化学方程式为 __________________________ ________ 。 答案 解析 2 1 MoO 3 + Na 2 CO 3 == =Na 2 MoO 4 + CO 2 ↑ 解析 利用钼精矿 ( 主要成分是 MoS 2 ) 制备钼酸钠有两种途径:途径 Ⅰ 是先在空气中焙烧生成 MoO 3 ,同时得到对环境有污染的气体 SO 2 ,然后再 用纯碱溶液溶解 MoO 3 ,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体; (4) 途径 Ⅱ 氧化时发生反应的离子方程式为 _________________________ ____________________________ 。 答案 解析 2 1 MoS 2 + 9ClO - + 6OH - == = 解析 途径 Ⅱ 是直接用 NaClO 溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体。 (5) 分析纯的钼酸钠常用四钼酸铵 [ (NH 4 ) 2 MoO 4 ] 和氢氧化钠反应来制取,若将该反应产生的气体与途径 Ⅰ 所产生的尾气一起通入水中,得到的正盐的化学式是 ______________________ 。 答案 解析 2 1 (NH 4 ) 2 CO 3 、 (NH 4 ) 2 SO 3 解析 将 CO 2 和 NH 3 一起通入水中生成的正盐为碳酸铵,化学式为 (NH 4 ) 2 CO 3 ,如果是 SO 2 气体,则生成的正盐为 (NH 4 ) 2 SO 3 。 (6) 钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图: ① 要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度之比应为 _____ 。 答案 解析 2 1 解析 根据图示可知 ,当钼酸钠、月桂酰肌氨酸浓度相等时,腐蚀速率最小,缓蚀效果最好,即浓度比为 1 ∶ 1 。 1 ∶ 1 ② 当硫酸的浓度大于 90% 时,腐蚀速率几乎为零,原因是 _____________ ___________ 。 解析 当硫酸的浓度大于 90% 时,腐蚀速率几乎为零,原因是常温下浓硫酸会使铁钝化,起到防腐蚀作用。 会使铁钝化 常温下浓硫酸 答案 解析 2 1 ③ 试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 ______________________ _______________________ 。 解析 由图示数据可知,碳素钢在盐酸中的腐蚀速率明显快于硫酸中的腐蚀速率;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速率很慢。 Cl - 有利于碳素钢的腐蚀, 答案 解析 2 1 不利于碳素钢的腐蚀 2. 白炭黑 (SiO 2 · n H 2 O) 广泛用于硅橡胶、塑料、油漆涂料等,制备白炭黑的方法主要有两种。 (1) 向硅酸钠溶液中通入热的 HCl 气体来制取白炭黑。 ① 氯化氢的电子式为 _________ 。常温下 Na 2 SiO 3 溶液的 pH___( 填 “ > ” “ < ” 或 “ = ” )7 。 ② 用化学方程式表示该制备原理: _______________________________ ___________________ 。 答案 2 1 > 2HCl + Na 2 SiO 3 + ( n - 1)H 2 O == = SiO 2 · n H 2 O ↓ + 2NaCl (2) 以红土镍矿 ( 含 SiO 2 、 MgO 、 Fe 2 O 3 、 NiO 等 ) 为原料制取白炭黑,其工艺流程如图所示。 ① 步骤 Ⅰ 熔融反应器适宜的材质是 ________( 填 “ 陶瓷 ”“ 玻璃 ” 或 “ 不锈钢 ” ) 。 答案 2 1 不锈钢 ② 步骤 Ⅱ 在稍低于 100 ℃ 时进行水浸的目的是 _____________ 。 ③ 步骤 Ⅳ 通入过量二氧化碳并控制 pH 8 ~ 9 ,碳酸化时发生反应的离子方程式为 _______________________________________________ 。 答案 2 1 加快浸取速率 ④ 向步骤 Ⅴ 过滤得到的滤液中加入石灰乳,发生苛性化反应,会重新生成 NaOH ,该反应的化学方程式为 _____________________________ ______________ 。 ⑤ 步骤 Ⅵ 酸洗后再进行水洗,某同学为加快洗涤速率,将水洗换为用无水酒精洗涤,该同学的操作 _______( 填 “ 正确 ” 或 “ 不正确 ” ) 。 答案 2 1 NaHCO 3 + Ca(OH) 2 == =CaCO 3 ↓ + NaOH + H 2 O 不正确 典例剖析 类型二 分离提纯型 明确目标产品 明确杂质成分 解题指导 解题指导 产品 除杂过程 解题指导 关注关键词,联系影响速率的因素 联想盐与强酸的反应 解题指导 有磁性的物质有哪些? 关注: Ca 2+ 与 不能大量共存 关注: H 2 O 2 的特征性质,要除去的杂质离子的性质 解题指导 陌生物质,联想金属无负价, NaBH 4 为离子化合物 瞻前顾后:①硫酸浸出;②粗硼酸来自镁盐溶液 解题指导 陌生化学反应:①联想硅的制取, Mg 在 CO2 中燃烧;② “ 制备过程 ” 暗示不是一个化学方程式 经典精练 1. 铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体 (CuCl 2 ·2H 2 O) ,为制取纯净的 CuCl 2 ·2H 2 O ,首先将其制成水溶液,然后按如图步骤进行提纯: 已知 Cu 2 + 、 Fe 3 + 和 Fe 2 + 的氢氧化物开始沉淀和沉淀完全时的 pH 如表所 2 1 Fe 3 + Fe 2 + Cu 2 + 氢氧化物开始沉淀时的 pH 1.9 7.0 4.7 氢氧化物完全沉淀时的 pH 3.2 9.0 6.7 请回答下列问题。 (1) 最适合作氧化剂 X 的是 ____( 填字母,下同 ) 。 A . K 2 Cr 2 O 7 B . NaClO C . H 2 O 2 D . KMnO 4 C 答案 解析 解析 氧化剂 X 可以把亚铁离子氧化为铁离子,而不会产生新的杂质,四种物质均可作氧化剂,但过氧化氢作氧化剂时,被还原为水,不会引入新的杂质;而其他 3 种物质作氧化剂,都会引入新的杂质, C 项正确。 2 1 (2) 加入的物质 Y 是 ______ 。 A.CuO B.NaOH C.Cu 2 (OH) 2 CO 3 D.NH 3 解析 加入物质 Y 的目的是调节溶液的 pH ,使铁离子沉淀,而不产生新的杂质,加入氢氧化钠或氨气,也能使铁离子沉淀,但会产生钠离子或铵根离子杂质,所以应选择 CuO 或 Cu 2 (OH) 2 CO 3 , A 、 C 项正确。 答案 解析 2 1 AC (3) 由溶液 Ⅲ 获得 CuCl 2 ·2H 2 O ,需要经过 _________ 、 ________ 、过滤操作。 解析 溶液 Ⅲ 为氯化铜溶液,得到氯化铜晶体,需要蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。 答案 解析 蒸发浓缩 冷却结晶 2 1 (4) 测定溶液 Ⅰ 中 Fe 2 + 的浓度,可用 KMnO 4 标准溶液滴定,取用 KMnO 4 溶液应使用 _____( “ 酸式 ” 或 “ 碱式 ” ) 滴定管。反应的离子方程式: _________________________________________ 。 解析 高锰酸钾的氧化性较强,易腐蚀碱式滴定管的胶管,所以选择酸式滴定管取用高锰酸钾溶液;高锰酸根离子将亚铁离子氧化为铁离子, 自身被还原为锰离子,离子方程式是 + 8H + + 5Fe 2 + == =Mn 2 + + 5Fe 3 + + 4H 2 O 。 + 8H + + 5Fe 2 + == =Mn 2 + + 5Fe 3 + + 4H 2 O 酸式 2 1 答案 解析 2. [ 2016· 全国卷 Ⅲ , 26(2)(3)(4)(5)(6) ] 过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题: ( 一 ) 碳酸钙的制备 2 1 (2) 下图是某学生的过滤操作示意图,其操作不规范的是 ____( 填标号 ) 。 a. 漏斗末端颈尖未紧靠烧杯壁 b. 玻璃棒用作引流 c. 将滤纸湿润,使其紧贴漏斗壁 d. 滤纸边缘高出漏斗 e. 用玻璃棒在漏斗中轻轻搅动以加快过滤速度 答案 ade 解析 2 1 解析 a 项,漏斗末端颈尖未紧靠烧杯壁,容易造成溶液飞溅,错误; b 项,玻璃棒用作引流,正确; c 项,将滤纸湿润,使其紧贴漏斗壁,防止有气泡,正确; d 项,滤纸边缘应低于漏斗口,错误; e 项,用玻璃棒在漏斗中轻轻搅动容易划破滤纸,错误。 2 1 ( 二 ) 过氧化钙的制备 (3) 步骤 ② 的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈 ____( 填 “ 酸 ”“ 碱 ” 或 “ 中 ” ) 性。将溶液煮沸,趁热过滤。将溶液煮沸的作用是 _________________ 。 酸 除去溶液中的 CO 2 解析 步骤 ② 中逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液中含有大量的 CO 2 ,溶液呈酸性,而 CaO 2 溶于酸,故应将溶液煮沸以除去溶解的 CO 2 气体。 答案 解析 2 1 (4) 步骤 ③ 中反应的化学方程式为 _________________________________ _________________________________________________________________________ ,该反应需要在冰浴下进行,原因是 __________________ _____ 。 温度过高时双氧水易 解析 根据题意可知反应物为 CaCl 2 、 H 2 O 2 、 NH 3 ·H 2 O ,产物为 CaO 2 、 NH 4 Cl 和 H 2 O , 则反应的化学方程式为 CaCl 2 + 2NH 3 ·H 2 O + H 2 O 2 == =CaO 2 ↓ + 2NH 4 Cl + 2H 2 O ,由于 H 2 O 2 在高温下易分解,所以反应应在冰浴中进行。 答案 解析 CaCl 2 + 2NH 3 ·H 2 O + H 2 O 2 == =CaO 2 ↓ + 2NH 4 Cl + 2H 2 O( 或 CaCl 2 + 2NH 3 ·H 2 O + H 2 O 2 + 6H 2 O == =CaO 2 ·8H 2 O ↓ + 2NH 4 Cl) 分解 2 1 (5) 将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是 _________________ 。 解析 由于乙醇与水互溶且易挥发,所以使用乙醇洗涤去除晶体表面的水分。 去除晶体表面水分 (6) 制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是 _____________ _ _______ ,产品的缺点是 _________ 。 纯度较低 工艺简单、操 作方便 解析 制备过氧化钙的另一种方法是将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是工艺简单,操作方便,产品的缺点是没有除杂净化工艺,所制得产品纯度低。 答案 解析 2 1 热点题型二 陌生无机物性质的综合考查 1. 题型特点 以元素化合物知识为载体,从素材情境中提取化学问题,将不同知识板块的内容整合和关联进行命题。 包括:物质及其变化的规范表达,物质变化时的定量关系、分析解释、说明理由、概括结论、物质的氧化性和还原性与电化学原理相关联、溶液中的粒子成分与平衡常数相关联等。 高考必备 2. 认识陌生物质的性质的一般思路 特别提醒 认识陌生物质时要特别注意以下三点: (1) 物质变化是复杂的、有条件的,但是可认识的,有规律的。 (2) 概念、原理是严谨的,但不能僵化机械地套用。 (3) 要善于多角度、系统、辨证地看问题;善于用 “ 分类与比较 ” 、 “ 定性与定量 ” 、 “ 宏观与微观 ” 、 “ 量变与质变 ” 、 “ 一般与特殊 ” 等重要化学思想方法分析相关联的问题。 典例剖析 读取信息:还原性 电离方程式的规范表达:从物质分类确定电离情况 解题指导 根据化合价代数和等于 0 计算 物质表示方法的规范表达:根据电子守恒计算氧化产物的化合价 物质分类与性质判断: H 3 PO 2 是一元酸,判断其分类,再根据弱酸性,可知其水解显碱 解题指导 化学方程式的规范表达:根据反应物和生成物以及电子守恒和质量守恒的原子即可写出方程式 解题指导 解题指导 电极反应式的规范表达:阳极实质是水电离的 OH - 放电产生 O 2 解题指导 解释原因:从离子运动、离子共存的角度分析 解题指导 原因解释:从已知信息 H 3 PO 2 的还原性,以及阳极产生氧化剂 O 2 的角度解释 经典精练 1. 铜是与人类关系密切的有色金属。已知:常温下,在溶液中 Cu 2 + 稳定, Cu + 易在酸性条件下发生反应: 2Cu + == =Cu 2 + + Cu 。大多数+ 1 价铜的化合物是难溶物,如 Cu 2 O 、 CuI 、 CuCl 、 CuH 等。 (1) 在新制 Cu(OH) 2 悬浊液中滴入葡萄糖溶液,加热生成不溶物的颜色为 ________ ,某同学实验时却发现有黑色物质出现,这种黑色物质的化学式为 ______ 。 砖红色 CuO 解析 葡萄糖是一个多羟基醛,能与新制 Cu(OH) 2 悬浊液加热反应生成砖红色沉淀 Cu 2 O ,如果加热温度过高,氢氧化铜受热分解成黑色的氧化铜和水。 答案 解析 2 1 (2) 在 CuCl 2 溶液中逐滴加入过量 KI 溶液可能发生: a.2Cu 2 + + 4I - ===2CuI ↓ ( 白色 ) + I 2 b.2Cu 2 + + 2Cl - + 2I - ===2CuCl ↓ ( 白色 ) + I 2 为顺利观察到白色沉淀可以加入的最佳试剂是 ___( 填字母 ) 。 A.SO 2 B. 苯 C.NaOH 溶液 D. 乙醇 2 1 解析 碘水是棕褐色的,会影响白色沉淀的观察,可以用苯把碘单质萃取出来,由于酒精与水以任意比例混溶,因此不能作萃取剂。 答案 解析 B (3) 一定条件下,在 CuSO 4 中加入 NH 5 反应生成氢化亚铜 (CuH) 。 ① 已知 NH 5 是离子化合物且所有原子都达到稀有气体的稳定结构,请写出 NH 5 的电子式: ___________________ 。 2 1 解析 NH 5 的所有原子都达到稀有气体的稳定结构,即氮原子的最外层达到 8 电子稳定结构,所有氢原子达到 2 电子稳定结构,说明 NH 5 是由 和 H - 组成的离子化合物,电子式为 。 答案 解析 ② 写出 CuH 在过量稀盐酸中有气体生成的反应的离子方程式: ___________ ____________________ 。 2 1 解析 CuH 溶解在稀盐酸中, CuH 中的 H - 失电子,盐酸中的 H + 得电子,产生的气体为氢气,酸性溶液中 2Cu + == =Cu 2 + + Cu ,故离子方程式为 2CuH + 2H + == =Cu 2 + + Cu + 2H 2 ↑ 。 答案 解析 == =Cu 2 + + Cu + 2H 2 ↑ 2CuH + 2H + ③ 将 CuH 溶解在适量的稀硝酸中,完成以下化学方程式: ____CuH + ____HNO 3 ===____Cu(NO 3 ) 2 + ____H 2 ↑ + ______ + ______ 2 1 解析 Cu + 在酸性条件下发生反应: 2Cu + ===Cu 2 + + Cu ,稀硝酸具有强氧化性,能把铜氧化为硝酸铜, CuH 具有还原性,因此二者反应生成氢气、一氧化氮气体、铜离子、 H 2 O ,其化学方程式为 6CuH + 16HNO 3 === 6Cu(NO 3 ) 2 + 3H 2 ↑ + 4NO ↑ + 8H 2 O 。 答案 解析 6 16 6 3 4NO ↑ 8H 2 O (4) 常温下,向 0.20 mol·L - 1 的硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的 pH = 6 时, c (Cu 2 + ) = _________________ [ 已知: K sp [ Cu(OH) 2 ] = 2.2 × 10 - 20 ] 。 2 1 答案 解析 2.2 × 10 - 4 mol·L - 1 2. 过二硫酸 ( 结构如图 ) 是一种白色晶体,其酸及盐均为强氧化剂。 答案 2 1 (1)(NH 4 ) 2 S 2 O 8 在水溶液中的电离方程式 __________________________ 。 (2) 在 Ag + 及加热的条件下, 可将溶液中的 Mn 2 + 氧化为 ,该反 应的离子方程式为 _______________________________________________ , 观察到的现象是 _________________ 。 溶液颜色变为紫色 答案 解析 2 1 (3) 由氯磺酸 (ClSO 3 H) 与过氧化氢作用可得固态的过二硫酸,该反应的化学方程式为 __________________________________ 。 2ClSO 3 H + H 2 O 2 == =H 2 S 2 O 8 ↓ + 2HCl ↑ (4) 工业上制备过二硫酸溶液的流程之一如下: 电解时阳极的电极反应式为 ____________________ ,阳极材料能否用铜丝代替铂丝? _____( 填 “ 能 ” 或 “ 不能 ” ) ,说明理由: ______________ __________________________ 。 不能 铜作阳极时本身会失去电子 铜是活性电极, 答案 解析 2 1 本课结束查看更多