- 2021-08-24 发布 |
- 37.5 KB |
- 15页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学鲁科版一轮复习同步练习:第2章 第6讲 氧化还原反应的基本概念和规律
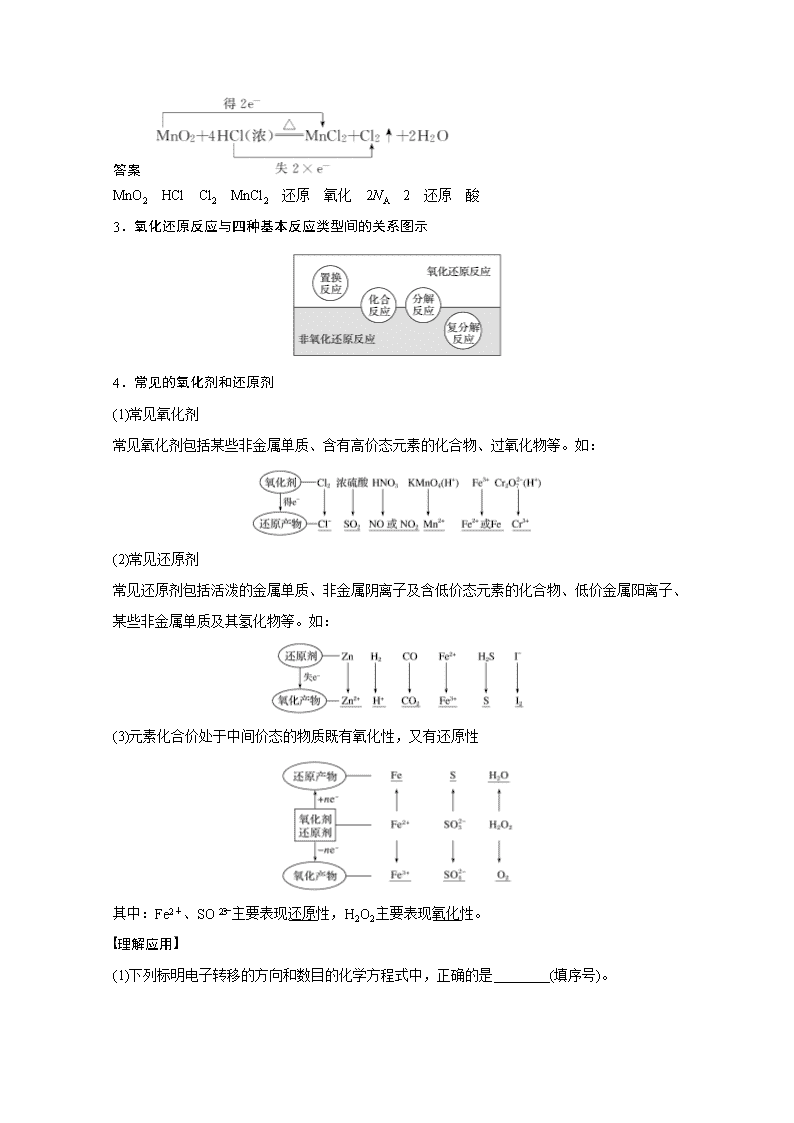
www.ks5u.com 第6讲 氧化还原反应的基本概念和规律 目标要求 1.认识有化合价变化的反应是氧化还原反应,了解氧化还原反应的本质是电子的转移。2.知道常见的氧化剂和还原剂。 1.氧化还原反应的本质和特征 2.基于双线桥理解氧化还原反应概念之间的关系 概括为“升失氧、降得还,剂性一致、其他相反”。 应用体验 用双线桥法标出MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O反应电子转移的方向和数目: ________________________________________________________________________ ________________________________________________________________________。 此反应中氧化剂是__________,还原剂是____________,氧化产物是________,还原产物是________,MnO2发生________反应,HCl发生________反应;生成1 mol Cl2时转移电子数目为________,被氧化的HCl的物质的量是______ mol,盐酸表现的性质是________性和______性。 答案 MnO2 HCl Cl2 MnCl2 还原 氧化 2NA 2 还原 酸 3.氧化还原反应与四种基本反应类型间的关系图示 4.常见的氧化剂和还原剂 (1)常见氧化剂 常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。如: (2)常见还原剂 常见还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如: (3)元素化合价处于中间价态的物质既有氧化性,又有还原性 其中:Fe2+、SO主要表现还原性,H2O2主要表现氧化性。 理解应用 (1)下列标明电子转移的方向和数目的化学方程式中,正确的是________(填序号)。 (2)①中MnO2的作用:__________。 ②中Cl2表现的性质:______________________。 ③中氧化产物和还原产物的质量比为________。 ④中氧化剂与还原剂物质的量之比为________。 答案 (1)④ (2)①催化剂 ②氧化性和还原性 ③5∶1 ④2∶1 (1)有单质参加或有单质生成的化学反应一定是氧化还原反应(×) (2)金属阳离子一定只具有氧化性(×) (3)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原(×) (4)氧化还原反应中的反应物,不是氧化剂就是还原剂(×) (5)某元素从游离态变为化合态,该元素可能被氧化也可能被还原(√) (6)置换反应都是氧化还原反应,化合反应可能是氧化还原反应(√) (7)CaO2与水发生氧化还原反应时,CaO2只作氧化剂(×) 题组一 氧化还原反应的判断 1.(2020·固原高三上学期期中联考)下列应用不涉及氧化还原反应的是( ) A.酸雨的形成 B.根瘤菌固氮 C.氨碱法制纯碱 D.电池放电 答案 C 解析 有电子转移的反应是氧化还原反应,酸雨的形成是燃烧含硫、氮化合物引起的,是氧化还原反应;根瘤菌固氮是将氮气转化为化合态的氮;电池放电是氧化还原反应;氨碱法制纯碱的反应是NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+CO2↑+H2O↑,选C。 2.(2018·北京,9)下列实验中的颜色变化,与氧化还原反应无关的是( ) A B C D 实验 NaOH溶液滴入FeSO4溶液中 石蕊溶液滴入氯水中 Na2S溶液滴入AgCl浊液中 热铜丝插入稀硝酸中 现象 产生白色沉淀,随后变为红褐色 溶液变红,随后迅速退色 沉淀由白色逐渐变为黑色 产生无色气体,随后变为红棕色 答案 C 解析 C项,向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,发生沉淀的转化,反应的离子方程式为2AgCl+S2-Ag2S+2Cl-,与氧化还原反应无关;A项,NaOH溶液滴入FeSO4溶液中,会生成Fe(OH)2白色沉淀,Fe(OH)2被氧化为Fe(OH)3,反应过程中出现灰绿色,最后变为红褐色,与氧化还原反应有关;B项,由于氯水显酸性,先使紫色石蕊溶液变红,后由于HClO具有氧化性, 使红色溶液迅速退色,与氧化还原反应有关;D项,热铜丝插入稀硝酸中发生的反应为3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,NO被氧气氧化生成红棕色的NO2,与氧化还原反应有关。 题组二 基于“双线桥”分析氧化还原反应(不定项选择题) 3.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4===3N2+4H2O,反应温度可高达2 700 ℃,对于该反应,下列说法中正确的是( ) A.该反应属于置换反应 B.N2H4是氧化剂 C.N2O4是还原剂 D.N2既是氧化产物,又是还原产物 答案 D 解析 该反应的反应物中无单质,不属于置换反应,A错;N2H4中N元素的化合价为-2,在反应中失电子变为0价,因此N2H4是还原剂,B错;N2O4中N元素的化合价为+4,在反应中得到电子变为0价,因此N2O4是氧化剂,C错;-2价的N和+4价的N均生成0价的N,因此N2既是氧化产物又是还原产物,D对。 4.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O+O2+4OH-===Fe3O4↓+S4O+2H2O。下列说法不正确的是( ) A.参加反应的氧化剂与还原剂的物质的量之比为1∶5 B.若有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol C.每生成1 mol Fe3O4,反应转移的电子为2 mol D.O2是氧化剂,S2O与Fe2+是还原剂 答案 AC 解析 反应中3Fe2+→Fe3O4,当3 mol Fe2+参加反应时,有2 mol Fe2+化合价升高,反应中Fe和S元素的化合价升高,Fe2+、S2O被氧化,作还原剂,O2为氧化剂,参加反应的氧化剂与还原剂的物质的量之比为1∶(2+2)=1∶4,A项错误、D项正确;若有2 mol Fe2+被氧化,失去2 mol电子,则被Fe2+还原的O2的物质的量为0.5 mol,B项正确;反应中3Fe2+→Fe3O4,2S2O→S4O,当3 mol Fe2+参加反应时,有2 mol Fe2+化合价升高,S元素由+2价升高到+价,所以每生成1 mol Fe3O4,反应转移的电子为4 mol,C项错误。 5.(2019·山东日照期中)在好氧菌和厌氧菌作用下,废液中NH能转化为N2(g)和H2O(l),示意图如下: 反应Ⅰ:NH+O2―→NO+H++H2O(未配平) 反应Ⅱ:NH+NO―→N2+H2O+H+(未配平) 下列说法正确的是( ) A.两池发生的反应中,氮元素只被氧化 B.标准状况下,反应Ⅱ中生成8.96 L N2时,转移电子1.5 mol C.好氧菌池与厌氧菌池投入废液的体积之比为3∶5时,NH能完全转化为N2 D.反应Ⅱ中氧化剂与还原剂物质的量之比为5∶3 答案 BC 解析 反应Ⅱ中NO作氧化剂,N元素的化合价降低,被还原,A项错误;配平反应方程式得反应Ⅰ为NH+2O2===NO+2H++H2O,反应Ⅱ为5NH+3NO===4N2↑+2H++9H2O。好氧菌池产生NO,厌氧菌池消耗NO,则好氧菌池和厌氧菌池投入的废液体积之比为3∶5时,NH能完全转化为N2,C项正确;反应Ⅱ中氧化剂与还原剂物质的量之比为3∶5,D项错误。 走好关键第一步——正确标出元素化合价 正确分析氧化还原反应中电子转移的数目,其前提是确定物质中各元素(特别是变价元素)的化合价。基本方法是先标出熟悉元素的化合价,再根据化合物中正、负化合价的代数和为零的原则求解其他元素的化合价。常见元素的化合价可以借助化合价口诀来记忆:一价氢、钾、钠、氟、氯、溴、碘、银;二价氧、钙、钡、镁、锌;三铝、四硅、五价磷;说变价也不难,二三铁、二四碳、二四六硫都齐全;铜汞二价最常见。 近几年高考中一些特殊物质中元素化合价判断 CuFeS2 Cu+2 Fe+2 S-2 K2FeO4 Fe+6 Li2NH N-3 LiNH2 N-3 AlN N-3 Na2S2O3 S+2 MO M+5 C2O C+3 HCN C+2 N-3 CuH Cu+1 H-1 FeO Fe+(8-n) Si3N4 Si+4 N-3 1.氧化性、还原性的判断 (1)氧化性是指得电子的性质(或能力);还原性是指失电子的性质(或能力)。 (2)氧化性、还原性的强弱取决于得、失电子的难易程度,与得、失电子数目的多少无关。如:Na-e-===Na+,Al-3e-===Al3+,但根据金属活动性顺序表,Na比Al活泼,更易失去电子,所以Na比Al的还原性强。 从元素的价态考虑: 最高价态——只有氧化性,如:Fe3+,浓H2SO4,KMnO4等; 最低价态——只有还原性,如:金属单质、Cl-、S2-等; 中间价态——既有氧化性又有还原性,如:Fe2+、S、Cl2等。 2.氧化性、还原性强弱的比较方法 (1)根据化学方程式判断 氧化剂(氧化性)+还原剂(还原性)===还原产物+氧化产物 氧化性:氧化剂>氧化产物; 还原性:还原剂>还原产物。 (2)根据反应条件和产物价态高低进行判断 ①与同一物质反应,一般越易进行,则其氧化性或还原性就越强。如Na与冷水剧烈反应,Mg与热水反应,Al与水加热反应也不明显,所以还原性:Na>Mg>Al;非金属单质F2、Cl2、Br2、I2与H2反应,F2与H2暗处剧烈反应并爆炸,Cl2与H2光照剧烈反应并爆炸,Br2与H2加热到500 ℃才能发生反应,I2与H2在不断加热的条件下才缓慢发生反应,且为可逆反应,故氧化性:F2>Cl2>Br2>I2。 ②当不同的氧化剂作用于同一还原剂时,如果氧化产物价态相同,可根据反应条件的高低进行判断:一般条件越低,氧化剂的氧化性越强,如:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,由上述反应条件的不同,可判断氧化性:KMnO4>MnO2。 当不同氧化剂作用于同一还原剂时,如果氧化产物价态不相同,可根据氧化产物的价态高低进行判断:氧化产物的价态越高,则氧化剂的氧化性越强,如:2Fe+3Cl22FeCl3,Fe+SFeS,则氧化性:Cl2>S。 拓展延伸 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与FeCl3溶液 ⑤Cl2与NaOH溶液 ⑥Fe与HNO3溶液 ⑦Fe与H2SO4溶液 ⑧Na与O2 (1)由于浓度不同而发生不同氧化还原反应的是____________________________________ (填序号,下同)。 (2)由于温度不同而发生不同氧化还原反应的是__________________________________。 (3)氧化还原反应不受浓度、温度影响的是__________。 答案 (1)①③⑥⑦ (2)⑤⑥⑦⑧ (3)②④ 解析 ⑥Fe和浓HNO3常温下钝化,加热继续反应,Fe和稀HNO3反应,HNO3被还原成NO。⑦Fe和浓H2SO4常温下钝化,加热继续反应,Fe和稀H2SO4反应生成FeSO4和H2。 根据影响因素判断氧化性、还原性强弱的方法 (1)浓度:同一种物质浓度越大,氧化性(或还原性)越强。如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3,还原性:浓HCl>稀HCl。 (2)温度:同一种物质,温度越高其氧化性越强。如:热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。 (3)酸碱性:同一种物质,所处环境酸(碱)性越强其氧化性(还原性)越强。 (1)强氧化剂与强还原剂混合不一定能发生氧化还原反应(√) (2)阳离子只有氧化性,阴离子只有还原性(×) (3)元素的非金属性越强,其氧化性越强,相应单质越活泼(×) (4)难失电子的物质一定易得电子(×) (5)含有最高价元素的化合物一定具有强氧化性(×) (6)MnO2不与稀盐酸反应是因为H+浓度小(×) 题组一 氧化性或还原性强弱的比较 1.铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:①Tl3++2Ag===Tl++2Ag+,②Ag++Fe2+===Ag+Fe3+,③Fe+2Fe3+===3Fe2+,下列离子氧化性比较顺序正确的是( ) A.Tl3+>Fe3+>Ag+ B.Fe3+>Ag+>Tl3+ C.Tl+>Ag+>Fe2+ D.Tl3+>Ag+>Fe3+ 答案 D 解析 在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性。 2.(2019·山东烟台期中)碘元素在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇碘单质变蓝,下列说法中正确的是( ) A.向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝 B.途径Ⅱ中若生成1 mol I2,消耗1 mol NaHSO3 C.氧化性的强弱顺序为Cl2>I2>IO D.一定条件下,I-与IO可能生成I2 答案 D 解析 向含I-的溶液中通入少量Cl2,可产生碘单质,所得溶液能使淀粉溶液变蓝,若向含I-的溶液中通入过量Cl2,生成IO,所得溶液不能使淀粉溶液变蓝,A项错误;根据转化关系2IO~I2~10e-,HSO~SO~2e-,可知途径Ⅱ中若生成1 mol I2,消耗5 mol NaHSO3,B项错误;由途径Ⅰ可以知道氧化性:Cl2>I2,由途径Ⅱ可以知道氧化性:I2查看更多