- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
内蒙古集宁一中2019-2020学年高二下学期月考化学试题
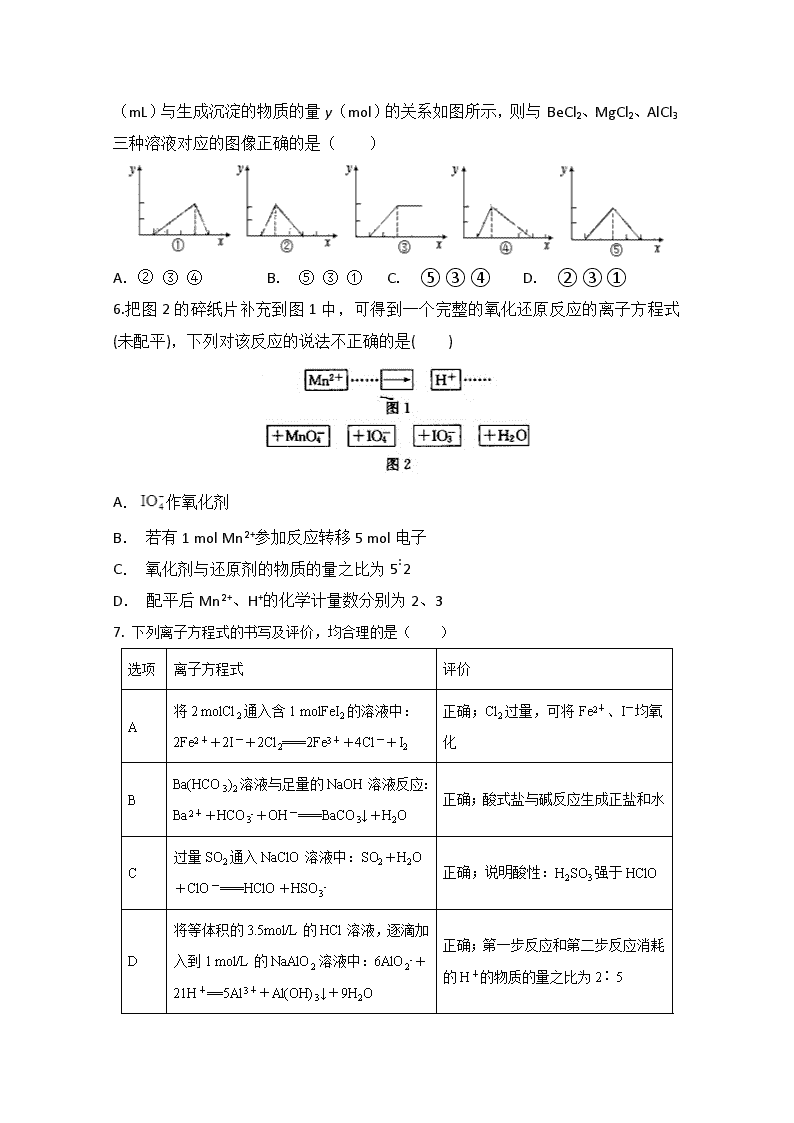
集宁一中2019-2020学年第二学期第二次月考 高二年级化学试卷 可能用到的原子量:O:16 P:31 N:14 Cu:64 K: 39 Cl:35.5 Br:80 第I卷(选择题 共42分) 1.生活环境逐渐恶化,人们日益重视环境问题,下列做法或说法正确的是( ) A. 推广使用无磷洗衣粉,以减少水体富营养化 B. PM2.5是指大气中直径接近于2.5μm(1m=106μm=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 C. 为提高农作物产量大量使用农药和化肥 D. 对农作物秸秆进行焚烧还田,以增加土壤肥力 2.除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及顺序正确的是( ) A. Na2CO3 AgNO3 HNO3 B. AgNO3 Na2CO3 HCl C. AgNO3 K2CO3 HNO3 D. AgNO3 Na2CO3 HNO3 3.对于某些离子的检验及结论正确的是 ( ) A.加氢氧化钠溶液加热产生的气体使湿润红色石蕊试纸变蓝,原溶液中一定有 B. 加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有Ag+ C.加盐酸有无色气体产生,该气体能使澄清石灰水变浑浊,原溶液中一定有 D. 加入少量的氢氧化钠后溶液中产生白色沉淀,原溶液中一定有Mg2+ 4.有下列变化:①Na2CO3→Na2SiO3,②SiO2→H2SiO3,③Na2SiO3→Na2CO3,④CaO→CaSiO3,其中不能通过一步反应实现的是( ) A. 只有① B. ② ④ C. 只有② D. ③ ④ 5.Be(OH)2是两性的,跟强酸反应时生成Be2+,跟强碱反应时生成。现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液分别滴入三种溶液中至过量,NaOH溶液的体积x (mL)与生成沉淀的物质的量y(mol)的关系如图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图像正确的是( ) A.② ③ ④ B. ⑤ ③ ① C. ⑤ ③ ④ D. ② ③ ① 6.把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平),下列对该反应的说法不正确的是( ) A.作氧化剂 B. 若有1 mol Mn2+参加反应转移5 mol电子 C. 氧化剂与还原剂的物质的量之比为5∶2 D. 配平后Mn2+、H+的化学计量数分别为2、3 7. 下列离子方程式的书写及评价,均合理的是( ) 选项 离子方程式 评价 A 将2 molCl2通入含1 molFeI2的溶液中:2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 正确;Cl2过量,可将Fe2+、I-均氧化 B Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3-+OH-===BaCO3↓+H2O 正确;酸式盐与碱反应生成正盐和水 C 过量SO2通入NaClO溶液中:SO2+H2O+ClO-===HClO+HSO3- 正确;说明酸性:H2SO3强于HClO D 将等体积的3.5mol/L的HCl溶液,逐滴加入到1 mol/L的NaAlO2溶液中:6AlO2-+21H+==5Al3++Al(OH)3↓+9H2O 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶5 第II卷(非选择题 共58分) 8.按要求填空。 (1)在Fe、Fe2+、Fe3+、H+中, ①只有氧化性的是______________________________; ②只有还原性的是______________________________; ③既有氧化性又有还原性的是____________________。 (2) 已知Rx++H+―→RO2+Mn2++H2O变化过程中,0.2 mol Rx参加反应,共转移0.4 mol 电子。 ①反应中的被还原的微粒是________。 ②x=________。 ③参加反应的氢离子的物质的量为________。 9.向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答: (1)a点之前的反应的离子方程式为 。 (2)a点到b点之间的反应的离子方程式是 、 。 (3)c点二氧化碳体积是 L。 (4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为 。 10.甲同学通过查询资料知道,一定浓度的硝酸与镁反应时,可得到二氧化氮、一氧化氮、氮气三种气体。该同学用下列仪器组装装置来直接验证有二氧化氮、一氧化氮生成并制取氮化镁 (假设实验中每步转化均是完全的) 。查阅文献得知: ①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃; ②镁也能与二氧化碳反应; ③氮化镁遇水反应生成氢氧化镁和氨气。 (1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是________________________________。 (2)为实现上述实验目的,所选用的仪器的正确连接方式是A→____________→E,确定还原产物中有二氧化氮的现象是______________________________________,实验中要多次使用装置F,第二次使用F的目的是______________________________________________。 (3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:________________________________。 (4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是______________________________________。 (5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:__________________________。 11.碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。一种焙烧氯化铵和菱锰矿粉制备高纯度碳酸锰的工艺流程如图所示 已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素 ②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表 金属离子 Al3+ Fe3+ Fe2+ Ca2+ Mn2+ Mg2+ 开始沉淀的pH 3.8 1.5 6.3 10.6 8.8 9.6 沉淀完全的pH 5.2 2.8 8.3 12.6 10.8 11.6 回答下列问题: (1)“混合研磨”的作用为_______________________ (2)“焙烧”时发生的主要反应的化学方程式为_________________________________ (3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________ (4)净化除杂流程如下 ①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________ A.(NH4)2S2O8 B.MnO2 C.KMnO4 ②调节pH时,pH可取的范围为_________________ (5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________查看更多