- 2021-08-23 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年江西省上饶市玉山县第一中学高一下学期期中考试试卷 化学(23-36班)(word版)
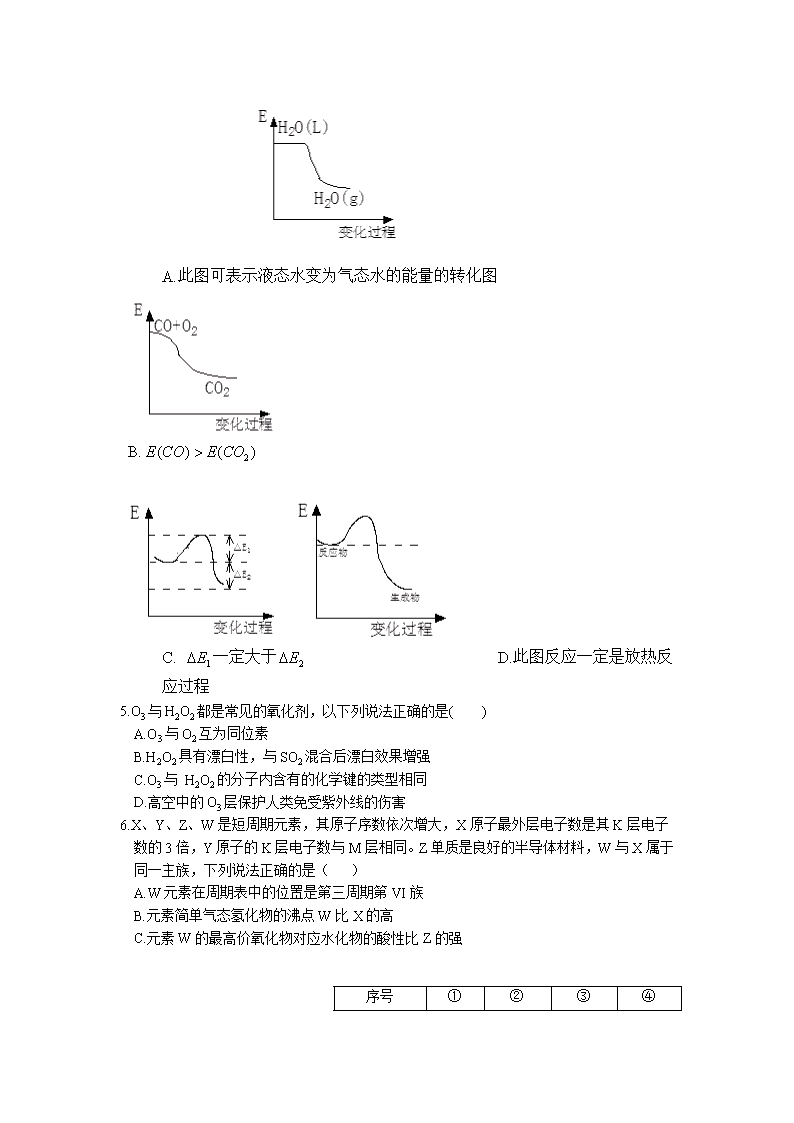
玉山一中2018—2019学年度第二学期高一期中考试 化学试卷(23-36班) 可能用到的相对质量:H-1、C—12、N—14、O-16、Al—37、Fe—56 一、选择题(每小题均只有一个选项符合题意,共16小题,共48分) 1.化学与生活紧密相连,以下现象与化学变化无关的是( ) A.禁放烟花,是为了我们的天空更加明亮。五颜六色的烟花火焰是烟花爆炸发生化学反应的结果 B.利用石墨制备金刚石,是化学变化 C.酒驾是一种极不负责任的危害社会的行为,利用测酒仪可以检测酒精含量 D.我们可以用稀KMnO4溶液对花卉、水果进行保鲜 2.对化学学科的学习从思维角度去看,本质是对化学符号的操控,对以下化学符号的表达,正确的是( ) A.F-的离子结构示意图: B.Na+的电子式: C.NH4Cl的电子式: D.用电子式表示NaOH的形成过程: 3.培养利用多重视角去审视物质及其变化的本质,有利于我们提升对化学知识的理解力。以下说法不正确的是( ) A.从宏观维度去审视化学变化的本质,只看其在变化中是否有新物质产生 B.从微粒观角度,化学变化的本质是原子的重新分配与组合的过程 C.从能量观角度,化学变化的本质是旧键断裂,新键形成的过程 D.从物质能量观角度,能量变化不需要以物质的变化为基础也可以相互转化 4.人类文明的进步,离不开对化学能源的使用,对化学能与热能的转化,以下选项正确的是 ( ) A. 此图可表示液态水变为气态水的能量的转化图 B. C. 一定大于 D.此图反应一定是放热反应过程 5.O3与H2O2都是常见的氧化剂,以下列说法正确的是( ) A.O3与O2互为同位素 B.H2O2具有漂白性,与SO2混合后漂白效果增强 C.O3与 H2O2的分子内含有的化学键的类型相同 D.高空中的O3层保护人类免受紫外线的伤害 6.X、Y、Z、W是短周期元素,其原子序数依次增大,X原子最外层电子数是其K层电子数的3倍,Y原子的K层电子数与M层相同。Z单质是良好的半导体材料,W与X属于同一主族,下列说法正确的是( ) A.W元素在周期表中的位置是第三周期第VI族 B.元素简单气态氢化物的沸点W比X的高 C.元素W的最高价氧化物对应水化物的酸性比Z的强 序号 ① ② ③ ④ 氧化剂 Cl2 KMnO4 KClO3 KMnO4 还原剂 FeBr2 H2O2 HCl(浓) HCl 其他反应物 H2SO4 氧化产物 O2 Cl2 Cl2 还原产物 FeCl3 MnSO4 Cl2 MnCl2 D.化合物YX、ZX2、WX3中化学键类型相同 7.下表是关于四个反应的相关信息, 下列结论正确的是( ) A.①中,反应的氧化产物一定只有FeCl3 B.氧化性比较: KMnO4>Cl2>Fe3+>Br2>Fe2+ C.理论上这四个反应均可设计成原电池 D.③中,反应的还原产物还有KCl 8.化学能向电能的转化,需要原电池装置才能转化,以下对原电池构造的认识和理解正确的是( ) A.原电池的两极材料,除了导电外,也要参与电极反应 B.构成原电池内电路的一定需要电解质溶液 C.自发的氧化还原反应是原电池构造的物质变化基础 D.在构成闭合回路时,电解溶液中的阳离子移向负极 9.已知反应后,的浓度增加0.4mol/L。则下列关于该化学反应的说法错误的是( ) A.由于A为纯固体,物质的量浓度是常数,故无法利用A的相关物理量的变化来表示该反应的速率大小 B.用物质B、C、D来分别表示该反应的速率之比为3:2:1 C.2min末,气体D在标准状况下的体积无法计算 D.单位时间内,每消耗0.3mol B气体,同时消耗0.1 mol D气体,此时该反应达到最大限度 10.在一定条件下,向以恒容密闭容器中充入1mol N2与4mol H2,化学反应,N2+3H2(g) 2NH3(g),当反应达到最大限度时,则下列说法正确的是( ) A. B.此时,该反应的能量变化量为0 C.单位时间内,断裂1molNN,同时断裂2mol N-H D.此时,该反应不一定达到了化学平衡状态 11.我国是燃烧煤大国,对提高煤的燃烧效率的研究有着十分重大的意义,则以下说法不正确的是( ) A.将煤块粉碎后,进行燃烧,有利于提高燃烧效率 B.提高燃煤转化率,关键是燃料与空气或氧气要尽可能充分地接触,且空气要适当过量 C.适当加高燃煤炉膛高度,可以提高燃煤转化率 D.提高煤的燃烧效率,它的意义在于节约能源,节省资源,减少污染 12.燃料电池是一种高效、环境友好的发电装置,其能量转化率理论上可高达85%~90%。以CH4为燃料时, 其燃料电池以融熔CaO为电解质,则以下说法正确的是: (其电池构造如右图所示) A.a极通入O2 B.b极反应方程式: C.该电池中电子的移动方向是由电解质 D.在该电池内部有可能发生 13.已知氧化性Fe3+>Cu2+。为了验证这一结论,以下验证实验和方法正确的是( ) 序号 (选项) 验证方法(实验) A 利用原电池原理、采用的原电池装置为: B 利用单质间的置换反应: C 向溶液中加入片,发现片溶解 D 测定的熔点比的高 14.已知在1L密闭容器中发生2A(s)+3B(g) C(g)+2D(g)。以下说法正确的是( ) A.2min末,测得V(B)=0.3mol/(L•min),此时V(A)=0.2mol/(L•min ) B.当密闭器中压强保持不变时,此时该反应已达到最大限度 C.单位时间内每消耗3NAB分子的同时消耗1mol C分子,则该反应已平衡 D.当时,则该反应已达最大限度 15.对于反应 ,在4min末,测得其在不同时期各物质反应的速率数据发下: ① ②③,则这三个时期速率由大 到小的顺序正确的是( ) A.①>②>③ B②>①>③ C.③>①>② D.②=③>① 16.为了验证,该反应的可逆性,姚秋予同学设计了以下几组实验, 你认为可行的是( )(已知不与碘离子反应) A.取反应后的溶液于试管中,滴加HNO3酸化AgNO3溶液,产生白色沉淀 B.取少量反应后溶液做焰色反应,透过蓝色钴玻璃观察到紫色火焰 C.取少量红色溶液,加入几滴淀粉KI溶液,发现红色变为蓝色。 D.向反应后的溶液滴加FeCl2溶液、发现溶液颜色变浅 二、非选择题(共4小题,共52分) 17.(14分)下表为元素周期表的一部分,根据表中所列出的元素回答下列问题。 族期 周期 IA IIA IIIA IVA VA VIA VIIA 2 3 (1)随着我国太空航天技术的发展,宇航员从某星球收集到一种气体,经检测,该分子的结构与ac2 分子相似,则该分子电子式为_________________. (2)上述元素可用来做半导体材料的是_________(填元素名称),该单质溶于一定浓度的强碱的离子 方程 式为________________________________________. (3)该部分元素周期表中,原子半径最大的是____________(填元素符号)。用该单质在空气中点燃得 到e3b物质,其阴、阳离子半径大小为_________;用电子式表示该物质的形成过程________________。 (4)为了比较该部分周素表中的非金属元素的非金属性强弱,以下说法不正确的是________(多选)。 ①可以利用这些元素的最高价氧化物对应水化物的酸性比较这些元素的非金属性 ②已知j的气态氢化物水溶液的酸性比i的气态氢化物的水溶液酸性强,所以非金属j>i ③已知a单质可从h的最高价氧化物中置换出h,则可说明非金属性a>h ④向i的气态氢化物的水溶液中滴加j单质,发现溶液变浑浊,则可说明i的非金属性弱于j。 18.(14分)从本质入手看物质及其能量的变化,可以让我们更加深入的去理解所学知识的内涵及外延应用。对于《原电池》这部分知识也是如此,如图是原电池的基本构造模型: (1)若Zn+CuSO4=ZnSO4+Cu,将该反应设计成原电池反应时, 负极为__________(填“a”或 ”b”);该极电极方程式 _______________________________________________. (2)若a极材料为Al,b极材料为Mg. ①若电解质为稀NaOH溶液时,则负极材料为______(填“Al”或”Mg”), 该原电池总式为______________________(写离子反应方程式) 。 ②若电解质为浓H2SO4,则该原电池的负极为_________(同上), 该反应的负极反应为________. (3)对于原电池的应用,以下说法正确的是_______(填序号)。 A.选择构成原电池两极材料时,必须选择活泼性不同的两种金属材料 B.构成原电池时,作为负极的材料的活泼性一定比正极材料的强 C.构成原电池时,作为正极材料的金属受到保护 D.从能量转化角度去看,如图的氧化还原反应能量 变化曲线,则不能够设计原电池 19.(10分)将等物质的量的A、B混合于2L的密闭容器中,发生如下反应: ,5min后,测得D的浓度为0.5mol/L,的平均反应速 率为0.1mol/(L·min)。求: (1)X的值为______. (2)A的平均反应速率为__________________. (3)反应开始前=____________mol. (4)以下论据可作为判断该反应已达到化学平衡状态的有______(双选)。 A.密闭容器中的压强保持不变 B. B的物质的量保持不变 C. D.单位时间内每消耗1mol B,同时生成2mol D (5)以下措施不可以加快该化学反应速率的是__________. A.向该容器中充入Ar气体 B.升高温度 C.向该容器中注入A气体 D.加入催化剂 20.(14分)X、Y、Z、W是短周期原子序数依次增大的元素,X的最外层电子数等于电子层数等于原子序数。Y是构成有机物骨架的核心元素,W的最外层电子数是次外层电子数的3倍。则完成下列问题: I. X_________Y__________Z__________W___________(填元素名称) II.以下是由上述元素组成的单质及其化合物间的转化关系图 (1)写出Z2的电子式______________,写出反应②的化学反应方程式_______ ________. (2)在一密闭的容器中,发生反应①,以下能说明该反应已达到最大反应 限度(平衡状态)的是___________(双选). A.单位时间内断开键,同时断开键 B. C. D.容器中的总压强保持一定 (3)若将设计成原电池,选择为电解液,则原电池的正极反方程式为 ___________;若外导线中通过0.2mol的电子时,则消耗的在标准状况下的体积为 . 高一化学23—36班参考答案 一、选择题(每小题3分,共48分) 1—5:ACDDD 6—10:CCCAB 11—16:CBCCDC 二、非选择题(包括4小题,共52分) 17.(14分) 18.(14分) 19.(10分) 20.(14分)查看更多