- 2021-08-23 发布 |
- 37.5 KB |
- 5页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年山西省朔州市怀仁一中高一上学期第一次月考化学试卷
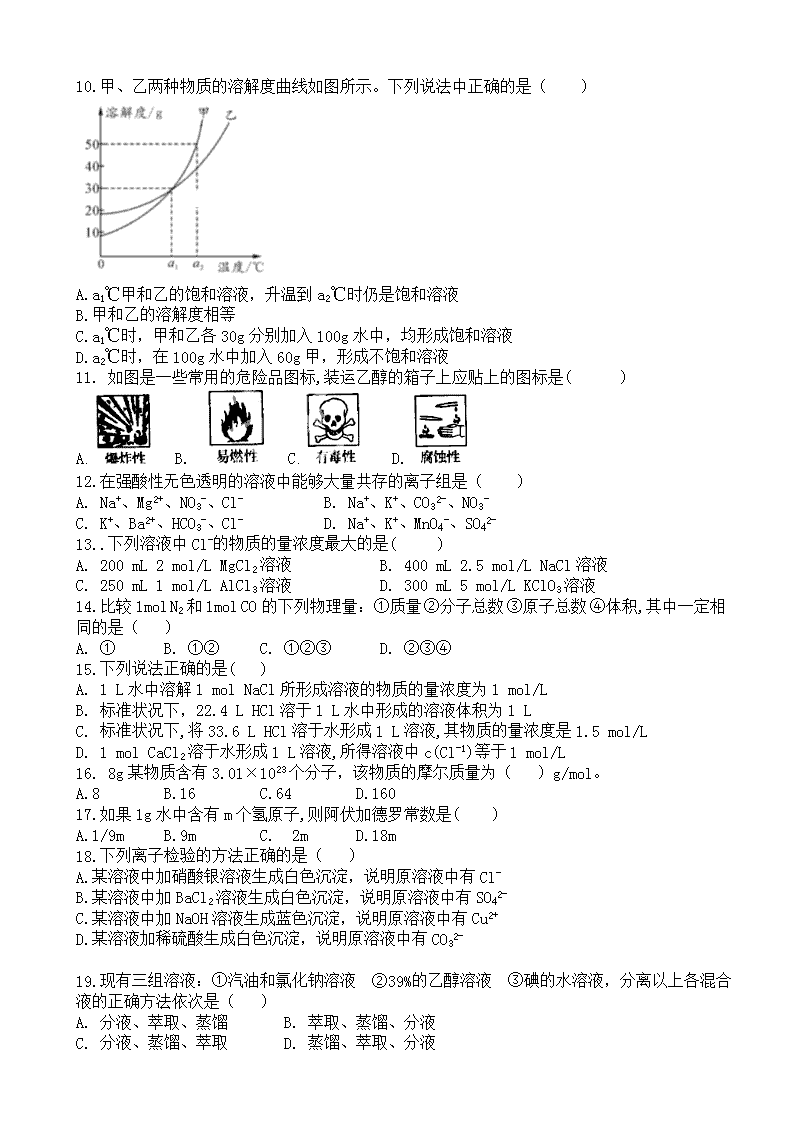
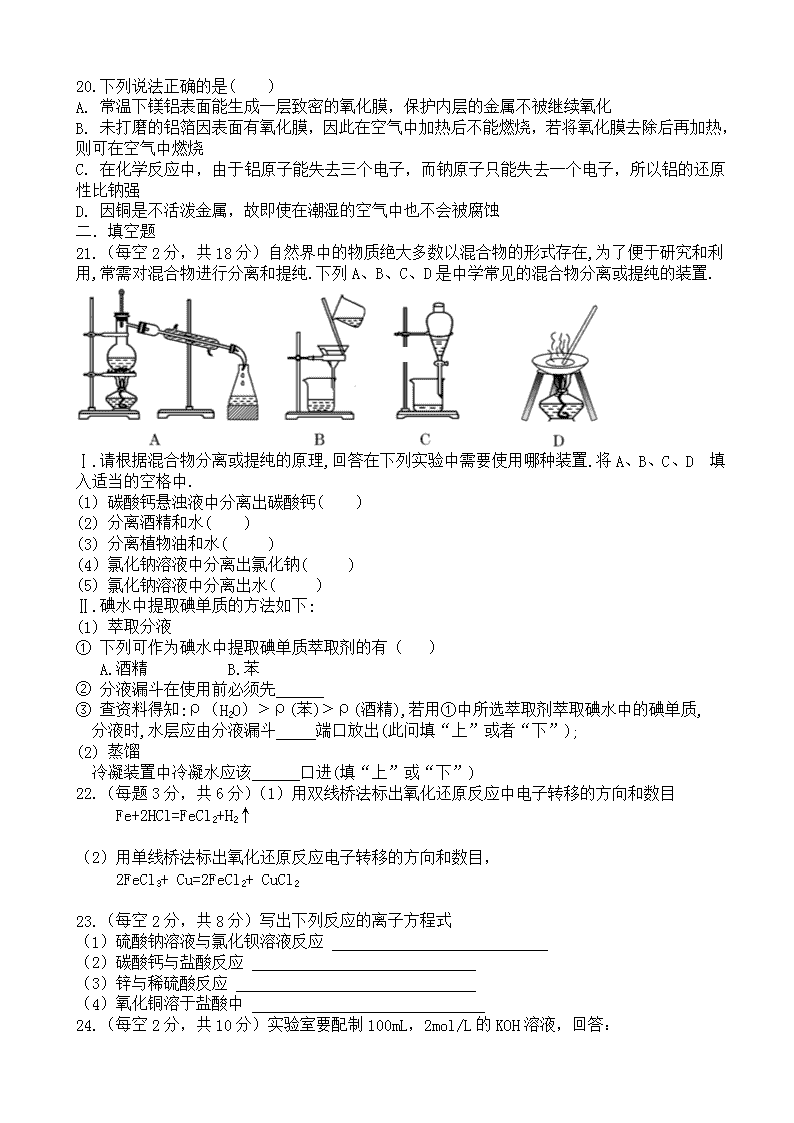
2019-2020学年度高一上学期 第一次化学检测 满分100分 时间60分钟 一.选择题(每小题只有一个正确选项,1-10每题2分,共20分;11-20每题3分,共30分) 1.某无土栽培所需的营养液成分是含有N、P、K、Ca等元素的无机盐,该配方适用于苦瓜、黄瓜、生菜的种植。可作营养液成分的是( ) A. P2O5 B. KOH C. NH4Cl D. CaCO3 2.生活中的自来水通常用氯气(Cl2) 进行杀菌消毒处理,发生反应的化学方程式是Cl2+H2O=X+HClO,则X的化学式为( ) A. H2 B. ClH C. HCl D. ClO2 3.1869 年门捷列夫编制了元素周期表。硫元素也排列其中,其化合价分别为-2、 0、+4、+6 价,依次对应的化学式错误的是( ) A. H2S B. S C. SO2 D. H2SO3 4.如图所示是某些粒子的结构示意图,下列有关表达不正确的是( ) A. 化学性质相似的是乙、丁 B. 具有相对稳定结构的是甲 C. 表示同种元素的是甲、丙 D. 甲是稀有气体元素 5.下列关于氢氧化钠的描述中错误的是( ) A.易溶于水,溶解时放出大量的热 B.对皮肤有强烈的腐蚀作用 C.水溶液能使石蕊试液变红 D.能去除油污,可作厨房的清洁剂 6.下列有关原子的说法中正确的是( ) A.原子的质量主要集中在质子和电子上 B.原子都是由质子、中子和核外电子构成的 C.原子的类别是由原子核内的质子数所决定的 D.原子中不存在带电微粒,因而整个原子不显电性 7.下列各图中●和分别表示不同元素的原子,则其中表示混合物的是( ) 8.金刚石、石墨和C60的化学性质相似,物理性质却有很大差异,其原因是( ) A.金刚石、石墨和C60里碳原子的排列方式不同 B.构成它们的原子数目不同 C.金刚石、石墨和C60由不同种原子构成 D.构成它们的原子大小不同 9.把少量下列物质分别放在水中,充分搅拌,可以得到溶液的是( ) A.面粉 B.氯化银 C.汽油 D.蔗糖 10.甲、乙两种物质的溶解度曲线如图所示。下列说法中正确的是( ) A.a1℃甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液 B.甲和乙的溶解度相等 C.a1℃时,甲和乙各30g分别加入100g水中,均形成饱和溶液 D.a2℃时,在100g水中加入60g甲,形成不饱和溶液 11. 如图是一些常用的危险品图标,装运乙醇的箱子上应贴上的图标是( ) A. B. C. D. 12.在强酸性无色透明的溶液中能够大量共存的离子组是( ) A. Na+、Mg2+、NO3-、Cl- B. Na+、K+、CO32-、NO3- C. K+、Ba2+、HCO3-、Cl- D. Na+、K+、MnO4-、SO42- 13..下列溶液中Cl-的物质的量浓度最大的是( ) A. 200 mL 2 mol/L MgCl2溶液 B. 400 mL 2.5 mol/L NaCl溶液 C. 250 mL 1 mol/L AlCl3溶液 D. 300 mL 5 mol/L KClO3溶液 14.比较1mol N2和1mol CO的下列物理量:①质量 ②分子总数 ③原子总数 ④体积,其中一定相同的是( ) A. ① B. ①② C. ①②③ D. ②③④ 15.下列说法正确的是( ) A. 1 L水中溶解1 mol NaCl所形成溶液的物质的量浓度为1 mol/L B. 标准状况下,22.4 L HCl溶于1 L水中形成的溶液体积为1 L C. 标准状况下,将33.6 L HCl溶于水形成1 L溶液,其物质的量浓度是1.5 mol/L D. 1 mol CaCl2溶于水形成1 L溶液,所得溶液中c(Cl-1)等于1 mol/L 16. 8g某物质含有3.01×1023个分子,该物质的摩尔质量为( )g/mol。 A.8 B.16 C.64 D.160 17.如果1g水中含有m个氢原子,则阿伏加德罗常数是( ) A.1/9m B.9m C. 2m D.18m 18.下列离子检验的方法正确的是( ) A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl- B.某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有SO42- C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+ D.某溶液加稀硫酸生成白色沉淀,说明原溶液中有CO32- 19.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③碘的水溶液,分离以上各混合液的正确方法依次是( ) A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液 C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液 20.下列说法正确的是( ) A. 常温下镁铝表面能生成一层致密的氧化膜,保护内层的金属不被继续氧化 B. 未打磨的铝箔因表面有氧化膜,因此在空气中加热后不能燃烧,若将氧化膜去除后再加热,则可在空气中燃烧 C. 在化学反应中,由于铝原子能失去三个电子,而钠原子只能失去一个电子,所以铝的还原性比钠强 D. 因铜是不活泼金属,故即使在潮湿的空气中也不会被腐蚀 二.填空题 21.(每空2分,共18分)自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯.下列A、B、C、D是中学常见的混合物分离或提纯的装置. Ⅰ.请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置.将A、B、C、D 填入适当的空格中. (1) 碳酸钙悬浊液中分离出碳酸钙( ) (2) 分离酒精和水( ) (3) 分离植物油和水( ) (4)氯化钠溶液中分离出氯化钠( ) (5) 氯化钠溶液中分离出水( ) Ⅱ.碘水中提取碘单质的方法如下: (1) 萃取分液 ① 下列可作为碘水中提取碘单质萃取剂的有( ) A.酒精 B.苯 ② 分液漏斗在使用前必须先 ③ 查资料得知:ρ(H2O)﹥ρ(苯)﹥ρ(酒精),若用①中所选萃取剂萃取碘水中的碘单质, 分液时,水层应由分液漏斗 端口放出(此问填“上”或者“下”); (2) 蒸馏 冷凝装置中冷凝水应该 口进(填“上”或“下”) 22.(每题3分,共6分)(1)用双线桥法标出氧化还原反应中电子转移的方向和数目 Fe+2HCl=FeCl2+H2↑ (2)用单线桥法标出氧化还原反应电子转移的方向和数目, 2FeCl3+ Cu=2FeCl2+ CuCl2 23.(每空2分,共8分)写出下列反应的离子方程式 (1)硫酸钠溶液与氯化钡溶液反应 (2) 碳酸钙与盐酸反应 (3) 锌与稀硫酸反应 (4) 氧化铜溶于盐酸中 24.(每空2分,共10分)实验室要配制100mL,2mol/L的KOH溶液,回答: (1) 一定用不到的仪器是_____(用字母表示) A.烧杯 B.200mL容量瓶 C.量筒 D.胶头滴管 E.玻璃棒 F.100mL容量瓶 (2) 配制时应称取KOH固体的质量为______g, (3) 实验开始时,需检验容量瓶______, (4) 下列操作的顺序是(用字母表示)______________________. A冷却 B称量 C洗涤 D定容 E溶解 F摇匀 G转移 (5) 容量瓶用蒸馏水洗净后未干燥就直接用于配制溶液,对实验结果 (填“有或无”) 影响。 25.(每空2分,共8分)质量相等的CO和CO2,物质的量比为 ,碳原子的原子个数之比为 ,氧原子的原子个数之比为 ,同温同压下CO和CO2气体体积比 。 高一化学参考答案 一.选择题(1-10每题2分,共20分;11-20每题3分,共30分) 1-5 CCDDC 6-10 CBADC 11-15 BAACC 16-20 BBCCA 二.填空题 21.(每空2分,共18分) Ⅰ. B A C D A Ⅱ. B 检漏 下 下 22.(每空3分,共6分) (1) 失2e- Fe+2HCl=FeCl2+H2↑ 得2×e- (2) 2e- 2FeCl3+Cu=2FeCl2+CuCl2 23. (每空2分,共8分) (1)SO42-+Ba2+=BaSO4↓ (2)CaCO3+2H+=Ca2++CO2↑+H2O (3)Zn+2H+=Zn2++H2↑ (4)CuO+2H+=Cu2++H2O 24. (每空2分,共10分) B 11.2 是否漏水 BEAGCDF 无 25. (每空2分,共8分) 11:7 11:7 11:14 11:7查看更多