- 2021-08-23 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习化学能与热能作业(全国通用)(1)
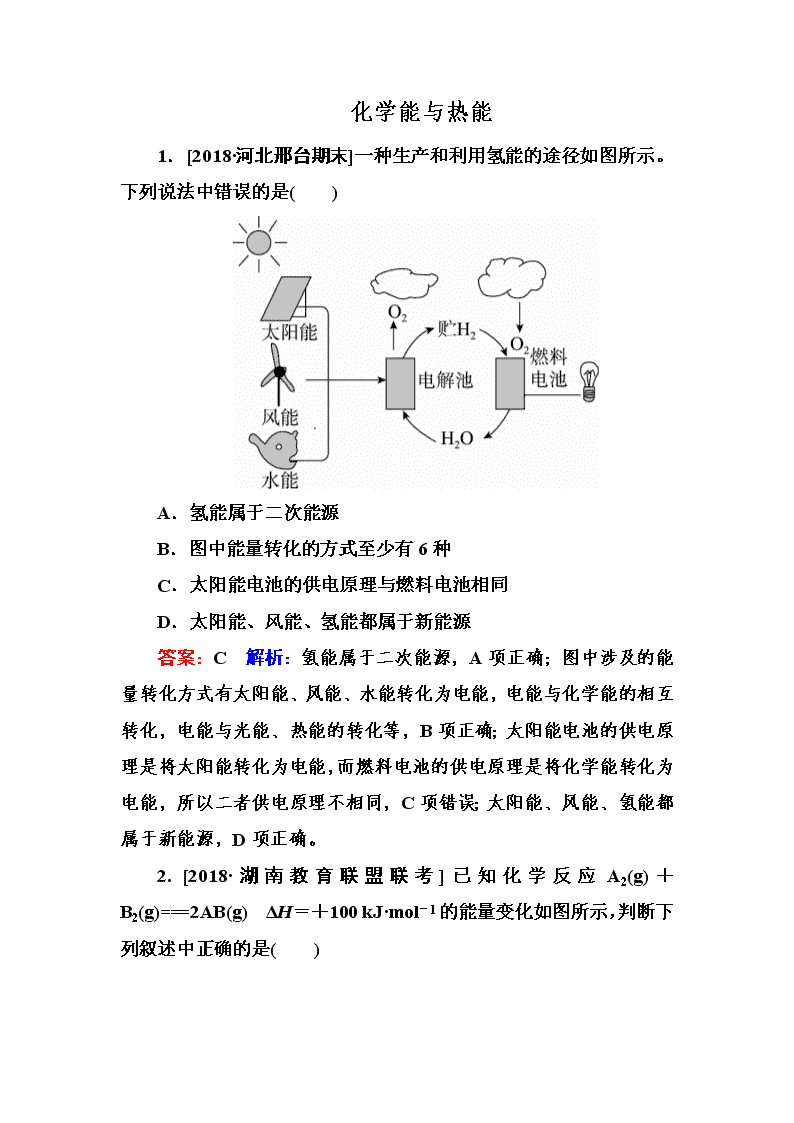
化学能与热能 1.[2018·河北邢台期末]一种生产和利用氢能的途径如图所示。下列说法中错误的是( ) A.氢能属于二次能源 B.图中能量转化的方式至少有6种 C.太阳能电池的供电原理与燃料电池相同 D.太阳能、风能、氢能都属于新能源 答案:C 解析:氢能属于二次能源,A项正确;图中涉及的能量转化方式有太阳能、风能、水能转化为电能,电能与化学能的相互转化,电能与光能、热能的转化等,B项正确;太阳能电池的供电原理是将太阳能转化为电能,而燃料电池的供电原理是将化学能转化为电能,所以二者供电原理不相同,C项错误;太阳能、风能、氢能都属于新能源,D项正确。 2. [2018·湖南教育联盟联考]已知化学反应A2(g)+B2(g)===2AB(g) ΔH=+100 kJ·mol-1的能量变化如图所示,判断下列叙述中正确的是( ) A.加入催化剂,该反应的反应热ΔH将减小 B.每形成2 mol A—B键,将吸收b kJ能量 C.每生成2分子AB吸收(a-b)kJ能量 D.该反应正反应的活化能大于100 kJ·mol-1 答案:D 解析:催化剂不能改变化学反应中反应热的大小,A项错误;形成化学键放出能量,B项错误;热化学方程式的化学计量数表示物质的量,故每生成2 mol AB吸收(a-b)kJ的能量。 3.[2018·安徽A10联盟联考]四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下: ①TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) ΔH1=+175.4 kJ·mol-1 ②C(s)+O2(g)===CO(g) ΔH2=-110.45 kJ·mol-1 下列说法中正确的是( ) A.C的燃烧热为110.45 kJ·mol-1 B.反应①若使用催化剂,ΔH1会变小 C.反应①中的能量变化如下图所示 D.四氯化钛制备的热化学方程式为TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH=-45.5 kJ·mol-1 答案:D 解析:C的燃烧热对应的燃烧产物为CO2,A项错误;使用催化剂不能改变焓变,B项错误;反应①是吸热反应,生成物总能量高于反应物总能量,C项错误;①+2×②得TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH=-45.5 kJ·mol-1,D项正确。 4.[2018·河南中原名校第五次联考]已知:①1 mol晶体硅中含有2 mol Si—Si键。②Si(s)+O2(g)===SiO2(s) ΔH,其反应过程与能量变化如图所示。 176下列说法中正确的是( ) A.晶体硅光伏发电是将化学能转化为电能 B.二氧化硅稳定性小于硅的稳定性 C.ΔH=-988 kJ·mol-1 D.ΔH=a-c kJ·mol-1 答案:C 解析:晶体硅光伏发电是将太阳能转化为电能,A项错误;根据化学键的键能判断,断裂1 mol二氧化硅中的Si—O键需要的能量为4×460 kJ=1 840 kJ,断裂1 mol晶体硅中的Si—Si键需要的能量为2×176 kJ=354 kJ,故二氧化硅的稳定性大于硅的稳定性,B项错误;Si(s)+O2(g)===SiO2(s) ΔH=(176×2+500-460×4) kJ·mol-1=-988 kJ·mol-1,C项正确;根据图中信息可知,ΔH=-c kJ·mol,D项错误。 5.[2018·湖南衡阳联考]下列依据热化学方程式得出的结论正确的是( ) A.已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1,则H2的燃烧热为185 kJ·mol-1 B.已知:C(金刚石,s)===C(石墨,s) ΔH<0,则金刚石比石墨稳定 C.已知:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则1 mol HCl与1 mol NH3·H2O反应放出57.3 kJ能量 D.已知:S(g)+O2(g)===SO2(g) ΔH1,S(g)+O2(g)===SO2(l) ΔH2,则有ΔH1>ΔH2 答案:D 解析:燃烧热是指1 mol可燃物完全燃烧生成稳定的氧化物所放出的热量,而H2(g)与Cl2(g)反应生成HCl(g),并未生成稳定的氧化物,故H2的燃烧热不等于185 kJ·mol-1,A错误。C(金刚石,s)===C(石墨,s)的ΔH<0,该反应为放热反应,等量的石墨具有的能量低于金刚石具有的能量,故石墨比金刚石更稳定,B错误。NH3·H2O是弱电解质,电离时要吸收热量,故1 mol HCl与1 mol NH3·H2O反应放出能量小于57.3 kJ,C错误。S(g)与O2(g)反应生成SO2(g)放出热量,生成等量的SO2(l)和SO2(g),前者放出的热量多,因ΔH<0,则有ΔH1>ΔH2,D正确。 6.[2018·浙江金丽衢十二校联考]根据如下能量关系示意图,下列说法正确的是(提示:热值是指单位质量的燃料完全燃烧放出的热量)( ) A.1 mol C(s)与1 mol O2(g)具有的能量之和为393.5 kJ B.反应2CO(g)+O2(g)===2CO2(g)中,反应物的总键能大于生成物的总键能 C.由C→CO的热化学方程式为2C(s)+O2(g)===2CO(g) ΔH=-110.6 kJ·mol-1 D.CO的热值为10.1 kJ·g-1 答案:D 解析:转化Ⅰ中1 mol C(s)与1 mol O2(g)生成1 mol CO2(g)放出393.5 kJ热量,故1 mol C(s)与1 mol O2(g)具有的能量之和大于393.5 kJ,A错误。由图可知,反应2CO(g)+O2(g)===2CO2(g)为放热反应,则反应物的总键能小于生成物的总键能,B错误。转化Ⅰ、Ⅱ的热化学方程式分别为①C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1;②CO(g)+O2(g)===CO2(g) ΔH=-282.9 kJ·mol-1;根据盖斯定律,由①×2-②×2可得2C(s)+O2(g)===2CO(g),则有ΔH=(-393.5 kJ·mol-1)×2-(-282.9 kJ·mol-1)×2=-221.2 kJ·mol-1,C错误。由CO(g)+O2(g)===CO2(g)的ΔH=-282.9 kJ·mol-1可知,1 mol CO完全反应放出282.9 kJ热量,故CO的热值为≈10.1 kJ·g-1,D正确。 7.[2018·安徽江淮十校第一次联考]已知:①2Fe2O3(s)+3C(s)===3CO2(g)+4Fe(s) ΔH=+468.2 kJ·mol-1 ②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 根据以上热化学方程式判断,下列说法正确的是( ) A.C(s)的燃烧热为393.5 kJ B.如图可表示由C生成CO2的反应过程和能量关系 C.O2(g)与Fe(s)反应放出824.35 kJ热量时,转移电子数为4NA D.Fe2O3(s)+C(g)===CO2(g)+2Fe(s) ΔH>+234.1 kJ·mol-1 答案:B 解析:由热化学方程式②可知,C(s)的燃烧热为393.5 kJ·mol-1,单位不是kJ,A错误。C(s)与O2(g)反应生成CO2(g)是放热反应,反应物具有的总能量高于生成物具有的总能量,符合图示关系,B正确。根据盖斯定律,由②×3-①可得4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=(-393.5 kJ·mol-1)×3-(+468.2 kJ·mol-1)=-1 648.7 kJ·mol-1,故放出824.35 kJ热量时,转移电子数为6NA,C错误。由①×可得Fe2O3(s)+C(s)===CO2(g)+2Fe(s) ΔH=+234.1 kJ·mol-1,由于等质量的C(g)具有的能量高于C(s)具有的能量,故反应Fe2O3(s)+C(g)===CO2(g)+2Fe(s)的ΔH<+234.1 kJ·mol-1,D错误。 8.[2018·安徽淮北实验高中期末]白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为E(P—P)=a kJ·mol-1、E(P—O)=b kJ·mol-1、E(P===O)=c kJ·mol-1、E(O===O)=d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( ) A.(4a+5d-4c-12b) kJ·mol-1 B.(4c+12b-4a-5d) kJ·mol-1 C.(4c+12b-6a-5d) kJ·mol-1 D.(6a+5d-4c-12b) kJ·mol-1 答案:D 解析:白磷与氧气可发生反应P4+5O2===P4O10,断裂P—P键和O===O键,形成P—O键和P===O键。分析图中P4和P4O10的分子结构可知,该反应中有6 mol P—P键和5 mol O===O键断裂,同时生成4 mol P===O键和12 mol P—O键,因此反应热ΔH=(6a kJ·mol-1+5d kJ·mol-1)-(4c kJ·mol-1+12b kJ·mol-1)=(6a+5d-4c-12b) kJ·mol-1。 9.[2018·山东临沂一中月考]已知如下热化学方程式: ①MnO2(s)+C(s)===MnO(s)+CO(g) ΔH1=+24.4 kJ·mol-1 ②MnO2(s) +CO(g)===MnO(s)+CO2(g) ΔH2=-148.1 kJ·mol-1 ③2MnO2(s)+C(s)===2MnO(s)+CO2(g) ΔH3 则下列判断正确的是( ) A.ΔH1<ΔH2 B.ΔH3=ΔH1+ΔH2 C.反应①的活化能为24.4 kJ·mol-1 D.反应③一定是吸热反应 答案:B 解析:分析题给热化学方程式可知,ΔH1>0,ΔH2<0,则有ΔH1>ΔH2,A错误。根据盖斯定律,由①+②可得2MnO2(s)+C(s)===2MnO(s)+CO2(g),则有ΔH3=ΔH1+ΔH2,B正确。反应①的反应热ΔH=+24.4 kJ·mol-1,等于正、逆反应的活化能之差,故反应①的活化能不是24.4 kJ·mol-1,C错误。反应③的ΔH3=ΔH1+ΔH2=(+24.4 kJ·mol-1)+(-148.1 kJ·mol-1)=-123.7 kJ·mol-1 <0,故反应③为放热反应,D错误。 10.[2018·辽宁丹东五校联考]已知:25℃、101 kPa时: ①4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2 835 kJ·mol-1 ②4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3 119 kJ·mol-1 下列说法正确的是( ) A.O3比O2稳定,由O2转化为O3是吸热反应 B.O2比O3稳定,由O2转化为O3是放热反应 C.等质量的O2比O3能量高,由O2转化为O3是放热反应 D.等质量的O2比O3能量低,由O2转化为O3是吸热反应 答案:D 解析:根据盖斯定律,由①-②可得3O2(g)===2O3(g),则有ΔH=(-2 835 kJ·mol-1)-(-3 119 kJ·mol-1)=+284 kJ·mol-1,故O2转化为O3的反应是吸热反应;据此推知,等质量的O2具有的能量比O3具有的能量低,故O2比O3更稳定。 11.[2018·江苏无锡期中检测]以下是大气中碳循环所涉及的部分重要反应。下列说法正确的是( ) ①6CO2(g)+6H2O(g)===C6H12O6(s)+6O2(g) ΔH1=a kJ·mol-1 ②C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(g) ΔH2=b kJ·mol-1 ③2C6H12O6(s)===6CO2(g) +6CH4(g) ΔH3=c kJ·mol-1 ④CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH4=d kJ·mol-1 A.由反应①可知a<0 B.2a+c+6d=0,a+b=0 C.反应②、③的ΔS<0 D.反应 CH4(g)+2O2(g)===CO2(g)+2H2O(l)的ΔH>d kJ·mol-1 答案:B 解析:反应①是植物吸收太阳光发生光合作用,CO2和H2O反应生成有机物C6H12O6(s)和O2,则有a>0,A错误。根据盖斯定律,由③+④×6可得2C6H12O6(s)+12O2(g)===12CO2(g)+12H2O(g) ΔH=(c+6d) kJ·mol-1;由①×2可得12CO2(g)+12H2O(g)===2C6H12O6(s)+12O2(g) ΔH=2a kJ·mol-1,上述两个反应的方向相反,则有2a+c+6d=0。反应①和②中涉及物质相同,反应方向相反,根据盖斯定律,则有ΔH1+ΔH2=0,即a+b=0,B正确。反应②、③均为正向气体总分子数增加的反应,则有ΔS>0,C错误。等量CH4(g)与O2(g)反应生成H2O(l)放出的热量大于生成H2O(g)放出的热量,则反应CH4(g)+2O2(g)===CO2(g)+2H2O(l)的ΔH查看更多
相关文章
- 当前文档收益归属上传用户