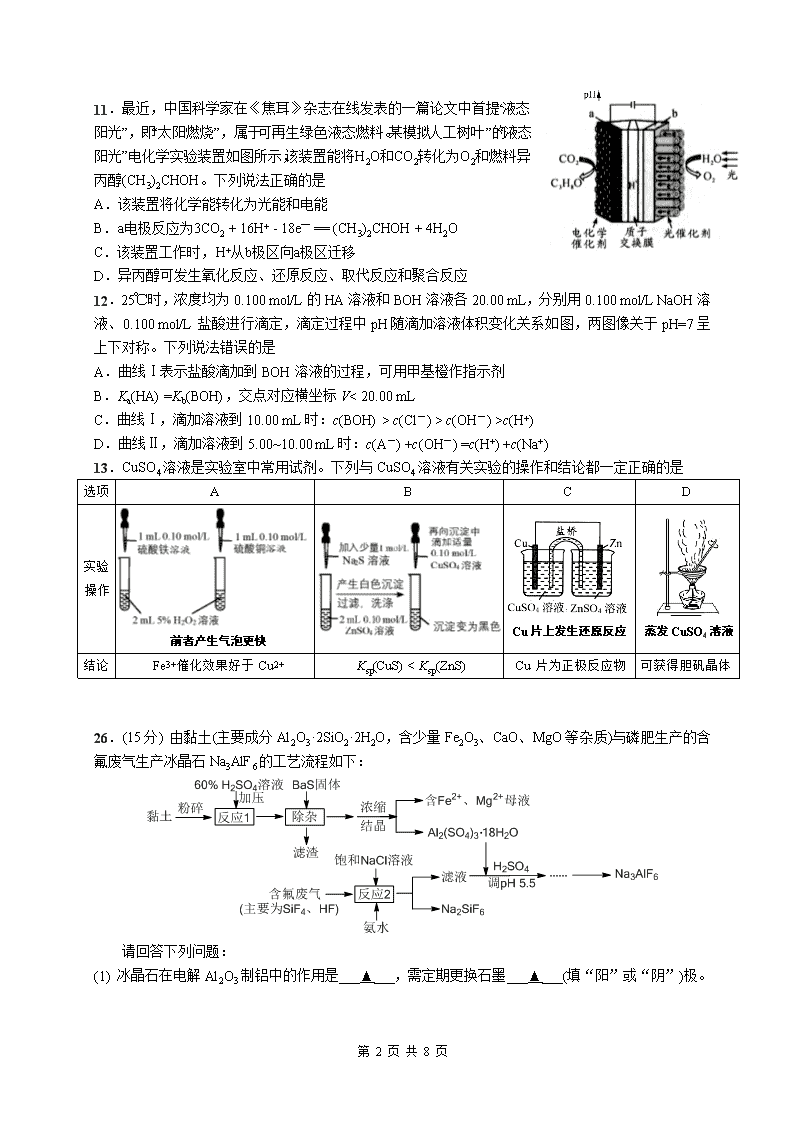
四川省成都七中2020届高三化学高考(7月2日)热身考试试题(Word版附答案)
第 1 页 共 8 页
成都七中高 2017 级高三热身考试
理 科 综 合化学
本试卷分选择题和非选择题两部分。满分 300 分,考试时间 150 分钟。
注意事项:
1. 答题前,务必将自己的姓名、考籍号填写在答题卡规定的位置上。
2. 答选择题时,必须使用 2B 铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡
皮擦擦干净后,再选涂其他答案标号。
3. 答非选择题时,必须使用 0.5 毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4. 所有题目必须在答题卡上作答,在试题卷上答题无效。
5. 考试结束后,只将答题卡交回。
可能用到的相对原子质量:H-1 C-12 O-16 Zn-65
第Ⅰ卷
一、选择题:本题共 7 个小题,每小题 6 分。在每小题给出的四个选项中,只有一项是符合题目要求
的。
7.化学与生活密切相关。下列叙述错误的是
A.不锈钢是一种主要含 Fe、Cr、Ni 且不易生锈的合金钢
B.陶瓷属于无机非金属材料,陶瓷中不含金属元素
C.煤层气中含有甲烷,可用作清洁燃料和化工原料
D.适量 SO2 可用于对食物杀菌防腐、抗氧化
8.设阿伏加德罗常数的值为 NA。有关化工原料苯乙炔 的下列叙述正确的是
A.51 g 该物质中含有单键数目为 2NAB.标准状况下,22.4 L 苯乙炔最多消耗 2NA 个 HCl
C.1mol 苯乙炔分子中共线的原子数最多为 6NAD.苯乙炔与足量 H2 加成产物的一氯代物有 5 种
9.某小组探究实验条件对反应速率的影响,设计如下实验,并记录结果如下:
编号 温度 H2SO4 溶液 KI 溶液 1%淀粉溶液体积 出现蓝色时间
① 20℃ 0.10 mol·L-110 mL 0.40 mol·L-1 5 mL 1mL 40 s
② 20℃ 0.10 mol·L-110 mL 0.80 mol·L-1 5 mL 1mL 21 s
③ 50℃ 0.10 mol·L-110 mL 0.40 mol·L-1 5 mL 1mL 5s
④ 80℃ 0.10 mol·L-110 mL 0.40 mol·L-1 5 mL 1mL 未见蓝色
下列说法正确的是
A.由实验①②可知,反应速率 v 与 c(I—)成正比
B.实验①-④中,应将 H2SO4 溶液与淀粉溶液先混合
C.在 I—被 O2 氧化过程中,H+只是降低活化能
D.由实验③④可知,温度越高,反应速率越慢
10.短周期主族元素 A、B、C、D 的原子序数依次增大,A、C 同主族,C、D 相邻;+1 价 B+离子核
外电子排布与稀有气体 Ne 的相同;A、B、C 的原子序数之和为 35,且可形成正盐 X(化学式 B2C2A3),
X 与稀 H2SO4 反应产生气体与黄色沉淀。下列说法一定正确的是
A.简单离子半径:B> D B.简单气态氢化物的热稳定性:A
c(Cl-) > c(OH-) >c(H+)
D.曲线Ⅱ,滴加溶液到 5.00~10.00 mL 时:c(A-) +c(OH-) =c(H+) +c(Na+)
13.CuSO4 溶液是实验室中常用试剂。下列与 CuSO4 溶液有关实验的操作和结论都一定正确的是
选项 A B C D
实验
操作
前者产生气泡更快 Cu 片上发生还原反应 蒸发 CuSO4 溶液
结论 Fe3+催化效果好于 Cu2+ Ksp(CuS) < Ksp(ZnS) Cu 片为正极反应物 可获得胆矾晶体
26.(15 分) 由黏土(主要成分 Al2O3·2SiO2·2H2O,含少量 Fe2O3、CaO、MgO 等杂质)与磷肥生产的含
氟废气生产冰晶石 Na3AlF6 的工艺流程如下:
请回答下列问题:
(1) 冰晶石在电解 Al2O3 制铝中的作用是___▲___,需定期更换石墨___▲___(填“阳”或“阴”)极。
第 3 页 共 8 页
铝
浸
出
率
/
%
(2) 不用 98%硫酸进行“反应 1”的可能原因是___▲___。
A.不易发生离子反应,造成浸出率下降
B.反应速率太快太剧烈,造成了操作危险
C.产生较多酸性废液,也提高了原料成本
(3) 保持其他条件不变,反应 1 的铝浸出率在不同温度下随时间变化如
图所示。“反应 1”的最佳温度与时间分别是___▲___℃、___▲___min。
(4) “除杂”步骤产生的“滤渣”中含有 BaSO4、CaSO4、S 等难溶物,
写出产生 S 的离子方程式___▲___。
(5) 若按“ ”来制备 Al2(SO4)3·18H2O,该方案的原料利
用率比原方案更___▲___ (填“高”或“低”)。
(6) “反应 2”所得“滤液”中含氟物质主要为___▲___ (写化学式)。
(7) 已知 Ka(HF)= 6.4×10-4,Al3++ 6F— AlF63—的 K=1.0×1019,欲使平衡时 c(AlF63—)/c(Al3+)≥10,且
调节并维持滤液 pH=5.5,则其中 HF 平衡浓度应不低于___▲___mol/L(保留 2 位有效数字,100.5≈ 3.2)。
27.(14 分) 葡萄糖酸锌 Zn(C6H11O7)2 是一种有机补锌剂,广泛应用于食药领域。已知葡萄糖酸锌能溶
于水,易溶于热水,不溶于乙醇。某小组由葡萄糖制备葡萄糖酸锌的实验步骤如下:
I.制备葡萄糖酸(C6H12O7):
60℃水浴下,向一定体积葡萄糖溶液中滴入 1%溴水至略过量,保温 15 min。
II.制备葡萄糖酸钙 Ca(C6H11O7)2:
将略过量 CaCO3 粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生。
过滤,冷却并加入等体积乙醇,产生沉淀。过滤,用乙醇洗涤固体,溶水待用。
III.制备葡萄糖酸锌粗品(装置如右图,夹持、控温装置略):
在 90℃水浴、搅拌下,向 ZnSO4 溶液中分批加入葡萄糖酸钙溶液。趁热过滤,向滤液中加入无水
乙醇并冷却析晶,过滤。
请回答下列问题:
(1) 步骤 I 中溴水的作用是作___▲___,判断溴水略过量的现象是___▲___。
(2) 步骤 II 中用 CaCl2 代替 CaCO3 可行吗?___▲___ (填“可行”或“不可行”),乙醇可洗去葡萄糖
酸钙固体表面杂质,还具有___▲___、___▲___优点。
(3) 步骤 III 中,恒压滴液漏斗需要打开活塞___▲___ (填“a”、“b”或“a 和 b”),90℃下,葡萄糖酸
钙与硫酸锌发生反应的离子方程式为___▲___。
(4) 葡萄糖酸锌粗品含少量难溶水的杂质,纯化晶体的合理操作顺序是___▲___ (选填写正确序号)。
① 蒸发浓缩至溶液表面出现晶膜;② 待晶体充分析出后,减压过滤;③ 将滤液冷却至室温,加入
10 mL 95%乙醇溶液并搅拌,促进晶体析出;④ 趁热减压过滤,除去不溶物;⑤ 在 50℃下用恒温干
燥箱烘干,称重;⑥ 取烧杯加入 10 mL 蒸馏水,加热至微沸,加入粗品,得到葡萄糖酸锌饱和溶液。
(5) 测定产品纯度步骤如下:
取 mg 提 纯 后 的 产 品 溶 于 水 配 成 100mL 溶 液 , 取 25.00mL 置 于 __▲__ 中 , 加 入
V1mLc1 mol·L-1Na2EDTA 溶液(过量)和指示剂,用 c2 mol·L-1 Zn2+标准溶液滴定至终点,发生反应:
Zn2++EDTA2—==ZnEDTA,三次滴定平均消耗锌标准溶液 V2mL,则该产品的纯度为___▲___%(保留 1
第 4 页 共 8 页
个数字系数)。
28.(14 分) 甲醇、水蒸气重整制氢(SRM)系统简单,产物中 H2 含量高,是电动汽车氢氧燃料电池理
想的氢源。其部分主要反应过程如下流程所示:
请回答下列问题:
I.对反应 ICH3OH(g) CO(g) + 2H2(g)的单独研究:
(1) 已知 CO(g)的热值为 10.1 kJ·g-1;CH3OH(g)、H2(g)的燃烧热分别为 760 kJ·mol-1、286 kJ·mol-1;计
算反应 I 的ΔH1=___▲___kJ·mol-1 (保留三位有效数字)。
(2) 原料进气比对反应 I 的选择性(某产物的选择性越大,则其含量越多)的影响较为复杂,其关系如图
甲。 当 n(O2)/n(CH3OH)=0.2~0.3 时,CH3OH 与 O2 发生的主要反应为___▲___。
图甲 图乙 图丙
II.对反应 II CO(g) + H2O(g) H2(g) + CO2(g)ΔH<0 的单独研究:
(3) 在进气比 n(CO)/n(H2O)不同时,测得相应的 CO 的平衡转化率如图乙(各点对应温度可能不同)。图
乙中 D、G 两点对应的反应温度分别为 TD 和 TG,其中相对低温的是___▲___(填 TD 或 TG)。
(4) 实验发现,其他条件不变,向反应 II 平衡体系中投入一定量纳米 CaO 可明显提高 H2 的体积分数,
原因是___▲___。
III.对反应 I 和 II 的综合研究:
(5)某催化剂条件下,体系中 CH3OH 转化率、中间产物 CO 生成率与温度变化关系如图丙所示。
① 随着温度升高,CH3OH 实际转化率不断接近平衡转化率的原因可能是___▲___;但是,CO 的实际
生成率并没有不断接近平衡生成率,其原因可能是___▲___ (填标号)。
A.反应Ⅱ正向移动 B.部分 CO 转化为 CH3OH
C.催化剂对反应Ⅱ的选择性低 D.催化剂对反应 I 的选择性低
② 写出能提高 CH3OH 转化率而降低 CO 生成率的一条措施___▲___。
35.【选修 3:物质结构与性质】(15 分)下图是一种钯(Pd)的氯配合物 X 的晶胞结构。回答下列问题:
第 5 页 共 8 页
请回答下列问题:
(1)基态 Cl 原子中存在未成对电子的能级,画出其该能级的轨道表示式___▲___。
(2)下列关于 Cl 元素的叙述正确的是___▲___ (填序号)。
A.Cl2 分子中无π键 B.Cl 是 p 区主族元素
C.第一电离能:ClS
(3)NCl3 分子的中心原子 N 的杂化方式是___▲___。
(4) NH3 常作制冷剂,其键角___▲___ (填“大于”或“小于”)NH4+的键角,NH3 的沸点高于 N2 沸点
的主要原因是___▲___。
(5) 物质 X 的晶体类型为___▲___,其中的 Pd 元素的化合价为___▲___、配位数为___▲___。
(6) 配合物Y是含有Pd的平面四方的配合物,经过元素分析与计算可知Y中Pd : Cl : N : H的数量比
=1:2:2:6。试画出配合物Y的可能结构___▲___。
36.【选修 5:有机化学基础】(15 分) 醇 A 是一种有机合成中间体,用于制增塑剂、除草剂、溶剂等。
下面是醇 A 的相关转化反应。
请回答下列问题:
(1) 醇 A 可在浓硫酸加热条件下得到 B、C 两种异构体(不考虑立体异构),C 有两个甲基。B 的系统命
名是___▲___,A 的结构简式为___▲___。
(2) 由 E 生成 F 的反应类型为___▲___,F 转变为羧酸 G,G 的核磁共振氢谱共有___▲___组峰。
(3) 写出羧酸 G 与醇 A 反应生成甜味物质 H 的化学方程式___▲___。
(4) E 的水解产物可催化氧化为含羰基官能团的物质 Z。写出相关反应方程式___▲___。
第 6 页 共 8 页
(5) A 转化为 E 的过程中还有另一种生成物 X,质谱显示 X 的相对分子质量为 92.5,X 的三个甲基化
学环境相同,X 可在热的氢氧化钠-醇溶液条件下只得到一种烯烃 Y,Y 与 B、C 互为同分异构。Y 的
结构简式为___▲___,X 的结构简式为___▲___。
(6) 在化合物 G 的同分异构体中能同时符合下列条件的有___▲___种。
①可与银氨溶液发生银镜反应;② 可催化氧化成醛;③ 含有手性 C 原子。
第 7 页 共 8 页
第 8 页 共 8 页