- 2021-08-23 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年四川省棠湖中学高一下学期开学考试化学试题
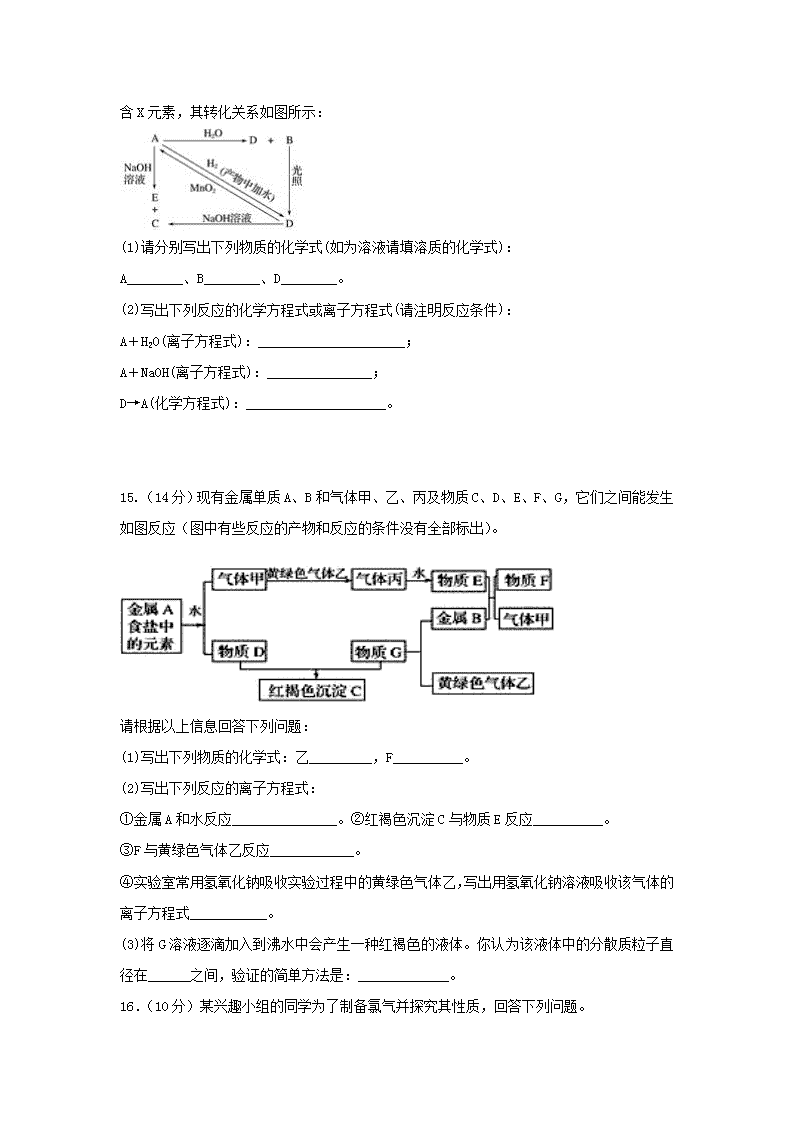
2018-2019学年四川省棠湖中学高一下学期开学考试化学试题 满分:300分 时间:150分钟 第I卷(选择题52分) 一、选择题:本题共13小题,每小题4分,在每小题给出的四个选项中只有一项符合题目要求。 1.《本草经集注》中记载有关于区别硝石(KNO3)和朴硝(Na2SO4) 的方法:“强烧之,紫青烟起,…,云是真硝石也。”文中区别的方法是利用了下列中的( ) A.焰色反应 B.萃取 C.丁达尔效应 D.蒸馏 2.磁流体是电子材料的新秀。在一定条件下,将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,可得到分散质粒子大小在36~55nm之间的黑色磁流体。下列说法中正确的是( ) A.所得的分散系属于悬浊液 B.所得的分散系中分散质为Fe2O3 C.用光束照射该分散系能产生丁达尔效应 D.分散系为胶体,分散质粒子大小即Fe(OH)3分子直径 3.下列关于浓硫酸的叙述,正确的是( ) A.具有吸水性,因而能使蔗糖炭化 B.在常温下可迅速与铜片反应放出SO2气体 C.是一种干燥剂,能够干燥NH3、H2等气体 D.在常温下能够使铁、铝等金属钝化 4.下列化合物中,属于碱性氧化物且能与水反应的是( ) A.FeO B.CaO C.Al2O3 D.CuO 5.根据下列反应:①Ag2O+H2O2=2Ag+O2↑+H2O;②3H2O2 + Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4 +8H2O判断:H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是( ) A.K2CrO4>H2O2>Ag2O B.Ag2O>H2O2>K2CrO4 C.H2O2>Ag2O> K2CrO4 D.Ag2O>K2CrO4>H2O2 6.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( ) A.若R(OH)n为强碱,则W(OH)n+1也为强碱 B.若HnXOm为强酸,则Y是活泼的非金属元素 C.若Y的最低化合价为-2,则Z的最高正化合价为+7 D.若X的最高正化合价为+5,则五种元素都是非金属元素 7.下列化合物中,在水溶液里和熔融状态下均不能导电的是 A.NaCl B.H2SO4 C.NaOH D.蔗糖 8.有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+浓度为0.4 mol/L,SO42-的浓度为0.7 mol/L,则该溶液中K+的浓度为( ) A.0.1 mol/L B.0.15 mol/L C.0.2 mol/L D.0.25 mol/L 9.下列离子方程式中书写正确的是( ) A.Al(OH)3溶于NaOH溶液:Al3++4OH-= AlO2- +2H2O B.NaHCO3溶液与NaOH溶液混合:HCO3-+OH-=CO32- +H2O C.氢氧化钡溶液与稀硫酸反应:Ba2++OH﹣+ H+ + SO42-= BaSO4↓+H2O D.FeCl3溶液腐蚀铜质电路板:2Fe3++3Cu=3Cu2++ 2Fe 10.下列化学反应在金属冶炼工业中还没有得到应用的是( ) A.2NaCl(熔融)2Na+Cl2↑ B.Al2O3+3C2Al+3CO↑ C.Fe2O3+3CO2Fe+3CO2 D.2Ag2O4Ag+O2↑ 11.下列离子方程式中正确的是( ) A.少量SO2通入NaOH溶液中:OH-+SO2→HSO3- B.H2S通入氯水中:S2-+Cl2 →S↓+2Cl- C.二氧化氮溶于水:3NO2+H2O →2H++2NO3-+NO↑ D.少量NaHSO4与过量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH- →BaSO4↓+2H2O 12.已知某气体的摩尔质量为Mg/mol,则bg该气体在标准状况下的体积(L)为( ) A.22.4Mb B. C. D.22.4b 13.等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1∶2∶3,则三种硫酸盐的物质的量浓度之比为( ) A.1∶2∶3 B.1∶6∶9 C.1∶3∶3 D.1∶3∶6 第II卷(非选择题48分) 14.(12分)常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示: (1)请分别写出下列物质的化学式(如为溶液请填溶质的化学式): A________、B________、D________。 (2)写出下列反应的化学方程式或离子方程式(请注明反应条件): A+H2O(离子方程式):_____________________; A+NaOH(离子方程式):_______________; D→A(化学方程式):____________________。 15.(14分)现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。 请根据以上信息回答下列问题: (1)写出下列物质的化学式:乙_________,F__________。 (2)写出下列反应的离子方程式: ①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。 ③F与黄绿色气体乙反应____________。 ④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___________。 (3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。 16.(10分)某兴趣小组的同学为了制备氯气并探究其性质,回答下列问题。 Ⅰ.写出实验室制取氯气的离子方程式:_______________________________ Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题: (1)浓硫酸的作用是___________________。 (2)证明氯气和水反应的实验现象为__________。 (3)ICl的性质与Cl2类似,写出ICl与水反应的化学方程式是______________________。 (4)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是 ______________________。漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是_____________________________________。 17.(12分)草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾。现从草木灰中提取钾盐,并用实验检验其中的CO32-、SO42-和Cl-。 (1)从草木灰中提取钾盐的实验操作顺序如下:①称量样品,②溶解沉降,③________,④________,⑤冷却结晶。 (2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示________(填字母)。 A.左盘重,样品轻 B.左盘轻,砝码重 C.右盘重,砝码轻 D.右盘轻,样品重 (3)在进行②③④操作时,都要用到玻璃棒,其作用分别是:②_____________;③____________;④_____________。 (4)将制得的少量晶体放入试管,加蒸馏水溶解并把溶液分成三份,分装在3支试管里。 ①在第一支试管里加入稀盐酸,可观察有________生成,证明溶液中有________离子。 ②在第二支试管里加入足量稀盐酸后,再加入BaCl2溶液,可观察到有________生成,证明溶液中有________离子。 ③在第三支试管里加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量稀硝酸后,再加入AgNO3溶液,可观察到有________生成,证明溶液中有________离子。 2019年春四川省棠湖中学高一年级开学考试 化学试题参考答案 1.A 2.C 3.D 4.B 5.B 6.B 7.D 8.C 9.B 10.B 11.C 12.B 13.B 14.Cl2 HClO HCl Cl2+H2O=H++Cl-+HClO Cl2+2OH-=Cl-+ClO-+H2O 4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O 15.Cl2 FeCl2 2Na+2H2O=2Na++2OH﹣+H2↑ Fe(OH)3+3H+=Fe3++3H2O 2Fe2++Cl2=2Fe3++2Cl﹣ Cl2+2OH﹣=Cl﹣+ClO﹣+H2O 1~100nm 是否有丁达尔现象 16.MnO2+4H++2Cl—=Mn2++Cl2 ↑+2H2O 干燥氯气 干燥的有色布条不褪色,湿润的有色布条褪色 ICl+H2O == HCl+HIO 2Cl2+2Ca(OH)2 ==CaCl2+Ca(ClO)2 +2H2O Ca(ClO)2 +CO2+ H2O==CaCO3 +2HClO 17.过滤 蒸发 B 搅拌加速样品溶解 引流,防止滤液溅到漏斗外 搅拌,使溶液受热均匀,防止滤液飞溅 气泡 CO32- 白色沉淀 SO42- 白色沉淀 Cl- 查看更多