- 2021-08-23 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
氧化还原反应教案
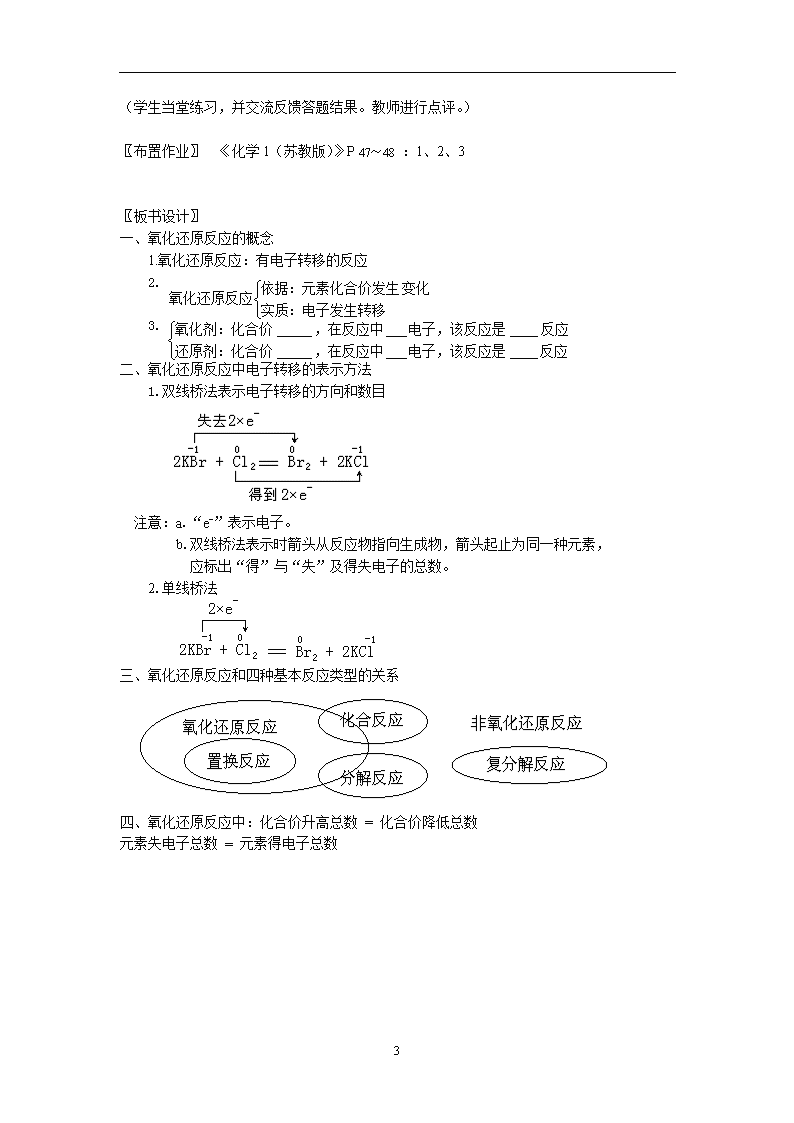
2.1.3 氧化还原反应 【教学目标】1.在复习化合价的基础上,使学生用化合价变化和电子转移的观点认识、理解氧化还原反应、氧化剂、还原剂等概念。 2.学会用化合价变化和电子转移的观点判断氧化还原反应。 3.掌握用双线桥法和单线桥法表示电子转移的方向和数目。 【教学重点】1.氧化还原反应、氧化剂、还原剂等概念及其判断。 2.用双线桥法和单线桥法表示电子转移的方向和数目。 【教学难点】电子转移方向和数目的表示法 【教学方法】启发 讨论 【教学设计】 [复习引入]1.常见元素的化合价 2.写出钠、氯原子的结构示意图,分析其得失电子的情况,推出钠、氯元素在化合物中的化合价 〖学生活动〗学生交流讨论,得出如下结果: 元素化合价升高→失去电子 元素化合价降低→得到电子 [问题情境]标出2KBr + Cl2 = Br2 + 2KCl 反应中各元素的化合价,并分析哪种元素失电子,哪种元素得电子,电子从哪种元素转移到哪种元素? 〖学生活动〗学生探索、讨论、交流,从而得出氧化还原反应、氧化剂、还原剂的概念。 〖教师活动〗在氯气与溴化钾的反应中,溴离子失去1个电子形成溴原子,溴原子结合 成溴分子,溴元素的化合价由-1升高到0;同时氯气分子中的氯原子得到溴离子给出的1个电子形成氯离子,氯元素的化合价由0降低到-1。 在反应过程中,溴离子与氯原子之间发生了电子转移,导致了溴元素与氯元素的化合价发生改变。 或 [强调提醒] a.“e-”表示电子 b.用双线桥法表示时箭头从反应物指向生成物,箭头起止为同一种元素,应标出“得”与“失”及得失电子的总数。 3 〖学生活动〗由学生归纳概括总结: 氧化还原反应的概念 氧化还原反应:有电子转移的反应 [问题情境]判断下列反应是否是氧化还原反应,是氧化还原反应的请指出氧化剂和还原剂。 (1)2Fe+3Cl2 = 2FeCl3 (2)CaO+H2O = Ca(OH)2 (3)Cl2+H2O = HCl+HClO (4)Fe+CuSO4 = FeSO4+Cu (5) (6) (7)NaOH+HCl = NaCl+H2 上述反应各属于四种基本反应类型中的哪一种?四种基本反应类型与氧化还原反应有何关系? 〖学生活动〗在教师的启发引导下,学生进行分析、讨论、交流,归纳总结如下: 〖教师活动〗[拓展视野] 物质的氧化性和还原性的强弱 在氧化还原反应中,氧化剂表现出氧化性,还原剂表现出还原性。一般情况下,得到电子的能力趆强,物质的氧化性就趆强;失去电子的能力趆强,物质的还原性就趆强。例如: 氟、氯、溴、碘的单质的氧化性强弱顺序为:F2>Cl2>Br2>I2 离子的还原性强弱顺序为:I->Br->Cl->F- 〖学生活动〗在教师的启发下,学生进行分析、讨论、交流,并由学生总结归纳如下规律: 氧化还原反应中:化合价升高总数 = 化合价降低总数 元素失电子总数 = 元素得电子总数 〖教师活动〗归纳、概括、小结本课知识要点。 〖巩固练习〗 《化学1(苏教版)》P 45中的[问题解决]: 请指出下列氧化还原反应中化合价发生变化的元素,分析电子转移的方向和数目,并指出氧化剂、还原剂。 3 (学生当堂练习,并交流反馈答题结果。教师进行点评。) 〖布置作业〗 《化学1(苏教版)》P 47~48 :1、2、3 〖板书设计〗 一、氧化还原反应的概念 1.氧化还原反应:有电子转移的反应 2. 3. 二、氧化还原反应中电子转移的表示方法 1.双线桥法表示电子转移的方向和数目 注意:a.“e-”表示电子。 b.双线桥法表示时箭头从反应物指向生成物,箭头起止为同一种元素, 应标出“得”与“失”及得失电子的总数。 2.单线桥法 三、氧化还原反应和四种基本反应类型的关系 四、氧化还原反应中:化合价升高总数 = 化合价降低总数 元素失电子总数 = 元素得电子总数 3查看更多