- 2021-08-23 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
氧化剂和还原剂(3) 导学案
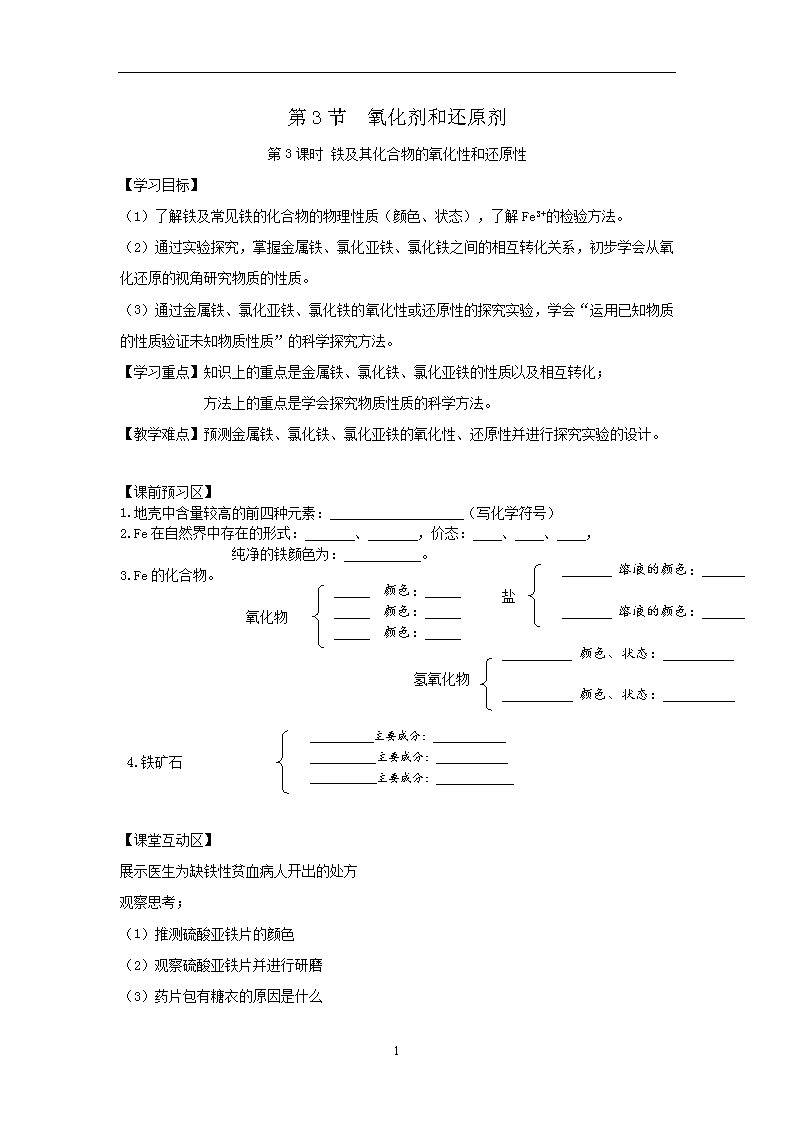
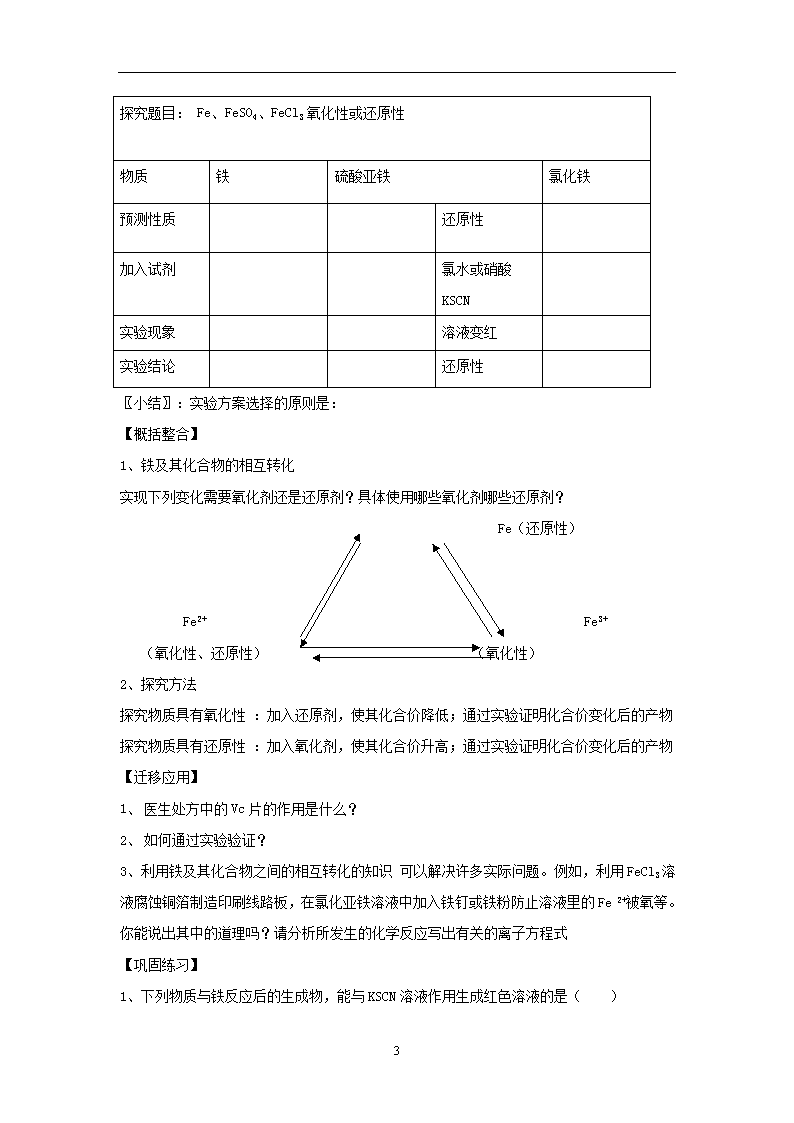
第3节 氧化剂和还原剂 第3课时 铁及其化合物的氧化性和还原性 【学习目标】 (1)了解铁及常见铁的化合物的物理性质(颜色、状态),了解Fe3+的检验方法。 (2)通过实验探究,掌握金属铁、氯化亚铁、氯化铁之间的相互转化关系,初步学会从氧化还原的视角研究物质的性质。 (3)通过金属铁、氯化亚铁、氯化铁的氧化性或还原性的探究实验,学会“运用已知物质的性质验证未知物质性质”的科学探究方法。 【学习重点】知识上的重点是金属铁、氯化铁、氯化亚铁的性质以及相互转化; 方法上的重点是学会探究物质性质的科学方法。 【教学难点】预测金属铁、氯化铁、氯化亚铁的氧化性、还原性并进行探究实验的设计。 【课前预习区】 1.地壳中含量较高的前四种元素: (写化学符号) 2.Fe在自然界中存在的形式: 、 ,价态: 、 、 , 溶液的颜色: 溶液的颜色: 纯净的铁颜色为: 。 颜色: 颜色: 颜色: 3.Fe的化合物。 盐 氧化物 颜色、状态: 颜色、状态: 氢氧化物 主要成分: 主要成分: 主要成分: 4.铁矿石 【课堂互动区】 展示医生为缺铁性贫血病人开出的处方 观察思考; (1)推测硫酸亚铁片的颜色 (2)观察硫酸亚铁片并进行研磨 (3)药片包有糖衣的原因是什么 4 (4)你推测的理论依据是什么 活动探究 硫酸亚铁还原性的探究 阅读课本54页“方法导引”与“工具栏” (一)溶液中Fe3+ 的检验 试剂: 现象: 方程式: 【实验试剂】铁粉,稀盐酸, FeCl3溶液,FeCl2溶液,氯水,稀硝酸,过氧化氢(H2O2)溶液,KSCN(硫氰化钾)溶液,锌粉,铜粉 小结:检验某物质具有还原性的一般思路。 (二)铁及其常见的化合物 【问题组】 (1)常见的含铁元素的物质有哪些?写出其化学式 (2)标出上述物质中铁元素的化合价 (3)按化合价将含铁物质进行分类? (4)在铁及其化合物中哪些具有氧化性,哪些具有还原性 ,哪些既有氧化性又有还原性? 预测依据是什么? 只具有 性 ; 只具有 性; 既有 性,又有 性。 (三)探究铁及其化合物的氧化性和还原性 【实验试剂】铁粉,稀盐酸, FeCl3溶液,FeCl2溶液,氯水,稀硝酸,过氧化氢(H2O2)溶液,KSCN(硫氰化钾)溶液,锌粉,铜粉 【实验探究】 1.设计方案:有理论依据,操作现象明显。 2.作好实验现象的记录、分析。 4 探究题目: Fe、FeSO4、FeCl3氧化性或还原性 物质 铁 硫酸亚铁 氯化铁 预测性质 还原性 加入试剂 氯水或硝酸KSCN 实验现象 溶液变红 实验结论 还原性 〖小结〗:实验方案选择的原则是: 【概括整合】 1、铁及其化合物的相互转化 实现下列变化需要氧化剂还是还原剂?具体使用哪些氧化剂哪些还原剂? Fe(还原性) Fe2+ Fe3+ (氧化性、还原性) (氧化性) 2、探究方法 探究物质具有氧化性 :加入还原剂,使其化合价降低;通过实验证明化合价变化后的产物 探究物质具有还原性 :加入氧化剂,使其化合价升高;通过实验证明化合价变化后的产物 【迁移应用】 1、 医生处方中的Vc片的作用是什么? 2、 如何通过实验验证? 3、利用铁及其化合物之间的相互转化的知识 可以解决许多实际问题。例如,利用FeCl3溶液腐蚀铜箔制造印刷线路板,在氯化亚铁溶液中加入铁钉或铁粉防止溶液里的Fe 2+被氧等。你能说出其中的道理吗?请分析所发生的化学反应写出有关的离子方程式 【巩固练习】 1、下列物质与铁反应后的生成物,能与KSCN溶液作用生成红色溶液的是( ) 4 A、盐酸 B、氯气 C、CuSO4溶液 D、稀硫酸 2、现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( ) A、苹果汁中的Fe2+变为Fe3+ B、苹果汁含有Cu2+ C、苹果汁含有OH— D、苹果汁含有Na+ 3、人体血红蛋白中含有Fe2+ ,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变成Fe3+ ,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐中毒,这说明维生素C具有( ) A、酸性 B、碱性 C、氧化性 D、还原性 4、要证明某溶液中不含Fe3+而可能含有Fe2+ ,进行实验操作的顺序有:①加入足量氯水,②加入足量高锰酸钾溶液,③加入少量KSCN溶液,其中顺序正确的是( ) A、①② B、③② C、③① D、①②③ 4查看更多