2019-2020学年湖南省临澧一中高一下学期第一次月考化学试题
湖南省临澧一中 2019-2020 学年高一下学期第一次月考化学试卷
时间:90 分钟 满分:100 分
一、 选择题(每小题只有一个正确答案,共 16 小题,每小题 3 分,共 48 分)
1.联合国大会确定 2019 年是“国际化学元素周期表年”。下列说法错误..的是
( )
A. 短周期共有 18 种元素
B. 元素周期表中有 118 种元素,即发现了 118 种原子
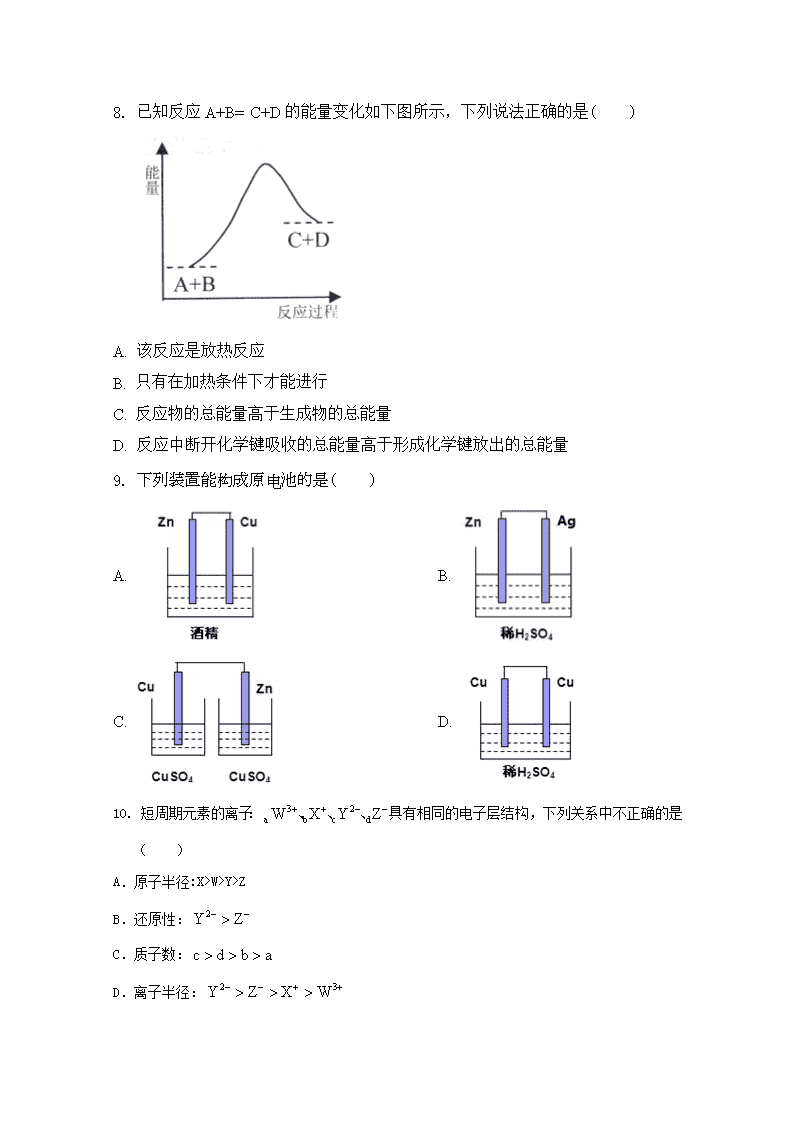
C. 在元素周期表金属与非金属的分界处可以找到半导体材料
D. 元素周期表中的每个周期都是按原子序数递增的顺序从左到右进行排列的
2. 试判断 115 号元素在元素周期表中的位置是( )。
A.第七周期第 IIIA 族 B.第七周期第 VA 族
C.第五周期第 VIIA 族 D.第五周期第 IIIA 族
3. 下列属于吸热反应的是( )
A. 气态水液化为液态水 B. 氢氧化钠和盐酸反应
C. 高温分解石灰石 D. 氢气在氯气中燃烧
4.下列电子式或用电子式表示化合物形成过程正确的是( )
A. NH4Cl 的电子式: B. 次氯酸的电子式H••Cl••
•••• O••
••••
C. D.
5. 下列分子中所有原子都满足最外层为 8 电子结构的是( )
A.CO2 B.H2O
C.PCl5 D.NH3
6. 下列说法中不正确的是( )
A. 熔化状态下能导电的化合物一定是离子化合物
B. 双原子分子中不一定含有极性键
C. 由非金属元素组成的化合物不一定是共价化合物
D. 不同元素组成的多原子分子内一定不存在非极性键
7.下列关于物质性质的比较,不正确的是( )
A. 沸点:HF﹥HCl﹥HBr﹥HI B. 离子半径大小: Al3+
W>Y>Z
B.还原性: 2Y Z
C.质子数: c d b a
D.离子半径: 2 3Y Z X W
11. 下列物质中,含有共价键的离子化合物是( )
A. NH3 B. HCl C. NaOH D. CaCl2
12.下列变化中,不需要破坏化学键的是( )
A. 氯化氢溶于水 B. 加热氯酸钾使其分解
C. 干冰气化 D. 氯化钠熔化
13. 应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化
合物的性质。下列预测中正确的是( )
①第 2 周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
②砹(At)单质为有色固体,AgAt 不溶于水也不溶于稀硝酸
③Li 在氧气中剧烈燃烧,产物是 Li2O2,其溶液是一种强碱
④硫酸锶(SrSO4)是难溶于水的白色固体
⑤硒化氢(H2Se)是无色、有毒、比 H2S 稳定的气体
A.②④ B.①②③④
C.①③⑤ D.②④⑤
14. 下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以
下叙述正确的是( )
A. A、B 的单质与稀盐酸反应速率 B>A
B. D、E 形成的简单离子的还原性 E->D-
C. 气态氢化物的稳定性 HD<H2C
D. E 的氧化物的水化物的酸性一定比 C 的强
15. 某元素 X 的某一个原子形成的离子可表示为 b
aXn-,下列说法正确的是( )
A. 这个 X 原子的质量约为 236.02 10
b
g
B. b
aXn-含有的中子数为 a+b
C. X 元素的相对原子质量为 b
元素代号 A B C D E
原子半/nm 0.160 0.143 0.102 0.071 0.099
主要化合价 +2 +3 +6、-2 -1 -1
D. b
aXn-含有的电子数为 a-n
16 . W、R、X、Y、Z 是原子序数依次增大的短周期主族元素。Y 是短周期中最活
泼的金属元素。W 与 Y 同主族,X 与 Z 同主族。R 原子最外层电子数比内层电子数
多 3,W、Y 原子的电子数总和与 X、Z 原子的电子数总和之比为 1∶2。下列说法正
确的是( )
A. 原子半径: r(Z)>r(X)>r(R)>r(W)
B. X 的简单气态氢化物的热稳定性比 Z 的弱
C. 由 W、R、X 三种元素组成的化合物只能是酸或碱
D. X 与 Y 形成化合物中可能既有离子键又有共价键
二、填空题(每空 2 分,共 52 分)
17. (16 分)(1)有①16
8 O 、 17
8O 、 18
8O ;②H2、D2、T2;③石墨、金刚石;④1
1H 、
2
1H、 3
1H;四组微粒或物质。互为同位素的是 (填编号,下同),互为同
素异形体的是 。
(2)已知拆开 1 mol H—H 键、1 mol N≡N、1 mol N—H 键分别需要吸收的能量为 436kJ、
946k J、391k J。则由氢气和氮气反应生成 1 mol NH3 需要 (填“放出”或“吸
收”) k J 能量。
(3)如图为原电池装置示意图:
①若 A 为 Zn,B 为 Cu,电解质溶液为稀硫酸,则 A 电极名称为_______(填“正
极”或“负极”),写出正极电极反应式:___________。
②若 A 为铜片,B 为铁片,电解质为 CuSO4 溶液,则铜片为 (填“正
极”或“负极”),写出负极电极反应式: _________________________。
18.(12 分)下表是元素周期表的一部分,按要求填空:
族
周期
IA IIA IIIA IVA VA VIA VIIA 0
2 ① ②
3 ③ ④ ⑤ ⑥ ⑦ ⑧
4 ⑨ ⑩
(1)在这些元素中,最活泼的金属元素与最活泼的非金属元素形成的化合物是
是:_____ (填化学式)。
(2)元素③、④、⑤的最高价氧化物的水化物中碱性最强的物质的电子式是:
_______________;元素⑥、⑦、⑧的最高价氧化物的水化物的酸性强弱是:
_________>_________>_________(填化学式)。
(3)元素①、②、⑦的原子半径由大到小的顺序是:_ > _____ >________ (填
元素符号)。
(4)用电子式表示元素⑦的氢化物的形成过程 。
(5) 写出元素③、⑤的最高价氧化物的水化物之间发生反应的离子反应方
程式 。
19.(14 分)有 A、B、C、D、E 五种短周期主族元素,它们的原子序数依次增大,
已知 A 的 L 层电子数是 K 层电子数的两倍,D 是短周期元素中原子半径最大的元素,
D 的单质在高温下与 C 的单质充分反应,可以得到与 E 单质颜色相同的淡黄色固态
化合物,试根据以上叙述回答:
(1)元素名称:A ; B ;
(2)元素 E 在周期表中的位置 ;
(3)元素 C 与 D 可以形成两种不同的化合物,用电子式表示 D2C 的形成过程
;D2C2 的化学键类型为
(填“离子键”“非极性共价键”或“极性共价键”)。
(4)AC2 的结构式为 ,写出 2AC 与 2 2D C 反应的化学方程式
。
20.(10 分).短周期元素 A、B、C、D、E 的原子序数依次增大,其中只有 A 与 C、 B
与 D 同主族, C 的离子和 B 的离子具有相同的电子层结构。A 和 B、D、E 均能形
成共价型化合物。A 和 B 形成的化合物溶于水形成的溶液呈碱性, E 的单质为黄
绿色气体可用于漂白和消毒,用化学用语....回答下列问题:
(1)写出元素 E 的简单离子结构示意图:________________________;
(2)由 A 分别与 B、D、E 所形成的共价化合物,热稳定性最差的是___________
(填化学式);
(3)由 A 和 E 形成的化合物与 A 和 B 形成的化合物反应所得产物的化学式为
___________;由 A 和 C 形成的化合物的电子式为 ;
(4)元素 A 和氧元素以原子个数比 1∶1 化合形成化合物 Q,元素 B 与氢元素以原
子个数比 1∶2 化合形成常用作火箭燃料的化合物 W,Q 与 W 发生氧化还原反应,
生成 B 单质和 A 的另一种氧化物,写出该反应的化学方程式:
____________________________ 。
2020 年上学期高一第一次阶段性考试
化学参考答案
1-5 BBCDA 6-10 DADBC 11-16 CCABAD
17.(1)①④ ③
(2)放出 46
(3)① 负极 2H++2e-=H2↑
② 正极 Fe-2e-= Fe2+
18. (1)KF
(2) HClO4>H2SO4﹥H3PO4
(3)S>O>F
(4)
(5)OH-+Al(OH)3=AlO2
-+2H2O
19.(1)碳 氮
(2)第三周期第ⅥA 族
(3) 离子键、非极性键
(4)O=C=O 2CO2+2Na2O2=2Na2CO3+O2
20. (1)
(2)PH3
(3)NH4Cl
(4) 2H2O2+N2H4=N2↑+4H2O