- 2021-08-23 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习能力提升训练4氧化还原反应含解析
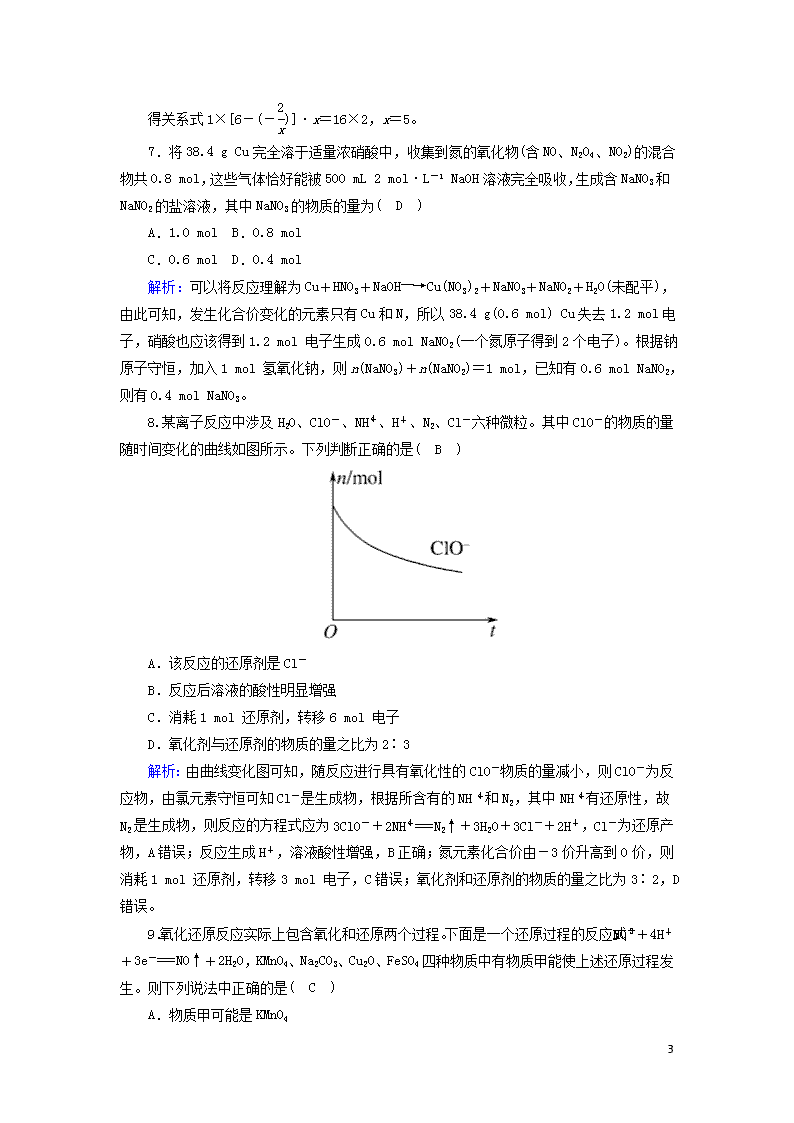
能力提升训练(4) 1.安全气囊碰撞时发生反应:10NaN3+2KNO3===K2O+5Na2O+16N2↑,下列判断正确的是( D ) A.每生成16 mol N2转移30 mol电子 B.NaN3中氮元素被还原 C.N2既是氧化剂又是还原剂 D.还原产物与氧化产物质量之比为1∶15 解析:每生成16 mol N2转移10 mol电子,A错误;NaN3中氮元素化合价升高,被氧化,B错误;N2既是氧化产物又是还原产物,C错误;还原产物与氧化产物质量之比为1∶15,D正确。 2.实验室常用NaNO2与NH4Cl两种物质的浓溶液混合共热制取少量N2。下列关于该反应的说法不正确的是( C ) A.该反应的产物除N2外还有NaCl和H2O B.NaNO2是氧化剂,NH4Cl是还原剂 C.每生成2.24 L标准状况下N2转移0.6 mol电子 D.氧化产物和还原产物均为N2 解析:根据方程式NaNO2+NH4Cl===NaCl+N2↑+2H2O,A正确;NaNO2中氮元素的化合价降低,NH4Cl中氮元素的化合价升高,NaNO2是氧化剂,NH4Cl是还原剂,B正确;每生成0.1 mol N2时,转移电子0.3 mol,C错误;该反应中只有氮元素的化合价发生变化,则生成物中的N2既是氧化产物又是还原产物,D正确。 3.室温下,发生下列几种反应: ①16H++10Z-+2XO===2X2++5Z2+8H2O ②2A2++B2===2A3++2B- ③2B-+Z2===B2+2Z- 根据上述反应,判断下列结论错误的是( A ) A.要除去含有A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入Z2 B.还原性强弱顺序为A2+>B->Z->X2+ C.反应①中X2+是XO的还原产物,反应③中B2是B-的氧化产物 D.在溶液中可能发生反应:8H++5A2++XO===X2++5A3++4H2O 解析:根据三个反应得出氧化性强弱顺序是XO>Z2>B2>A3+,还原性强弱顺序为A2+>B->Z->X2+,要除去含有A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入B2,A错误,B正确;反应①中XO为氧化剂,X2+是XO的还原产物,反应③中B-发生氧化反应生成B 7 2,即B2是B-的氧化产物,C正确;根据氧化性强弱顺序XO>Z2>B2>A3+,所以XO能氧化A2+,发生的反应为8H++5A2++XO===X2++5A3++4H2O,D正确。 4.向CuSO4溶液中逐滴加入KI溶液至过量,观察到有沉淀(CuI)生成,且溶液变为棕色,再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列有关分析中正确的是( D ) A.上述实验条件下,物质的氧化性:Cu2+>SO2>I2 B.在SO2与I2的反应中得到的还原产物为H2SO4 C.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 D.滴加KI溶液时,每转移2 mol e-会生成2 mol CuI沉淀 解析:溶液变为棕色,有单质碘生成,通入SO2气体,溶液变成无色,因为碘单质与SO2反应生成硫酸和氢碘酸,得2CuSO4+4KI===2CuI↓+I2+2K2SO4,氧化性:Cu2+>I2;又根据SO2+I2+2H2O===H2SO4+2HI,氧化性:I2>SO2,A、B错误;通入SO2时发生氧化还原反应使碘单质被消耗,溶液褪色,体现SO2的还原性,C错误;硫酸铜和碘化钾反应的化学方程式是2CuSO4+4KI===2CuI↓+I2+2K2SO4,由方程式可知转移2 mol e-时生成2 mol CuI沉淀,D正确。 5.将过量H2O2溶液加入含(NH4)2CrO4的氨水中,加热后冷却,生成暗棕红色晶体M[化学式为Cr(NH3)3O4],其离子方程式为CrO+3NH3+3H2O2===M+2H2O+2OH-+O2↑,测得M中有2个过氧键。下列叙述正确的是( D ) A.M中Cr的化合价为+3 B.参与反应的H2O2全部被氧化 C.向FeSO4溶液中滴加几滴M的溶液,没有明显现象 D.转移0.2 mol电子时,生成M的质量为16.7 g 解析:因M中有2个过氧键,在过氧键中的氧元素是-1价,则M中Cr的化合价为+4,A错误;因M中有2个过氧键,所以3 mol H2O2中只有1 mol被氧化,B错误;向FeSO4溶液中滴加几滴M的溶液,M中的过氧键氧化Fe2+,溶液由浅绿色变为棕黄色,C错误;根据方程式知生成1 mol O2时,转移2 mol电子,同时生成1 mol M,所以转移0.2 mol电子时,生成M的质量为16.7 g,D正确。 6.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为( D ) A.2 B.3 C.4 D.5 解析:本题考查在氧化还原反应中用得失电子守恒进行相关的计算。 7 得关系式1×[6-(-)]·x=16×2,x=5。 7.将38.4 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol·L-1 NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为( D ) A.1.0 mol B.0.8 mol C.0.6 mol D.0.4 mol 解析:可以将反应理解为Cu+HNO3+NaOH―→Cu(NO3)2+NaNO3+NaNO2+H2O(未配平),由此可知,发生化合价变化的元素只有Cu和N,所以38.4 g(0.6 mol) Cu失去1.2 mol电子,硝酸也应该得到1.2 mol 电子生成0.6 mol NaNO2(一个氮原子得到2个电子)。根据钠原子守恒,加入1 mol 氢氧化钠,则n(NaNO3)+n(NaNO2)=1 mol,已知有0.6 mol NaNO2,则有0.4 mol NaNO3。 8.某离子反应中涉及H2O、ClO-、NH、H+、N2、Cl-六种微粒。其中ClO-的物质的量随时间变化的曲线如图所示。下列判断正确的是( B ) A.该反应的还原剂是Cl- B.反应后溶液的酸性明显增强 C.消耗1 mol 还原剂,转移6 mol 电子 D.氧化剂与还原剂的物质的量之比为2∶3 解析:由曲线变化图可知,随反应进行具有氧化性的ClO-物质的量减小,则ClO-为反应物,由氯元素守恒可知Cl-是生成物,根据所含有的NH和N2,其中NH有还原性,故N2是生成物,则反应的方程式应为3ClO-+2NH===N2↑+3H2O+3Cl-+2H+,Cl-为还原产物,A错误;反应生成H+,溶液酸性增强,B正确;氮元素化合价由-3价升高到0价,则消耗1 mol 还原剂,转移3 mol 电子,C错误;氧化剂和还原剂的物质的量之比为3∶2,D错误。 9.氧化还原反应实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-===NO↑+2H2O,KMnO4、Na2CO3、Cu2O、FeSO4四种物质中有物质甲能使上述还原过程发生。则下列说法中正确的是( C ) A.物质甲可能是KMnO4 7 B.总反应中只体现了硝酸的强氧化性 C.反应中若产生3.0 g气体,则转移电子数为0.3NA D.氧化过程的反应式一定为Cu2O-2e-+2H+===2Cu2++H2O 解析:硝酸根得到电子是氧化剂,则物质甲应是还原剂,高锰酸钾一般作氧化剂,A错误;反应中还有硝酸盐生成,还体现硝酸的酸性,B错误;3.0 g NO是0.1 mol,转移电子的物质的量是0.3 mol,C正确;作还原剂的可以是氧化亚铜,也可以是硫酸亚铁,D错误。 10.向含有5×10-3 mol HIO3与少量淀粉的溶液中通入H2S,溶液变蓝且有S析出,继续通入H2S,溶液的蓝色褪去,则在整个过程中( D ) A.共得到0.96 g硫 B.通入H2S的体积为336 mL C.碘元素先被还原后被氧化 D.转移电子总数为3.0×10-2NA 解析:由题知:HIO3~3H2S~3S,得到的硫的质量是5×10-3×3×32 g=0.48 g,故A错误;整个过程中消耗0.015 mol的H2S,标况下体积为336 mL,但题目未注明是否为标准状况,故B错误;整个过程碘元素被还原,故C错误;根据得失电子守恒、原子守恒,得到HIO3~3H2S~3S~I-~6e-,消耗5×10-3 mol HIO3伴随0.03 mol 电子转移,转移电子总数为3.0×10-2NA,故D正确。 11.在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性,跟Zn、H2O反应的化学方程式如下:2ICl+2Zn===ZnCl2+ZnI2,ICl+H2O===HCl+HIO,下列关于ICl性质的叙述正确的是( B ) A.ZnCl2既是氧化产物,又是还原产物 B.ZnI2既是氧化产物,又是还原产物 C.ICl跟H2O的反应,ICl是氧化剂,H2O是还原剂 D.反应6.5 g Zn,转移电子0.1 mol 解析:2ICl+2Zn===ZnCl2+ZnI2中,Zn元素的化合价升高,I元素的化合价降低,而ICl+H2O===HCl+HIO中,各元素的化合价不变。在反应中ZnCl2是氧化产物,故A错误;在反应中ZnI2既是氧化产物,又是还原产物,故B正确;ICl+H2O===HCl+HIO中,各元素的化合价不变,不属于氧化还原反应,故C错误;6.5 g Zn 的物质的量为0.1 mol,反应后生成Zn2+,转移电子0.2 mol,故D错误。 12.将第ⅤB族元素金属单质铌(Nb)与I2、Nb2O5置于封闭容器中,控制温度进行反应:6Nb+15I2+2Nb2O510NbOI3。下列说法错误的是( C ) A.Nb的最高化合价为+5 B.Nb2O5具有酸性氧化物的性质 C.还原剂与氧化剂的物质的量之比为6∶17 7 D.6 mol Nb参加反应共转移30 mol电子 解析:铌的最高化合价为+5,A正确;Nb2O5是酸性氧化物,B正确;氧化剂为碘,还原剂为Nb,反应前后Nb2O5中Nb的化合价没有变化,还原剂与氧化剂的物质的量之比为6∶15,C错误;6 mol Nb参加反应共转移30 mol 电子,D正确。 13.高锰酸钾又称过锰酸钾、灰锰氧、PP粉等,是一种强氧化剂,有较好的杀菌作用,是中学化学常见的氧化剂。工业上用软锰矿(主要成分为MnO2)制备高锰酸钾的流程如图(部分条件和产物省略): 请回答下列问题: (1)写出实验室加热高锰酸钾生成锰酸钾的化学方程式:2KMnO4K2MnO4+MnO2+O2↑。 (2)操作Ⅱ的实验目的是将混合在一起的KMnO4和K2CO3分离。 (3)熔融过程中,生成1 mol K2MnO4,转移电子的物质的量为2 mol。 (4)CO2与K2MnO4溶液反应的离子方程式为3MnO+2CO2===2MnO+MnO2↓+2CO。 (5)电解过程中,使用的是惰性电极,则: ①阳极的电极反应式为MnO-e-===MnO。 ②阴极附近溶液的pH将增大(填“增大”“减小”或“不变”)。 14.(2019·湖南湘阴联考)“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾、硝酸铵和氰化钠(NaCN)。请回答下列问题: (1)钠、钾着火,下列可用来灭火的是D。 A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭 (2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应,下列反应可能发生的是A、B、D、F。 A.NH4NO3―→N2↑+O2↑+H2O B.NH4NO3―→NH3↑+HNO3 C.NH4NO3―→O2↑+HNO3+H2O D.NH4NO3―→N2↑+HNO3+H2O E.NH4NO3―→N2↑+NH3↑+H2O 7 F.NH4NO3―→N2O↑+H2O (3)NaCN属于剧毒物质,有多种无害化处理方法。 ①H2O2处理法:NaCN+H2O2―→N2↑+X+H2O 推测X的化学式为NaHCO3。 ②NaClO处理法:aCN-+bClO-+2cOH-===dCNO-+eN2↑+fCO+bCl-+cH2O,方程式中e∶f的值为B(填选项标号)。 A.1 B.1/2 C.2 D.不能确定 (4)以TiO2为催化剂用NaClO将CN-氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-的废水与过量NaClO溶液的混合液共200 mL(设其中CN-的浓度为0.2 mol·L-1)进行实验。 ①写出CNO-在酸性条件下被NaClO氧化的离子方程式:2CNO-+6ClO-+8H+===N2↑+2CO2↑+3Cl2↑+4H2O; ②若结果测得CO2的质量为1.408 g,则该实验中测得CN-被处理的百分率为80.0%。 解析:(1)K、Na与水、CO2均能剧烈反应,故钠、钾着火时应使用扑灭金属火灾的专用灭火器灭火,没有专用灭火器时可用细沙盖灭。 (2)C中反应NH4NO3―→O2↑+HNO3+H2O只有化合价升高的元素而没有化合价降低的元素,不符合氧化还原反应原理,故该反应不能发生;E中反应NH4NO3―→N2↑+NH3↑+H2O可认为是氧化,二者均变为,但由于得电子数比失电子数多,因此生成物中应剩余而不应剩余,即不应有NH3生成,所以该反应也不能发生。 (3)①由反应NaCN+H2O2===N2↑+X+H2O可知,CN-被H2O2氧化,其中被氧化为,应被氧化为,则X可能为Na2CO3或NaHCO3,由于反应前Na、C的原子个数比为1∶1,故X只能是NaHCO3。 ②根据反应前后N原子守恒有2e+d=a……①,根据C原子守恒有f+d=a……②,联立①②解得=。 (4)②n(CO2)==0.032 mol,根据C原子守恒有n(CN-)=n(CO2)=0.032 mol,即被处理的CN-的物质的量为0.032 mol,而CN-的总物质的量为0.2 mol·L-1×0.2 L=0.04 mol,则CN-被处理的百分率为×100%=80.0%。 15.为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。 7 实验过程: Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入分液漏斗B中,继续通入N2,然后关闭K1、K3、K4。 Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。 Ⅲ.当B中溶液变黄时,停止加热,关闭K2。 Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。 Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。 Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。 (1)过程Ⅰ的目的是排出装置中的空气,防止干扰。 (2)棉花中浸润的溶液为NaOH溶液。 (3)实验Ⅴ中观察的现象是B中溶液黄色逐渐变为浅绿色。 Ⅳ、Ⅵ中欲检验的离子是Fe3+、SO。 (4)B中发生反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,2Fe3++SO2+2H2O===2Fe2++SO+4H+。 解析:(1)通入N2的目的是排出装置中的空气,防止干扰。 (2)棉花中浸润的溶液为NaOH溶液,除氯气、SO2。 (3)B中Fe3+被SO2还原,所以黄色变为浅绿 B中通Cl2后检验的是Fe3+,通SO2后检验SO。 7查看更多