- 2021-08-23 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学必修1第3章 第2节 第1课时
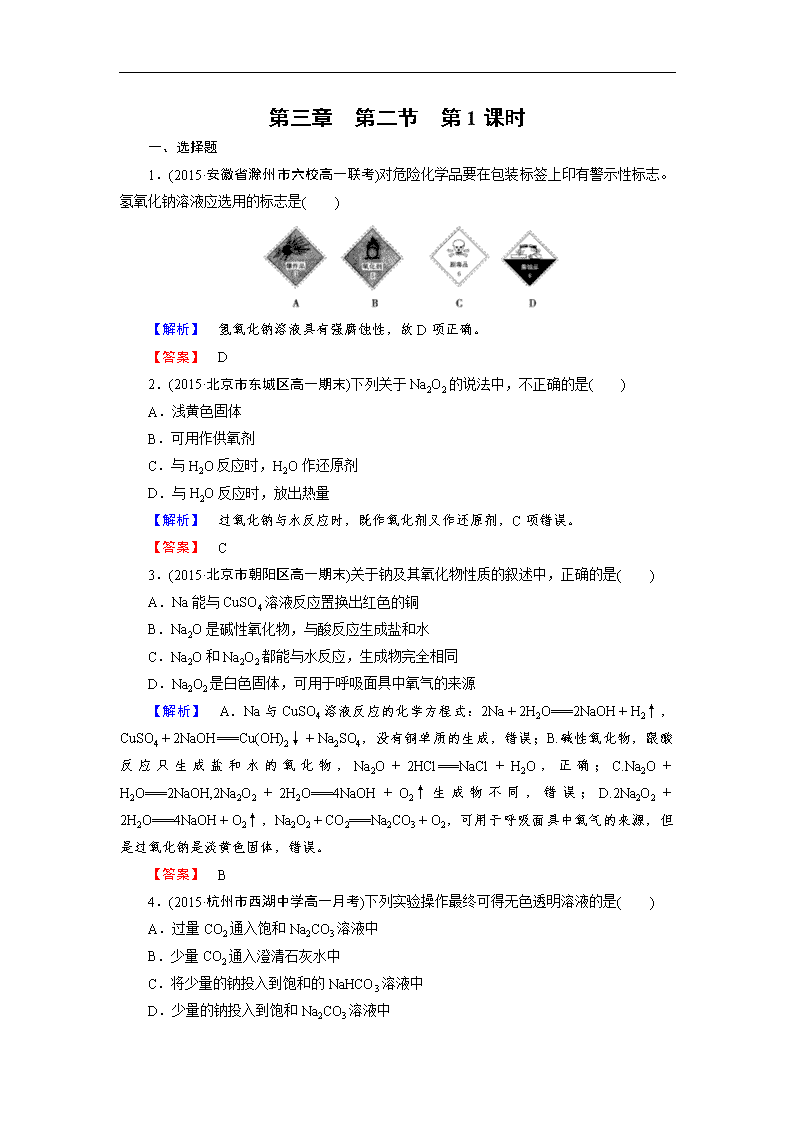
第三章 第二节 第1课时 一、选择题 1.(2015·安徽省滁州市六校高一联考)对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的标志是( ) 【解析】 氢氧化钠溶液具有强腐蚀性,故D项正确。 【答案】 D 2.(2015·北京市东城区高一期末)下列关于Na2O2的说法中,不正确的是( ) A.浅黄色固体 B.可用作供氧剂 C.与H2O反应时,H2O作还原剂 D.与H2O反应时,放出热量 【解析】 过氧化钠与水反应时,既作氧化剂又作还原剂,C项错误。 【答案】 C 3.(2015·北京市朝阳区高一期末)关于钠及其氧化物性质的叙述中,正确的是( ) A.Na能与CuSO4溶液反应置换出红色的铜 B.Na2O是碱性氧化物,与酸反应生成盐和水 C.Na2O和Na2O2都能与水反应,生成物完全相同 D.Na2O2是白色固体,可用于呼吸面具中氧气的来源 【解析】 A.Na与CuSO4溶液反应的化学方程式:2Na+2H2O===2NaOH+H2↑,CuSO4+2NaOH===Cu(OH)2↓+Na2SO4,没有铜单质的生成,错误;B.碱性氧化物,跟酸反应只生成盐和水的氧化物,Na2O+2HCl===NaCl+H2O,正确;C.Na2O+H2O===2NaOH,2Na2O2+2H2O===4NaOH+O2↑生成物不同,错误;D.2Na2O2+2H2O===4NaOH+O2↑,Na2O2+CO2===Na2CO3+O2,可用于呼吸面具中氧气的来源,但是过氧化钠是淡黄色固体,错误。 【答案】 B 4.(2015·杭州市西湖中学高一月考)下列实验操作最终可得无色透明溶液的是( ) A.过量CO2通入饱和Na2CO3溶液中 B.少量CO2通入澄清石灰水中 C.将少量的钠投入到饱和的NaHCO3溶液中 D.少量的钠投入到饱和Na2CO3溶液中 【解析】 A.二氧化碳通入饱和碳酸钠中反应生成碳酸氢钠,由于碳酸氢钠的溶解度小于碳酸钠,所以会有沉淀析出,不选A;B.少量二氧化碳通入石灰水中反应生成碳酸钙沉淀,不选B;C.钠和水反应生成氢氧化钠,氢氧化钠和碳酸氢钠反应生成碳酸钠,由于碳酸钠的溶解度大于碳酸氢钠,所以没有沉淀析出,选C;D.钠和水反应生成氢氧化钠和氢气,消耗了水,使得原来饱和的碳酸钠溶液中溶质过多而析出,不选D。 【答案】 C 5.(2015·重庆市杨家坪中学高一月考)一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增加14 g,则原混合气体中CO和O2的物质的量之比是( ) A.4︰9 B.1︰1 C.7︰6 D.4︰3 【解析】 由反应2Na2O2+2CO2===2Na2CO3+O2,可知混合物在常温下跟足量的Na2O2固体反应生成固体为Na2CO3,1 mol Na2O2生成1 mol Na2CO3,质量增加28 g,恰好为CO的质量,固体增重14 g,说明混合气体中CO为14 g,则O2为26 g-14 g=12 g,所以原混合气体中CO和O2的质量比为14 g︰12 g=7︰6。 【答案】 C 【点评】 本题考查了混合物的相关计算,需要一定的观察能力,难度中等。解题时可以从物质的化学式组成上入手分析,可以大大简化理解和计算过程。 6.(2015·杭州市西湖中学高一月考)用1 L 1 mol·L-1NaOH溶液吸收0.8 mol CO2,所得溶液中Na2CO3和NaHCO3的物质的量之比约为( ) A.1︰3 B.1︰2 C.2︰3 D.3︰2 【解析】 假设生成的碳酸钠和碳酸氢钠的物质的量分别为x mol、y mol。根据钠离子守恒,2x+y=1,根据碳原子守恒:x+y=0.8,解得x=0.2,y=0.6,所以比例为1︰3,选A。 【答案】 A 7.(2015·江西省德镇市高一期末)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( ) A.取a克混合物充分加热,减重b克 B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 C.取a克混合物与足量稀硫酸充分反应,逸出气体用固体NaOH吸收,增重b克 D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 【解析】 在Na2CO3和NaHCO3中,加热能分解的只有NaHCO3,A项能测定;取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体产物是NaCl,Na2CO3 和NaHCO3转化为NaCl时的固体质量变化不同,B项能测定;NaOH可以同时吸收CO2和水蒸气,C项不能测定,同理,Na2CO3和NaHCO3转化为BaCO3时的固体质量变化也不同,D项能测定;选C。 【答案】 C 8.(2015·甘肃省肃南县一中高一期末)把7.4 g Na2CO3·10 H2O和NaHCO3组成的固体混合物溶于水配成100 ml溶液,其中c(Na+)=0.6 mol·L-1。若把等质量的固体混合物加热至恒重,残留固体的质量是( ) A.3.18 g B.2.12 g C.4.22 g D.5.28 g 【解析】 把固体混合物加热至恒重的话最后的物质是Na2CO3,根据Na守恒,n(Na+)=0.6 mol·L-×0.1 L=0.06 mol,则残留的Na2CO3的物质的量为0.03 mol,质量为3.18 g。 【答案】 A 9.(2015·山东省桓台县二中高三期末)向NaOH和Na2CO3混合溶液中滴加0.1 mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( ) A.在0~a范围内,只发生中和反应 B.ab段发生反应的离子方程式为:CO+2H+===H2O+CO2↑ C.a=0.3 D.原混合溶液中NaOH与Na2CO3的物质的量之比为1︰2 【解析】 A.在氢氧化钠与碳酸钠的混合液中,先发生氢离子与氢氧根离子的中和反应,再发生碳酸根离子与氢离子生成碳酸氢根离子的反应,所以在0~a范围内,不只发生中和反应,错误;B.a点溶液为氯化钠和碳酸氢钠溶液,所以ab段发生反应的离子方程式为:HCO+H+===H2O+CO2↑,错误;C.根据生成的二氧化碳的物质的量可知原溶液中有0.01 mol 的碳酸钠,0.01 mol的碳酸钠与0.01 mol的氢离子反应生成0.01 mol的碳酸氢根离子,0.01 mol的碳酸氢根离子需要0.01 mol的氢离子反应生成0.01 mol的二氧化碳,所以生成二氧化碳所消耗盐酸是0.01 mol/0.1 mol/L=0.1 L,即0.4-a=0.1,所以a=0.3,正确;D.碳酸钠的物质的量是0.01 mol,生成碳酸氢根离子消耗盐酸的体积是0.1 L,则氢氧化钠消耗盐酸的体积是0.3-0.1=0.2 L,所以氢氧化钠的物质的量是0.2 L×0.1 mol/L=0.02 mol,原混合溶液中NaOH与Na2CO3的物质的量之比为2︰1,错误,答案选C。 【答案】 C 10.(2015·山东省枣庄二中高三模拟)某学生用NaHCO3和KHCO3 组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)。则下列分析、推理不正确的是( ) 盐酸的体积 50 mL 50 mL 50 mL m(混合物)/g 9.2 15.7 27.6 V(CO2)/L(STP) 2.24 3.36 3.36 A.盐酸的物质的量浓度为3.0 mol·L-1 B.根据表中数据不能计算出混合物中NaHCO3的质量分数 C.加入混合物9.2 g时盐酸过量 D.15.7 g混合物未与盐酸完全反应 【解析】 A.根据表中数据可知第三次实验中盐酸一定是不足的,CO2的物质的量是0.15 mol,则根据方程式HCO+H+===H2O+CO2↑可知盐酸的浓度是0.15 mol÷0.05 L=3.0 mol/L,A正确;B.第一次实验中盐酸是过量的,则根据固体质量和CO2的物质的量可以计算碳酸氢钠的质量分数,B错误;C.在9.2 g固体的基础上继续增加质量,生成的CO2体积继续增加,这说明加入混合物9.2 g时盐酸过量,C正确;D.如果15.7 g固体完全反应,则产生CO2的体积是×2.24L=3.82L,而实际产生的是3.36 L,因此盐酸不足,D正确,答案选B。 【答案】 B 二、非选择题 11.(2015·唐山一中高一月考)常见化合物A、B,其焰色反应均呈黄色,C是一种单质。转化关系如图所示(其他物质均已略去)。 回答下列问题: (1)A在通常情况下为淡黄色粉末,常做潜水艇中的供氧剂,写出A的化学式________________。 (2)写出④的化学方程式________________。 (3)若溶液E中仅含一种溶质,写出⑤的离子方程式________________。 (4)若A、B混合物在密闭容器中加热,充分反应后,只得到一种固体化合物。则A、B的物质的量之比为________________。 【解析】 本题重在找到突破口,常见化合物A、B,其焰色反应均呈黄色,故其为Na的化合物,A在通常情况下为淡黄色粉末,常做潜水艇中的供氧剂,根据此信息,推测A为Na2O2;由于C为气体单质,且是A、B的混合物加热反应而来,推测C可能为O2,能与Na2O2反应生成O2的常见物质是水和二氧化碳,由于NaHCO3分解会生成水和二氧化碳,且B为Na的化合物,所以B是NaHCO3很合理,与稀硫酸反应产生无色无味气体D,那么D为CO2;溶液E为Na2O2与水反应生成的氢氧化钠,氢氧化钠再与碳酸氢钠反应生成的Na2CO3溶液。④的化学方程式是2NaHCO3Na2CO3+CO2↑+H2O;⑤的离子方程式为碳酸钠溶液与CO2的反应CO+CO2+H2O===2HCO;Na2O2、NaHCO3混合物在密闭容器中加热,充分反应后,剩余固体可能为碳酸钠或者碳酸钠与氢氧化钠(更过量时还有余过氧化钠)的混合物;只得到一种固体化合物,则该固体应该为碳酸钠,2NaHCO3Na2CO3+CO2↑+H2O、2Na2O2+2CO2===2Na2CO3+O2↑,依据方程式,也就是2 mol的NaHCO3产生1 mol的CO2,刚好能把1 mol的Na2O2转化为Na2CO3,所以Na2O2、NaHCO3的物质的量之比为1︰2时刚好生成Na2CO3,即使NaHCO3过量,即Na2O2、NaHCO3的物质的量之比小于1︰2也只有碳酸钠剩余,故A、B的物质的量之比为≤1︰2。 【答案】 (1)Na2O2 (2)2NaHCO3Na2CO3+CO2↑+H2O (3)CO+CO2+H2O===2HCO (4)≤1︰2 【点评】 本题属于无机框图推断题,考查的比较基础,突破口是过氧化钠的性质。Na2O2、NaHCO3混合物在密闭容器中加热,充分反应后的剩余物质的成分也值得同学们再做深入细致的分析。 12.(2015·吉林省松原市扶余县一中高一期中)将Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100 mL盐酸,充分反应后溶液为中性,放出气体(已干燥)2.24 L(标准状况),将生成的气体全部通入另一份混合粉末,充分反应后气体的体积变为2.016 L(标准状况),问: (1)2.24 L气体的成分为:________________; (2)试通过讨论并计算每份混合粉末中Na2O2和NaHCO3的物质的量: 第一种情况:n(Na2O2)=________mol和n(NaHCO3)=________mol; 第二种情况:n(Na2O2)=________mol和n(NaHCO3)=________mol。 【解析】 (1)Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100 mL盐酸,充分反应后溶液为中性,则反应后溶质为氯化钠,根据反应2Na2O2+4HCl===4NaCl+2H2O+O2↑,NaHCO3+HCl===NaCl+H2O+CO2↑,可知,2.24 L混合气体为O2和CO2,故答案为:O2和CO2;(2)2.24 L混合气体的物质的量为:=0.1 mol, 2.016 L气体的物质的量为:=0.09 mol, 2Na2O2+2CO2===2Na2CO3+O2 △n 2 2 1 m n 0.1 mol-0.9 mol=0.01 mol 则:n=m=0.02 mol。第一种情况:若CO2完全反应,则第一份生成CO2的物质的量为0.02 mol,O2的物质的量为0.1 mol-0.02 mol=0.08 mol,则由2Na2O2+4HCl===4NaCl+2H2O+O2↑过氧化钠的物质的量为0.08 mol×2=0.16 mol;NaHCO3+HCl===NaCl+H2O+CO2↑生成二氧化碳为0.02 mol,则碳酸氢钠为0.02 mol,所以Na2O2为0.16 mol,NaHCO3为0.02 mol;第二种情况,若CO2未完全反应,则Na2O2的物质的量为0.02 mol, 2Na2O2+4HCl===4NaCl+2H2O+O2↑ 0.02 mol 0.01 mol 则第一份生成O2的为0.01 mol,所以CO2的物质的量为:0.1 mol-0.01 mol=0.09 mol,由NaHCO3+HCl===NaCl+H2O+CO2↑,故碳酸氢钠为0.09 mol所以Na2O2为0.02 mol,NaHCO3为0.09 mol。 【答案】 (1)O2和CO2;(2)第一种情况n(Na2O2)=0.16 mol和n(NaHCO3)=0.02 mol;第二种情况:n(Na2O2)=0.02 mol和n(NaHCO3)=0.09 mol。 13.(2015·唐山市一中高一期蝇)过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用,它与二氧化碳反应的化学方程式为:2Na2O2+2CO2===2Na2CO3+O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95 g过氧化钠样品为原料,制取O2,设计出如下实验装置: (1)A中制取CO2的装置,应从下列图①和②中选哪个图:________ B装置的作用是________,C装置内出现的现象是________________。为了检验E中收集到的气体,在取出集气瓶后,用________的木条伸入集气瓶内,木条会出现________________。 (2)若E中的石灰水出现轻微白色浑浊,请说明原因:________________。 (3)反应完毕时,若测得E中的集气瓶收集到的气体250毫升,又知氧气的密度为1.43克/升,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值________(偏大或偏小),相差约________毫升(取整数值,所用数据均在标准状况下测定),这可能是由于______________________________。 (4)你认为上述A-E的实验装置中,E部分是否安全、合理? E是否需要改进,若需要改进,应改为下图中的________(填甲、乙、丙、丁)。 【解析】 (1)该反应的药品是固体和液体,且不需加热,所以所需装置为固液混合不加热型,所以排除①,故选②;大理石和盐酸的反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢气体、水蒸气,氯化氢和碳酸氢钠能反应生成二氧化碳,二氧化碳和碳酸氢钠不反应,水蒸气能使无水硫酸铜由白色变蓝色,所以C装置内可能出现的现象是白色固体变蓝色;过氧化钠和二氧化碳反应生成氧气,氧气能使带火星的木条复燃。(2)二氧化碳能使澄清的石灰水变浑浊,若E中石灰水出现轻微白色浑浊,说明未反应的二氧化碳与石灰水反应所致。(3)1.95 g过氧化钠的物质的量为=0.025 mol,由关系式2 Na2O2—O2得,氧气的体积为22.4 L/mol×=0.28 L>250 mL,所以实际收集到的氧气体积比理论计算值小,280 mL-250 mL=30 mL,原因是Na2O2可能含有其它杂质;D装置可能有氧气未被排出。(4)E装置容易产生倒吸现象,所以不安全、不合理,所以需要改进;饱和石灰水能和二氧化碳反应,所以饱和石灰水的作用是吸收二氧化碳,收集较纯净的氧气,乙试管中进气管较长,二氧化碳能充分和饱和石灰水反应,丙试管中进气管较短,导致二氧化碳和饱和石灰水反应不充分,且随着气体的进入,导管中的液体被排到水糟中,故选乙。 【答案】 (1)图②;吸收A装置中产生的HCl;变蓝;带火星的木条;复燃;(2)D中有部分CO2未参加反应流入E中;生成沉淀;(3)偏小;30;Na2O2可能含有其它杂质;D装置可能有氧气未被排出。(4)不安全,不合理 乙 14.(2015·西安市庆安中学高一期末)有一种白色粉末是无水碳酸钠和碳酸氢钠的混合物,称取0.442 g灼烧至恒重,把放出的气体通入足量澄清石灰水中,生成0.200 g沉淀,灼烧后的残渣能与30 mL盐酸恰好完全反应。试求:(1)原混合物中各物质的质量。(2)所用盐酸的物质的量浓度。 【解析】 (1)0.200 g碳酸钙的物质的量为0.200 g/100 g·mol-1=0.002 mol,根据碳元素守恒可知,n(CO2)=n(CaCO3)=0.002 mol。加热无水碳酸钠和碳酸氢钠的混合物,发生反应:2NaHCO3Na2CO3+CO2↑+H2O,由方程式可知,n(NaHCO3)=2n(CO2)=0.002 mol×2=0.004 mol,故碳酸氢钠的质量为0.004 mol×84 g·mol-1=0.336 g,故碳酸钠的质量为0.442 g-0.336 g=0.106 g。(2)原混合物中n(NaHCO3)=0.004 mol,n(Na2CO3)=0.106 g/106 g·mol-1=0.001 mol,灼烧后的残渣为碳酸钠,能与30 mL盐酸恰好完全反应生成NaCl,根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯离子守恒有n(HCl)=n(NaCl),故n(HCl)=n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.001 mol×2+0.004 mol=0.006 mol,故盐酸的物质的量浓度为0.006 mol/0.03 L=0.2 mol/L。 【答案】 (1)NaHCO3 0.336 g Na2CO3 0.106 g (2)0.2 mol·L-1 查看更多