- 2021-08-23 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】福建省福州市2020届高三下学期3月高考适应性测试(线上)
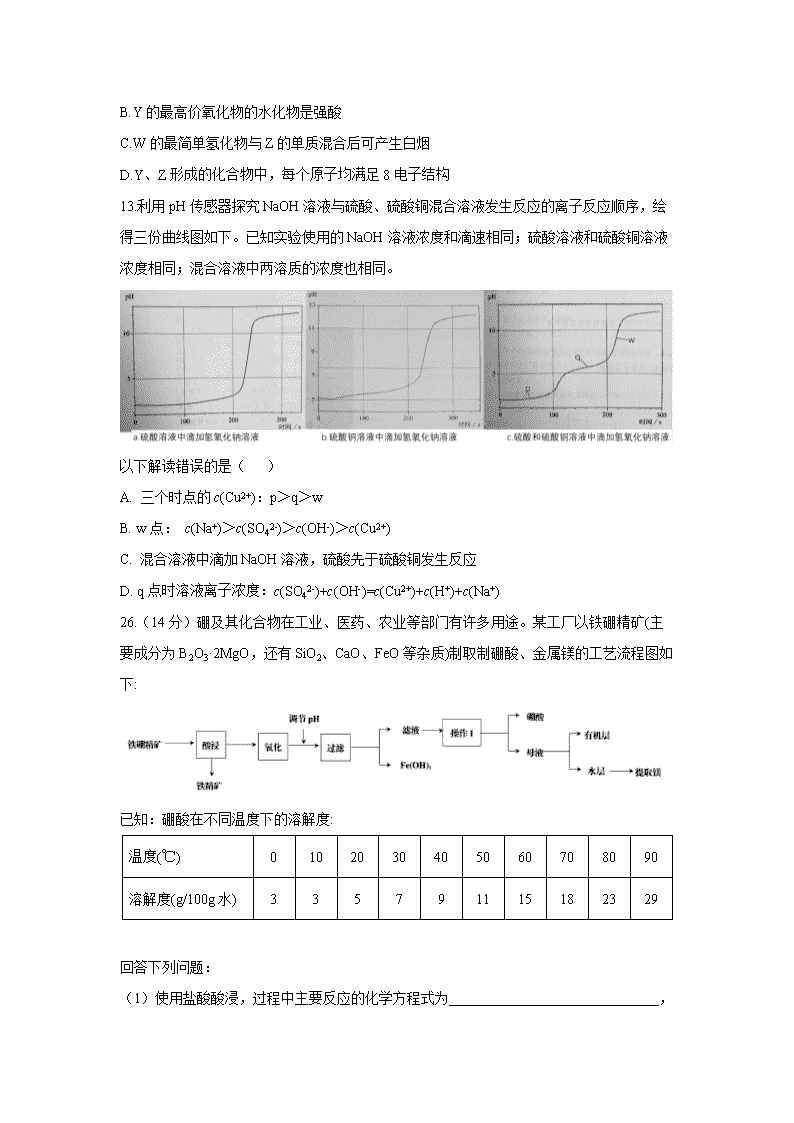
福建省福州市2020届高三下学期3月高考适应性测试(线上) 7. 化学与人类生活、生产和社会可持续发展密切相关,下列说法错误的是( ) A.84消毒液具有强氧化性,可用于居家环境杀菌消毒 B.加强生活垃圾分类与再生资源回收有利于践行“绿水青山就是金山银山”的理念 C.中国华为自主研发的5G芯片巴龙5000的主要材料是Si D.太阳能光催化环境技术技术可以将二氧化碳转化为燃料,该燃料属于一次能源 8. 从杨树中提取的Z是具有美白功效的化妆品的组分。现可用如下反应制备: 下列叙述错误的是( ) A.上述X+Y→Z反应属于加成反应 B.Z在苯环上的一氯代物有8种 C.Z所有碳原子不可能处于同一平面 D.Y可作为加聚反应的单体 9.实验室常用乙醇和浓硫酸共热制取乙烯:CH3CH2OH浓硫酸 170℃ H2C=CH2↑+H2O 某同学用以下装置进行乙烯制取实验。下列叙述不正确的是( ) A.m的作用是确保乙醇与浓硫酸能顺利流下 B.电控温值可设置在165-175℃ C.a出来的气体可用瓶口向下排空气法收集 D.烧瓶内可放几粒碎瓷片以防爆沸 10.生物固氮与模拟生物固氮都是重大基础性研究课题。大连理工大学曲景平教授团队设计合成了一类新型邻苯二硫酚桥联双核铁配合物,建立了双铁分子 仿生化学固氮新的功能分子模型。右图是所发论文插图。以下说法错误的是( ) A.催化剂不能改变反应的焓变 B.催化剂不能改变反应的活化能 C.图中反应中间体NXHY数值Y:X<3 D.图示催化剂分子中包含配位键 11. 某可充电钠离子电池放电时工作原理如图所示,下列说法错误的是 ( ) A.放电时电势较低的电极反应式为:Fe[Fe(CN)6]+2Na++2e- = Na2Fe[Fe(CN)6] B.外电路中通过0.2mol电子的电量时,负极质量变化为2.4g C.充电时,Mo箔接电源的正极 D.放电时,Na+从右室移向左室 12. 某抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Y、Z的最外层电子数之和是X的最外层电子数的2倍。下列叙述正确的是( ) A.元素的非金属性:W>Z>X B.Y的最高价氧化物的水化物是强酸 C.W的最简单氢化物与Z的单质混合后可产生白烟 D.Y、Z形成的化合物中,每个原子均满足8电子结构 13.利用pH传感器探究NaOH溶液与硫酸、硫酸铜混合溶液发生反应的离子反应顺序,绘得三份曲线图如下。已知实验使用的NaOH溶液浓度和滴速相同;硫酸溶液和硫酸铜溶液浓度相同;混合溶液中两溶质的浓度也相同。 以下解读错误的是( ) A. 三个时点的c(Cu2+):p>q>w B. w点: c(Na+)>c(SO42-)>c(OH-)>c(Cu2+) C. 混合溶液中滴加NaOH溶液,硫酸先于硫酸铜发生反应 D. q点时溶液离子浓度:c(SO42-)+c(OH-)=c(Cu2+)+c(H+)+c(Na+) 26.(14分)硼及其化合物在工业、医药、农业等部门有许多用途。某工厂以铁硼精矿(主要成分为B2O3·2MgO,还有SiO2、CaO、FeO等杂质)制取制硼酸、金属镁的工艺流程图如下: 已知:硼酸在不同温度下的溶解度: 温度(℃) 0 10 20 30 40 50 60 70 80 90 溶解度(g/100g 水) 3 3 5 7 9 11 15 18 23 29 回答下列问题: (1)使用盐酸酸浸,过程中主要反应的化学方程式为______________________________, 为提高浸出速率,可采取的措施有_________________________________(写出两条)。 (2)酸浸时,温度与硼浸出率的关系如图所示,则合适的酸浸温度为_________。 (3)浸出液“氧化”的是将溶液中的Fe2+用_______试剂氧化为Fe3+,反应的离子方程式为_____________________________________________。 (4)从滤液中获得H3BO3晶体的“操作I”具体操作是_____________________________。 (5)操作1后尚有约30%硼元素存在母液,向母液中加入有机萃取剂萃取分液,此时硼酸处于_________层中(填“有机”或“无机”)。实验室模拟“萃取”操作使用的玻璃仪器除烧杯外,另一主要玻璃仪器是_____________。 (6)某工厂用的铁硼精矿制备硼酸,得到纯度为99.8%的硼酸,则铁硼精矿中硼的质量分数是__________(列式表达)。 27.(14分)二氧化硫(SO2)是一种在空间地理、环境科学、地质勘探等领域受到广泛研究的一种气体。 Ⅰ.某研究小组设计了一套制备及检验SO2部分性质的装置,如图1所示。 (1)仪器A的名称____________。 (2)装置乙的作用是为了观察生成SO2的速率,则装置乙中加入的试剂是____________。 (3)①实验前有同学提出质疑:该装置没有排空气,而空气中的O2氧化性强于SO2 ,因此装置丁中即使有浑浊现象也不能说明是SO2导致的。请你写出O2与Na2S溶液反应的化学反应方程式________________________________________。 ②为进一步检验装置丁产生浑浊现象的原因,进行新的实验探究。实验操作及现象见下表。 序号 实验操作 实验现象 1 向10mL 1mol·L-1Na2S溶液中通O2 15min后,溶液才出现浑浊 2 向10mL 1mol·L-1Na2S溶液中通SO2 溶液立即出现黄色浑浊 由实验现象可知:该实验条件下Na2S溶液出现浑浊现象是SO2导致的。你认为上表实验1反应较慢的原因可能是____________________________________。 Ⅱ.铁矿石中硫元素的测定可以使用燃烧碘量法,其原理是以氮气为载体,以稀盐酸、淀粉和碘化钾的混合溶液为吸收液,用0.0010mol·L-1KIO3标准溶液进行滴定。检测装置如图2所示 [查阅资料] ①实验进行5min样品中的S元素都可转化为SO2 ②2IO3-+5SO2+4H2O 8H++5SO42- +I2 ③I2+SO2+2H2O2I-+SO42-+ 4H+ ④IO3-+5I-+6H+3I2+3H2O (4)工业设定的滴定终点现象是____________________________________。 (5)实验一:不放样品进行实验,5min后测得消耗标准液体积为V1 实验二:加入1g样品再进行实验,5min后测得消耗标准液体积为V2 ①比较数据发现V1远远小于V2,可忽略不计。则设置实验一的目的是________________。 ②测得V2的体积如下表 序号 1 2 3 KIO3标准溶液体积/mL 10.02 9.98 10.00 该份铁矿石样品中硫元素的质量百分含量为____________。 28.(15分)脱除工业废气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。 (1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。 已知:①4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1 ②N2(g)+O2(g)2NO(g) ΔH=+180 kJ·mol-1 ③H2O(g) H2O(l) ΔH=-44 kJ·mol-1 写出常温下,NH3还原NO反应的热化学方程式:_____________________________________。 (2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。 ①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3:4,则脱除后NO转化为____________。 ②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图1所示。图1中,40~60℃ NO脱除率上升可能的原因为___________________________________;60~80℃ NO脱除率下降可能的原因为____________________________________________。 图1 图2 (3)过硫酸钠(Na2S2O8)氧化去除NO 第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2 第二步: NaNO2继续被氧化为NaNO3,反应为NO2﹣+S2O82﹣+2OH﹣⇌NO3﹣+2SO42﹣+H2O。 不同温度下,平衡时NO2﹣的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图2 所示。 ①a、b、c、d四点平衡常数K由大到小的顺序为____________,原因是____________。 ②若a点(0.1,40%)时,NO2-的初始浓度为a mol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=____________。(用含a的代数式表示,已知65℃时Kw=1.0ⅹ10-13) (4)利用新型材料光催化脱除NO法如下图所示。 某电化小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应方程式为 ________________________________________________。 35.(15分)【化学——选修3:物质结构与性质】 铁被誉为“第一金属”,铁及其化合物广泛应用于生活、生产、国防等领域。 (1)已知:元素的一个基态的气态原子得到一个电子形成-1价气态阴离子时所放出的能量称为该元素的第一电子亲和能,用E1表示。从-1价的气态阴离子再得到1个电子,成为-2价的气态阴离子所放出的能量称为第二电子亲和能E2,依此类推。 FeO是离子晶体,其晶格能可通过如下的Born-Haber循环计算得到。 铁单质的原子化热为____________kJ·mol-1,FeO的晶格能为____________kJ·mol-1,基态O原子E1____________E2(填“大于”或“小于”),从原子结构角度解释_____________。 (2)乙二胺四乙酸又叫做EDTA(图1),是化学中一种良好的配合剂,形成的配合物叫做螯合物。EDTA在配位滴定中经常用到,一般是测定金属离子的含量。已知:EDTA配离子结构(图2)。 图1 图2 图3 EDTA中碳原子轨道的杂化类型为____________,EDTANa-Fe(Ⅲ)是一种螯合物,六个配位原子在空间构型为____________。EDTANa-Fe(Ⅲ)的化学键除了σ键和配位键键外,还存在____________。 (3) Fe3O4晶体中,O2-的重复排列方式如图3所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和如3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,O2-数与正四面体空隙数(包括被填充的)之比为____________,有____________%的正八面体空隙填充阳离子。Fe3O4晶胞的八分之一是图示结构单元(图3),晶体密度为5.18 g/cm3,则该晶胞参数a =____________pm。(写出计算表达式) 36. (15分)[化学——选修5《有机化学基础》] 为了寻找高效低毒的抗肿瘤药物,化学家们合成了一系列新型的1,3- 二取代酞嗪酮类衍生物。 (1)化合物B 中的含氧官能团为__________和__________(填官能团名称)。 (2)反应i-iv中属于取代反应的是___________。 (3)ii的反应方程式为___________________________________________________。 (4)同时满足下列条件的的同分异构体共有_____种,写出其中一种的结构简式: _________________________。 I.分子中含苯环;II.可发生银镜反应;III.核磁共振氢谱峰面积比为1∶2∶2∶2∶1 (5)是一种高效低毒的抗肿瘤药物,请写出以和和为原料制备该化合物的合成路线流程图(无机试剂任用): 。 【参考答案】 1.C 2.C 3.B 4.C 5.B 6.D 7.D 8.A 9.C 10.B 11.A 12.C 13.D 26. (14分) (1)B2O3·2MgO+4HCl+H2O = 2H3BO3+2MgCl2(2分), 适当增加盐酸浓度、提高反应温度、减小铁硼矿粉粒径、充分搅拌等(2分) (2)90-95℃(写此范围内的任意意均可得分)(1分) (3)H2O2(1分),2Fe2++ H2O2+ 2H+ = 2Fe3++ 2H2O(2分) (氯气也应该可以得分,2Fe2++ Cl2=2Fe3++2Cl-) (4)蒸发浓缩、冷却结晶、过滤(2分)……“冷却结晶”与“过滤”各1分 (5)有机(1分),分液漏斗(1分) (6)(2分) 27. (14分) Ⅰ(1)蒸馏烧瓶(2分) (2)饱和亚硫酸氢钠溶液(或其它合理答案)(2分) (3) ①O2+2H2O+2Na2S4NaOH+2S↓(2分) ②氧气在水中的溶解度比二氧化硫小(或其它合理答案)(2分) Ⅱ(4)吸收液出现稳定的蓝色(2分) (5) ①空白实验(2分) ②0.096%(0.097%等答案不给分)(2分) 28.(15分) (1)4NH3(g) + 6NO(g) 5N2(g) + 6H2O(l) ΔH=-2069.9 kJ·mol-1(2分) (2)①HNO3(或NO3-)(2分) ②温度升高,化学反应速率加快(2分) 温度升高,气体溶解度下降;(或温度升高,ClO-水解增强,HClO发生分解等)(回答1点即可,2分) (3)①K(b)>K(a)=K(c)=K(d)(1分) a、c、d三点在同一温度下,K值相同;b点温度升高,NO2-的脱除率上升,说明平衡向正向移动,K值增大(2分,要点:要答出d 点时温度发生的变化,不能只回答平衡正向移动。) ②128a20.3-1.2a(2分) (4)O2 + 2e- + 2H+ = H2O2(2分) 35.(15分)〔化学——选修3:物质结构与性质〕 (1)416.3(1分) 3902(1分) 小于(1分) 当负一价氧离子再获得电子时要克服负电荷之间的排斥力,因此要吸收能量(2分) (2) sp2,sp3 (2分) 八面体(1分) 离子键和π键 (2分) (3) 1 ∶2(2分) 50%(2分) (2分) 36.(15分)〔化学——选修5:有机化学基础〕 (1)羧基、羰基 (各1分,共2分) (2)ii,iii,iv (共3分,错一个扣1分) (3)+N2H4+2H2O(2分) (4)6(2分) (其中1种,2分) (5) (共4分)查看更多