高中化学第二章化学反应速率和化学平衡3化学平衡5等效平衡及转化率问题真题导思含解析 人教版选修4
等效平衡及转化率问题
1.(2018年高考·江苏卷)(双选)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1
容器2
容器3
反应温度T/K
700
700
800
反应物投入量
2 mol SO2、1 mol O2
4 mol SO3
2 mol SO2、1 mol O2
平衡v正(SO2)/(mol·L-1·s-1)
v1
v2
v3
平衡c(SO3)/(mol·L-1)
c1
c2
c3
平衡体系总压强p/Pa
p1
p2
p3
物质的平衡转化率α
α1(SO2)
α2(SO3)
α3(SO2)
平衡常数K
K1
K2
K3
下列说法正确的是( )
A.v1
K3,p2>2p3
C.v1α3(SO2)
D.c2>2c3,α2(SO3)+α3(SO2)<1
解析:若容器2体积增大一倍,则容器1和2为等效平衡,若为等效平衡,则平衡时容器2中n(SO3)是容器1的两倍,现压缩体积至与容器l相等,平衡正向移动,容器2中n(SO3)增大,则c2>2c1,A错误;该反应的正反应放热,故升高温度,平衡逆向移动,平衡常数减小,则K1>K3,根据A项分析,p2<2p1,而p1α3(SO2),C正确;根据A项分析,c2>2c1,升高温度,平衡逆向移动,c1>c3,则c2>2c3,又知α1(SO2)>α3(SO2),而α1(SO2)+α2(SO3)<1,所以α2(SO3)+α3(SO2)<1,D正确。
答案:CD
4
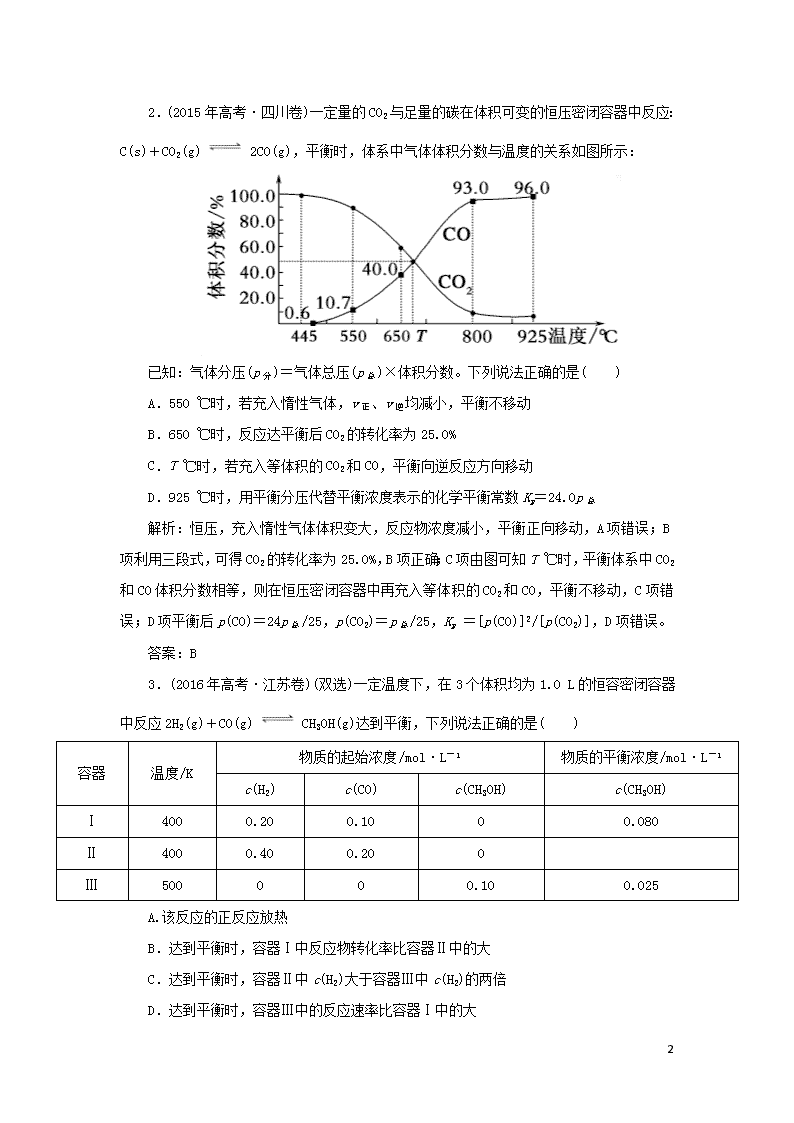
2.(2015年高考·四川卷)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
A.550 ℃时,若充入惰性气体,v正、v逆均减小,平衡不移动
B.650 ℃时,反应达平衡后CO2的转化率为25.0%
C.T ℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
解析:恒压,充入惰性气体体积变大,反应物浓度减小,平衡正向移动,A项错误;B项利用三段式,可得CO2的转化率为25.0%,B项正确;C项由图可知T ℃时,平衡体系中CO2和CO体积分数相等,则在恒压密闭容器中再充入等体积的CO2和CO,平衡不移动,C项错误;D项平衡后p(CO)=24p总/25,p(CO2)=p总/25,Kp =[p(CO)]2/[p(CO2)],D项错误。
答案:B
3.(2016年高考·江苏卷)(双选)一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g) CH3OH(g)达到平衡,下列说法正确的是( )
容器
温度/K
物质的起始浓度/mol·L-1
物质的平衡浓度/mol·L-1
c(H2)
c(CO)
c(CH3OH)
c(CH3OH)
Ⅰ
400
0.20
0.10
0
0.080
Ⅱ
400
0.40
0.20
0
Ⅲ
500
0
0
0.10
0.025
A.该反应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大
4
解析:A项中,KⅠ==2 500,KⅢ=≈14.82,由Ⅰ、Ⅲ比较,温度升高平衡向左移动,所以正反应为放热反应,A正确。B项中,容器Ⅱ相当于在容器Ⅰ的基础上压缩容器体积,压强增大,平衡右移,容器Ⅱ中的转化率比Ⅰ中大,B错误。C项中,容器Ⅱ中,增大压强,平衡向右移动,平衡时 c(H2)要小于Ⅰ中c(H2)的2倍;Ⅲ和Ⅰ比较,平衡时Ⅲ中c(H2)>Ⅰ中c(H2),所以容器Ⅱ中c(H2)小于容器Ⅲ中c(H2)的两倍,C错误。D项中,Ⅲ中温度为500 K,Ⅰ中温度为400 K,温度越高,反应速率越快,D正确。
答案:AD
4.(2017年高考·课标全国卷Ⅰ)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1=________%,反应平衡常数K=________。
(2)在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2______α1,该反应的ΔH______0(填“>”“<”或“=”)。
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)。
A.H2S B.CO2 C.COS D.N2
解析:(1)设平衡时H2S转化的物质的量为x。
H2S(g)+CO2(g) COS(g)+H2O(g)
初始/mol 0.40 0.10 0 0
转化/mol x x x x
平衡/mol 0.40-x 0.10-x x x
由题意得
=0.02
解得x=0.01 mol。
H2S的平衡转化率α1=×100%=2.5%。
K==
=≈2.8×10-3。
4
(2)温度升高,水的平衡物质的量分数增大,平衡右移,则H2S的转化率增大,故α2>α1。温度升高,平衡向吸热反应方向移动,故ΔH>0。
(3)A项,充入H2S,H2S的转化率反而减小;B项,充入CO2,增大了一种反应物的浓度,能够提高另一种反应物的转化率,故H2S的转化率增大;C项,充入COS,平衡左移,H2S的转化率减小;D项,充入N2,对平衡无影响,不改变H2S的转化率。
答案:(1)2.5 2.8×10-3 (2)> > (3)B
4