- 2021-08-23 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高一化学必修一详解总结元素化合物知识整合化合物知识点总结
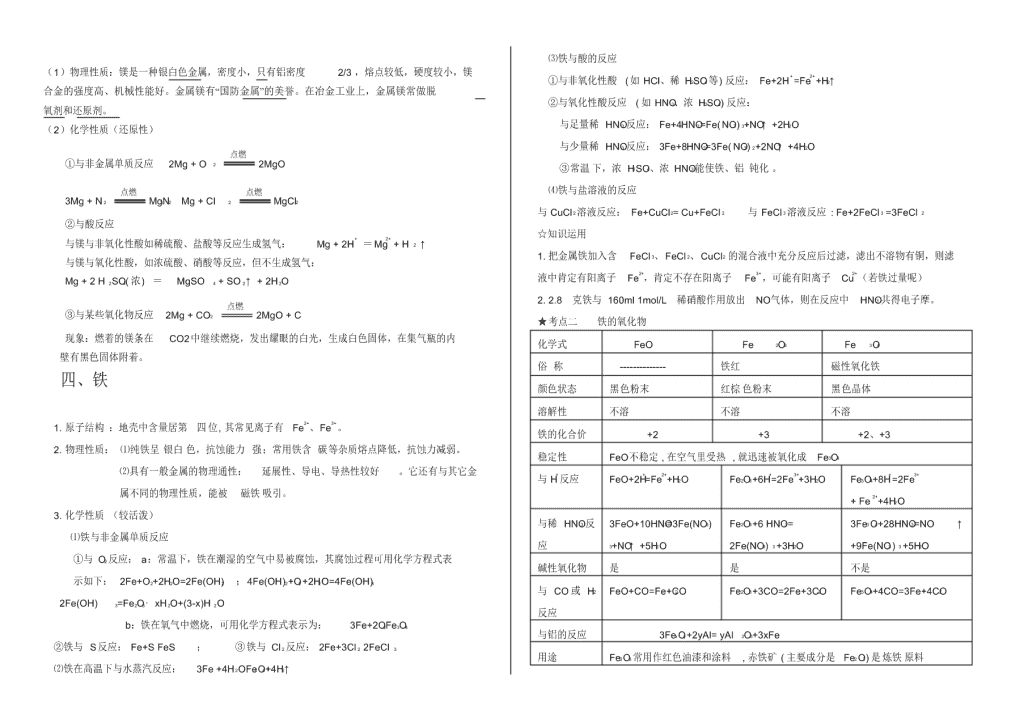
化合物知识点总结 一.金属钠 (一)钠 1.物性 金属钠是一种柔软 ,银白色、有金属光泽的金属,是热和电的良导体; 它的密度比水的密度小,比煤油的密度大,熔点为℃、沸点为℃ 2.化性 (1) 跟非金属反应: 4Na+O2=2Na2O,(空气中钠的切面变暗 2Na+O2 Na2O2 (黄色火焰 ) Na 2O2 比 Na2O 稳定 2Na+Cl 2 NaCl( 白烟 ) 钠与水反应: 2Na+2H2O =2NaOH +H2 ↑ 现象: ①浮:钠投入水中并浮在水面上 ②声:钠立即跟水反应,并放出热量,发出嘶嘶响 声,产生气体。③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失,④ 红 : 反 应 后 的 水 溶 液 使 酚 酞 变 红 。 钠 与 CuSO4 溶 液 反 应 2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2 ↑ 3. 钠的制取和存放 (1)制备: 2NaCl( 熔融 ) 2Na + Cl2↑ ( 2)钠的存放 : 少量金属钠可保存在煤油里。 (3) 用途: 强还原剂, 工业用它还原金属钛、 锆、铌等; 如:4Na+ TiCl 4(熔融) =Ti +4NaCl, 钠和钾的合金在常温下呈液态,是原子反应堆的导热剂;钠也可用于制高压钠灯 (二).钠的化合物 1.氧化钠和过氧化钠的比较 比较内容 Na2O Na2 O2 颜色、状态 白色固体 淡黄色固体 氧的化合价 — 2 价 — 1 价(过氧离子 O2 2— ) 稳定性 较不稳定 较稳定 生成条件 通过钠的常温氧化生成 通过钠的燃烧生成 物质类别 碱性氧化物 过氧化物(不是碱性氧化物) 与水反应 Na2O + H 2O==2NaOH 2Na2O2 + 2H 2O==4NaOH + O2↑ 与 CO2 反应 Na2O + CO2==Na2CO3 2Na2O2 + 2CO 2==2Na2CO3 + O 2 与盐酸反应 Na 2O + 2HCl==2NaCl + H2O 2Na2O2 + 4HCl==4NaCl + 2H 2O + O2↑ 用途 用于少量 Na2O2 制取 强氧化剂、漂白剂、供氧剂 保存 密封保存 密封保存 2.碳酸钠与碳酸氢钠 3.氢氧化钠( NaOH)是常见的强碱,是一种白色片状晶体, 。极易溶于水 ( 并放出大量热 ) , 易吸水而发生潮解,在空气中还易变质,反应为: 2NaOH+ CO2=Na2CO3+ H2O。 俗名:苛性钠、烧碱、火碱,氢氧化钠有很强腐蚀性,具有碱的通性。 保存:密封保存。试剂瓶不能用玻璃塞,应用橡皮塞。因为烧碱能与玻璃成分中的 SiO2 发生反应: SiO2+ 2NaOH= Na2 SiO3+ H2O,生成的 Na2SiO3 使玻璃塞与瓶口粘结。 二、镁的性质 碳酸钠 碳酸氢钠 俗名 苏打、纯碱 小苏打 色、态 白色粉未 白色粉未 水溶性 易溶于水 溶解度较碳酸钠小 热稳定性 稳定,受热不易分解 2NaHCO3 Na2CO3+CO2↑+H2O 与盐酸反 应 慢 Na 2CO3+HCl=NaCl+NaHCO3 Na2CO3+2HCl=2NaCl+CO2↑+H2 O 快 NaHCO3+HCl=NaCl+CO2↑+H2O 与碱反应 Na2CO3+Ca(OH)2=CaCO3+2NaOH NaHCO3+NaOH= Na2CO3+H2O 用途 重要化工原料,制玻璃、造纸 发酵粉 Mg MgO MgCl2 Mg (OH)2 Mg3N2 O2 或 CO2 HCl 加热 水解 HCl 电解 N2 强碱 (1)物理性质:镁是一种银白色金属,密度小,只有铝密度 2/3 ,熔点较低,硬度较小,镁 合金的强度高、机械性能好。金属镁有“国防金属”的美誉。在冶金工业上,金属镁常做脱 氧剂和还原剂。 (2)化学性质(还原性) ①与非金属单质反应 2Mg + O 2 点燃 2MgO 3Mg + N 2 点燃 Mg3N2 Mg + Cl 2 点燃 MgCl2 ②与酸反应 与镁与非氧化性酸如稀硫酸、盐酸等反应生成氢气: Mg + 2H+ = Mg2+ + H 2 ↑ 与镁与氧化性酸,如浓硫酸、硝酸等反应,但不生成氢气: Mg + 2 H 2SO4( 浓 ) = MgSO 4 + SO 2↑ + 2H 2O ③与某些氧化物反应 2Mg + CO2 点燃 2MgO + C 现象:燃着的镁条在 CO2中继续燃烧,发出耀眼的白光,生成白色固体,在集气瓶的内 壁有黑色固体附着。 四、铁 1. 原子结构 :地壳中含量居第 四 位 , 其常见离子有 Fe2+、Fe3+ 。 2. 物理性质: ⑴纯铁呈 银白 色,抗蚀能力 强;常用铁含 碳等杂质熔点降低,抗蚀力减弱。 ⑵具有一般金属的物理通性: 延展性、导电、导热性较好 。它还有与其它金 属不同的物理性质,能被 磁铁 吸引。 3. 化学性质 (较活泼) ⑴铁与非金属单质反应 ①与 O2 反应: a:常温下,铁在潮湿的空气中易被腐蚀,其腐蚀过程可用化学方程式表 示如下: 2Fe+O2+2H2O=2Fe(OH)2 ; 4Fe(OH)2+O2 +2H2O=4Fe(OH)3 2Fe(OH) 3=Fe2O3·xH 2O+(3-x)H 2O b:铁在氧气中燃烧,可用化学方程式表示为: 3Fe+2O2Fe3O4 ②铁与 S反应: Fe+S FeS ; ③ 铁与 Cl 2 反应: 2Fe+3Cl 2 2FeCl 3 ⑵铁在高温下与水蒸汽反应: 3Fe +4H2OFe3 O4+4H2↑ ⑶铁与酸的反应 ①与非氧化性酸 (如 HCl、稀 H2SO4 等) 反应: Fe+2H + =Fe2+ +H2↑ ②与氧化性酸反应 ( 如 HNO3、浓 H2SO4) 反应: 与足量稀 HNO3 反应: Fe+4HNO3=Fe(NO3) 3+NO↑+2H2O 与少量稀 HNO3 反应: 3Fe+8HNO3=3Fe( NO3) 2+2NO↑+4H2O ③常温 下,浓 H2SO4、浓 HNO3 能使铁、铝 钝化 。 ⑷铁与盐溶液的反应 与 CuCl 2 溶液反应: Fe+CuCl2= Cu+FeCl 2 与 FeCl 3 溶液反应 : Fe+2FeCl 3 =3FeCl 2 ☆知识运用 1. 把金属铁加入含 FeCl 3、 FeCl 2、 CuCl2 的混合液中充分反应后过滤,滤出不溶物有铜,则滤 液中肯定有阳离子 Fe2+,肯定不存在阳离子 Fe3+ ,可能有阳离子 Cu2+ (若铁过量呢) 2. 2.8 克铁与 160ml 1mol/L 稀硝酸作用放出 NO气体,则在反应中 HNO3 共得电子摩。 ★考点二 铁的氧化物 化学式 FeO Fe 2O3 Fe 3O4 俗 称 -------------- 铁红 磁性氧化铁 颜色状态 黑色粉末 红棕 色粉末 黑色晶体 溶解性 不溶 不溶 不溶 铁的化合价 +2 +3 +2、+3 稳定性 FeO不稳定 , 在空气里受热 , 就迅速被氧化成 Fe3O4 与 H+ 反应 FeO+2H+=Fe2++H2O Fe2O3+6H+=2Fe3++3H2O Fe3O4+8H+ =2Fe3+ + Fe 2++4H2O 与稀 HNO3 反 应 3FeO+10HNO3=3Fe(NO3) 3+NO↑+5H2O Fe2O3+6 HNO3= 2Fe(NO3) 3 +3H2O 3Fe3 O4+28HNO3=NO ↑ +9Fe(NO3 ) 3 +5H2O 碱性氧化物 是 是 不是 与 CO 或 H2 反应 FeO+CO=Fe+CO2 Fe2O3+3CO=2Fe+3CO2 Fe3O4+4CO=3Fe+4CO2 与铝的反应 3Fex Oy +2yAl= yAl 2O3+3xFe 用途 Fe2O3 常用作红色油漆和涂料 , 赤铁矿 ( 主要成分是 Fe2 O3) 是 炼铁 原料 ★考点三 铁的氢氧化物 1. 铁的氢氧化物的制备 实验 3-9: 在 2 支试管内分别加入少量 FeCl 3 和 FeSO4 溶液,然后滴入 NaOH溶液。观察并描述 发生的现象 . 2. 铁的氢氧化物的性质 化学式 Fe(OH)2 Fe(OH)3 颜色 状态 白色 固体 红褐色 固体 溶解性 不溶 不溶 稳定性 Fe(OH)2 FeO+H2O 2Fe(OH)3 Fe 2O3+3H2O 与 H+反应 Fe(OH)2+2H+= Fe 2++2H2O Fe(OH)3+3H+= Fe 3++3H2O 转化关系 4Fe(OH) 2+O2+2H2O=4 Fe(OH) 3 探究性学习 : 在实验 3-9 中 , 使 Fe(OH)2 变成灰绿色最后变成红褐色的氧气来源有哪些如何消除或减少氧气 的这些来源 , 以确保 Fe(OH)2 不被氧气氧化,观察到持续时间长的白色沉淀 i .氧气来源有 : FeSO4 溶液及 NaOH溶液及空气 。 ii .消除或减少氧气来源的方案设计。 (1) 实验 3-9 中减少氧气来源的方案 : 将装有 NaOH溶液的滴管伸入到试管底部 . 目的是 避免生 成的 Fe(OH)2 沉淀接触空气中的 O2。 (2) 方案欣赏 : 仔细体会以下方案的设计原理与思路并回答相关问题 用下面两种方法可以制得白色的 Fe(OH)2 沉淀: 方案一:用不含 Fe3+的 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH溶液反应制备。 ①除去蒸馏水中溶解的 O2 常采用 煮沸 的方法。 ②生成白色 Fe(OH)2 沉淀的操作可采用长滴管吸取不含 O2 的 NaOH溶液, 插入 FeSO4 溶液液面下, 再挤出 NaOH溶液。这样操作的理由是 避免生成的 Fe(OH)2 沉淀迅速接触到空气 。 方案二:在如图装置中,用 NaOH溶液、铁屑、稀 H2SO4 等试剂制备。 ①在试管Ⅰ里加入的试剂是 稀 H2SO4 铁屑 。 ②在试管Ⅱ里加入的试剂是 NaOH溶液。 ③为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹, 塞紧塞子后的实验步骤是 : 检验试管Ⅱ出口处排出的氢气的纯度。当排出 的 H2 纯净时,再夹紧止水夹 。 ④这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是 : 试管Ⅰ中反 应生成的 H2 充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入。 + 与 Fe2+ 的鉴别: 方法 溶液中含 Fe2+ 溶液中含 Fe3+ 观察法 溶液呈浅绿色 溶液呈棕黄色 通入 H2S 无现象 有浅黄色沉淀析出 加入 KSCN 无明显变化 Fe3+ + SCN- = [Fe(SCN)] 2+ 加入苯酚 无明显变化 溶液变为紫色 加入碱液 生成白色沉淀, 并变为灰绿 色,最终变成红褐色 生成红褐色沉淀 加入淀粉碘化钾试液 无明显变化 溶液变蓝 加入铜片 无明显变化 铜片溶解且溶液变为蓝色 加入 KMnO4 KMnO4 的紫色变浅 无明显变化 五、 铜及其化合物 (一)金属材料 金属材料包括纯金属和它们的合金,可分为黑色金属材料和有色金属材料。 (l) 重要的黑色金属材料 ①黑色金属材料:通常包括铁、铬、锰以及它们的合金。 ②钢是用量最大、用途最广泛的合金。 FeCl 3 溶液 FeSO4 溶液 实验现象 产生红褐色沉淀 生成的白色沉淀, 迅速变成灰绿色, 最后 变成红褐色 反应原理 Fe3+ +3OH- = Fe(OH) 3 ↓ Fe2+ +2OH- =Fe(OH) 2↓ 4Fe(OH) 2 + O 2+2H2 O=4 Fe(OH) 3 (2) 几种有色金属材料 ①有色金属材料:除黑色金属以外的其他各种金属材料及其合金。 ②几种有色金属材料 (二)、铜及其化合物的主要性质 (1) 物理性质:紫红色,不能被磁铁吸引。 (2) 化学性质: 反应物质 化学方程式 非金属 O2 2Cu+ O2 2CuO (黑色固体) Cl2、 S Cl 2+ Cu CuCl 2 ; 2Cu+S Cu 2S 氧化性酸 浓 H2SO4 Cu+2H2SO4( 浓 ) CuSO4+ SO2↑+ 2H2O 浓 HNO3 Cu+4HNO3( 浓 )===Cu(NO3) 2+ 2NO2↑+ 2H2O 稀 HNO3 3Cu+ 8HNO3( 稀 )===3Cu(NO3) 2+2NO↑+ 4H2O 盐 AgNO3 Cu+2AgNO3===Cu(NO3) 2+2Ag FeCl 3 Cu+2FeCl 3===CuCl2+2FeCl 2 2. 氧化铜和氧化亚铜 名称 氧化铜 氧化亚铜 颜色 黑 红 与酸反应 CuO+ 2H+ ===Cu2+ + H2 O Cu2O+ 2H+ ===Cu2+ + Cu+ H2 O 与 H2 反应 CuO+ H2Cu+H2O Cu2O+ H2 2Cu+ H2O ·5H2O CuSO4·5 H2O 为蓝色晶体,俗称蓝矾、胆矾。无水 CuSO4 为白色粉末,遇水变蓝色 ( 生成 CuSO4·5H2O)可作为水的检验依据。 【注】①溶液中的 Cu2+ 常为蓝色 (浓 CuCl 2 溶液为绿色,稀 CuCl2 溶液为蓝色 ) ,可作为 Cu2+的 判定依据。如 CuSO4 溶液为蓝色。② Cu 2+ 与碱反应生成蓝色沉淀 [Cu(OH) 2] ,这是鉴定 Cu2+ 的原 理之一。 六、碳硅 (一)、C、Si 单质性质及其用途的比较。 碳 硅 存在形态 既有游离态, 又有化合态; 主要单 质有: 金刚石、 石墨、 C60 等同素异 形体 在地壳中的含量仅次于氧,全部以化 合态存在;主要单质有:晶体硅和无 定性硅两大类 单质的物理 性质 金刚石熔点很高, 硬度很大; 石墨 熔点很高 (比金刚石高) 硬度较小, 能导电,有滑腻感。 晶体硅,灰黑色,有金属光泽;与金 刚石相似,熔点很高,硬度很大;是 良好的半导体材料。 化 学 性 质 与 非 金 属 单 质 反应 与 O2 反应: 2C+O2 2CO C+O2 CO2 与 O2、 Cl 2 反应: Si+O2 SiO2 Si+2Cl 2 SiCl 4 与氧 化物 反应 与 Fe2O3、H2 O、 SiO2 反应: 3C+2Fe2O3 3CO2+4Fe 2C+SiO2 2CO↑+Si 与酸 反应 与浓硫酸、浓硝酸反应: C+2H2SO4( 浓 ) CO2↑+2SO2↑+2H2O C+4HNO3( 浓 ) CO2↑+4NO2↑+2H2O 只与氢氟酸反应: Si+4HF==SiF 4↑ +2H2↑ 与碱 反应 与碱不反应 与 NaOH溶液反应: Si+2NaOH+H2O==Na2SiO 3+2H2 ↑ 用途 金刚石用作切割工具; 石墨用作电极、铅笔芯。 计算机芯片;含硅 4%的硅钢具有很 高的导磁性,主要用作变压器铁芯; 含硅 15%的硅钢具有很好的耐酸性 能,作为耐酸材料;制光电池等 二、 CO2 和 SiO2 的比较 物 质 二氧化硅 二氧化碳 物理性质 硬度大、熔沸点高、常温下为固 体、不溶于水 熔沸点低,常温下为气体,微溶 于水 化 学 性 质 ① 与 水 反应 不反应 CO2 + H 2O H 2CO3 ② 与 酸 反应 SiO2 + 4HF = SiF 4↑ + 2H 2O 不反应 ③ 与 碱 反应 SiO2 + 2NaOH = Na 2SiO3 + H 2O 盛碱液的试剂瓶用橡皮塞 CO2 + 2NaOH = Na 2CO3 + H 2O或 CO2 + NaOH = 2NaHCO3 ④ 与 盐 反应 SiO2 + Na 2CO3 = Na2SiO3 + CO 2↑ SiO2 + CaCO3 = CaSiO 3 + CO 2↑ Ca(ClO) 2 + CO2 + H 2O = CaCO3↓ + 2HClO CO2 + Na 2 CO3 + H 2O = 2NaHCO3 ⑤ 与 碱 性 氧 化 物反应 SiO2 + CaO = CaSiO 3 CO2 + Na 2 O = Na 2CO3 三、硅酸及硅酸盐 1. 硅酸 ⑴物理性质:与一般的无机含氧酸不同,硅酸难溶于水。 ⑵化学性质:①弱酸性:是二元弱酸,酸性比碳酸弱, 与 NaOH溶液反应的化学方程式为: H2SiO3+2NaOH== Na2SiO3+2H2O。 ②不稳定性:受热易分解,化学方程式为: H2SiO3 H2 O+ SiO2。 ⑶制备:通过可溶性硅酸盐与其他酸反应制得,如 Na2SiO3 溶液与盐酸反应: Na2SiO3+2HCl== H 2SiO 3↓+2NaCl ⑷用途:硅胶可用作干燥剂、催化剂的载体等。 2、硅酸盐 ⑴硅酸盐:硅酸盐是由硅、氧和金属元素组成的化合物的总称,是构成地壳岩石的主要成分。 ⑵硅酸钠:硅酸钠溶液俗称水玻璃,是无色黏稠液体,常用于制备黏合剂、防腐剂、耐火材 料。 ⑶硅酸盐组成的表示 通常用二氧化硅和金属氧化物的组合形式表示硅酸盐的组成:如硅酸钠( Na2SiO3)可表示 为 Na2O·SiO 2。长石( KAlSi 3O8)可表示为 K2O·Al 2O3·6SiO 2。(注意:硅酸盐写法与氧化物写 法中各元素的化合价保持不变,原子个数比相等;表示顺序一般为:活泼金属的氧化物·较 活泼金属的氧化物·二氧化硅·水) 。 四、无极非金属材料 1. 传统的无极非金属材料 硅酸盐材料是传统的无机非金属材料:玻璃、水泥、各种陶瓷等都是以黏土、石英和 长石等为原料生产的硅酸盐制品,比较如下 硅酸盐产品 水 泥 玻 璃 陶瓷 原 料 石灰石、黏土 纯碱、石灰石、石英 黏土 反应原理 发生复杂的物理化学 变化(不作要求) SiO2 + Na 2CO3 =====Na2 SiO3 + CO 2↑ SiO2 + CaCO3 =====CaSiO3 + CO2 ↑ 主要设备 水泥回转窑 玻璃窑 陶瓷窑 主要成分 3CaO·SiO2、2CaO·SiO2、 3CaO·Al 2O3 Na2SiO 3、 CaSiO3 、SiO2 反应条件 高温 高温 2. 新型无极非金属材料 材料类别 主要特性 示例 用途 半导体陶瓷 具有电学特性 氧化锡陶瓷 集成电路中的半导体 光学材料 具有光学特性 光导纤维 光缆通讯、医疗、照明等 生物陶瓷 具有生物功能 氧化铝陶瓷钉 人造骨、人造关节、接骨 螺 【要点名师透析】 1. 硅及其化合物的特殊性质 高温 高温 高温 高温 高温 高温 (1)硅 ①非金属单质一般为非导体,如硫,但 Si 却为半导体;②非金属单质与碱反应一般 是非金属既作氧化剂又作还原剂,而 Si 与碱反应只作还原剂;③ C、 Si 同属Ⅳ A 族,还原性 是 Si 大于 C,而 C却能将 Si 从 SiO2 中还原出来 ( 条件是高温 ) ,原因是产物 CO气体迅速从反 应体系中逸出, SiO2+ 2CSi+2CO↑;④非金属单质一般不跟非氧化性酸作用,而 Si 能与 HF 发生反应, Si + 4HF==SiF4↑+ 2H2↑; (2)硅的化合物 ①酸性氧化物一般不与酸发生非氧化还原反应,但 SiO2 却能与 HF作用, SiO2+4HF===SiF4↑+ 2H2O; ②无机酸一般可溶于水, 而 H2SiO3 及 H4SiO4 却难溶于水; Na2SiO3 水溶液俗名为 “水玻璃” , 但它与玻璃却大相径庭, Na2SiO3 水解显强碱性,俗名“泡花碱”,但它却不是碱,而是盐。 二、 CO2 与碱的反应及 HCO3 - 、CO3 2- 的检验 与强碱反应 反应原理: NaOH Na2CO3 NaHCO3 反应后溶质成分的判断可用数轴表示: 溶质的成分 X≤ 1∶1 NaHCO3 1∶ 1HCl > HBr > HI ②最高价氧化物对应的水化物的酸性强弱 HClO4 > HBrO4 5、溴单质的氧化性介于 Cl2 和 I2 之间, 因此在海水提溴的化工生产中可以选用 Cl2 作氧化 剂。从海水中提取溴,一般要经历浓缩、氧化 , 提取 三个步骤。 6、溴的应用 ①工业上:制造燃料的抗爆剂;溴化银常被用做 感光 材料。 ②农业上:制含溴的杀虫剂。如薰蒸剂,杀虫剂,抗爆剂 ③医药上: 红药水的主要成分就是含溴和汞的有机化合物 。KBr 和 NaBr 则常被用做镇静剂; 碘也是一种重要的药用元素,可治疗口腔溃疡,如碘甘油,华素片(还可制加碘盐) 。 AgI 可用于人工降雨,使空气里的水蒸气凝聚成雨。 如何鉴别 Cl- 、 Br- 、 I- 7、 Cl - 、 Br - 、 I - 的鉴别 Cl - 生成不溶于稀硝酸的白色沉淀 Br - 生成不溶于稀硝酸的淡黄色沉淀 I - 生成不溶于稀硝酸的黄色沉淀 九、氮 (一)氮气及氮的氧化物 1. 物理性质 颜色 气味 毒性 密度 溶解性 N2 无色 无味 无毒 比空气稍小 难溶于水 NO 无色 无味 有毒 比空气稍大 不溶于水 NO2 红棕色 有刺激性气味 有毒 比空气稍大 与水发生反应 2. 化学性质 (1)氮气 ①与氧气反应 ② 与氢气反应 (2)NO 与 O2反应: 2NO+ O2===2NO2 ( NO的检验, NO与 O2 不共存) (3)NO 2与 H2O反应: 3NO2 +H2O===2HNO3+ NO( n( 氧化剂 ) :n( 还原剂 )=1:2 ) 3.氮的氧化物对环境的影响 (1) 形成硝酸型酸雨 。 (2) 形成光化学烟雾 。 (3) 破坏臭氧层。 (二)氨和铵盐 1.氨气( NH3):( 1)分子结构:由极性键形成的三角锥形分子, N -3 价,为 N 元素的最低 价态 (2)物理性质:无色、刺激性气味的气体,密度比空气小,极易溶于水,常温常压下 1 体积水能溶解 700 体积的氨气(喷泉实验,尾气处理需防倒吸) ,易液化(可作致冷剂) 氨气的喷泉实验:①原理(极易溶于水使内外形成较大气压差)②引发操作③现象 ④成功关键:烧瓶干燥、装置气密性好、氨气集满 (3)化学性质: ①与水反应:氨水呈碱性,原理: NH3+H2ONH3·H2ONH4 ++OH- 氨气是中学阶段唯一能使湿润的红色石蕊试纸变蓝色的气体,常用此性质检验氨气。 (饱和氨水中存在的平衡体系:溶解平衡, NH3·H2O、 H2 O的电离平衡) (氨水中微粒: NH3、H2O、 NH3·H2O; NH4 + 、OH- 、 H+ ) NH3·H2O化学性质:弱碱性、不稳定性。 (氨水易挥发:越热、越浓越易挥发) ②与酸反应:与挥发性酸 ( 如浓盐酸、硝酸 )的反应: NH3+HCl=NH4Cl 现象:产生白烟(也可 检验 NH3)与硫酸反应: 2NH3+H2SO4=(NH4) 2SO4 ③与盐溶液反应:向 AlCl 3 溶液中滴加氨水反应的离子方程式为: Al 3++3 NH3·H2O=Al(OH)3↓+3 NH 4 + ④NH3 具有还原性,能被 O2、 CuO、NOx、 Cl 2 等物质氧化。 +5O2 4NO+6H2O ( 工业制硝酸的基础 ) 4NH 3+3O22N2+6H2O(置换反应) +3CuO 3Cu+N2+3H2O +8NH3==N2+6NH4Cl (白烟) (4)制备:工业:实验室: (见要点透析) 2.铵盐 (1)物理性质:白色晶体,易溶于水 (2)化学性质:①热解: NH 4HCO3 = NH3↑ + H 2O + CO2 ↑( 30℃以上可分解) , NH 4Cl = NH3↑+ HCl ↑ ②碱解: Ca( OH) 2 + 2NH 4Cl = CaCl 2 + 2NH 3↑ + 2H 2O 铵盐与碱溶液的离子方程式: NH4 + + OH- = NH3 ↑+ H2O(该性质可用于氨气的制取和铵根离子 的检验) (3)NH4 + 的检验 :取少量样品,与碱混合于试管中,加热。将湿润的红色石蕊试纸靠 近管口,试纸变蓝色,说明样品中含有 NH4 +;也可以将蘸有浓盐酸的玻璃棒靠近管口,若有白 烟产生,说明样品中含有 NH4 +。 三、硝酸 1、物理性质:无色、易挥发(在空气中遇水蒸气呈白雾状) ,有刺激性气味的液体。 2、化学性质⑴强酸性:稀硝酸使紫色石蕊试液变红色,浓硝酸使紫色石蕊试液先变红色后褪 色。 ⑵不稳定性 由于浓硝酸溶有分解出的 NO2 气体,所以浓硝酸一般为黄色,可通空气或氧气转化 其保存方法是:棕色细口瓶(玻璃塞)置于阴凉处。 ⑶强氧化性 ①与金属( Au、Pt 以外的所有金属) (部分化学方程式,注意离子方程式) Cu+4HNO3( 浓 )= Cu(NO 3) 2+2NO2↑+2H2 O、 3Cu+8HNO 3( 稀 )=3Cu(NO3) 2 +2NO↑+4H2O 3Fe+8HNO3( 稀、少 )=3Fe(NO3 ) 2+2NO↑+4H 2O Fe+4HNO3 (稀、足 )= Fe(NO 3) 3+NO↑+2H2O 金属 Al 、 Fe 在冷的浓硝酸中发生钝化(不是不反应) 。故可以用铁、铝容器运输冷的浓硝酸。 ②与非金属的反应 碳与浓硝酸: C+4HNO3(浓) CO2↑+4NO2↑+2H2O ③与某些还原性物质反应 3FeO+ 10HNO3( 稀 )= 3Fe(NO 3 ) 3+NO↑+5H2O 3Fe 2++ NO3 - + 4H + = 3Fe 3+ +NO↑+2H2O 3、工业制备 4NH3+5O2 4NO+6H2O 2NO+O2===2NO2 3NO2+ H2 O===2HNO3+ NO △ △ △ △ 4、 NO3 离子检验:固体或浓溶液与浓硫酸、 Cu共热时,若产生红棕色气体则含 NO3 ; 若为稀溶液则先浓缩。 【要点名师透析】 一、氨气的实验室制法 1、实验室制法 Ⅰ、一般方法⑴装置图 ( 如右图 ) : ⑵反应原理: 2 NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2 O ⑶装置类型:固体 +固体气体(与 KClO3 或 KMnO4 制 O2相同) ⑷收集:向下排空气法。 ⑸干燥:用碱石灰( NaOH和 CaO固体的混合物) ⑹检验:①用湿润的红色石蕊试纸置于试管口,若试纸变蓝色,说明氨已收集满了;②将蘸 有浓盐酸的玻璃棒置于试管口,若有白烟产生,说明收集满了。 ⑺尾气处理①在导管口放一团用水或稀硫酸浸湿的棉花团吸收多余的氨气。 ②用水或稀硫酸吸收多余的氨气(注意防倒吸,如图) Ⅱ、两种简易方法 ⑴加热浓氨水法 ①反应原理: NH3·H2O NH3↑+H2 O ⑵浓氨水中加固态碱性物质 浓氨水中存在平衡: NH3+H2ONH3·H2ONH4 ++OH- 加入碱性物质(如: NaOH、CaO、碱石灰等),使平衡逆向移动,同时反应放热,促进 NH3·H2O 的分解。 【提醒】:①制氨气所用铵盐不能用硝铵、碳铵。因加热过程中 NH4NO3 可能发生爆炸性的分解 反应,发生危险;而碳铵受热极易分解产生 CO2,使生成的 NH3 中混有较多的 CO2 杂质。②消石 灰不能用 NaOH、KOH代替,原因是: a、NaOH、KOH具有吸湿性、易结块,不利于产生 NH3;b、 在高温下能腐蚀大试管。③因氨气比空气轻,易与空气发生对流,所以收集时,导气管应插 入收集气体的试管底部附近,管口塞一团干燥的棉花团,来防止 NH3 与空气对流,确保收集到 纯净的氨气。④制备 NH3 也可以通过加热浓氨水的方法,利用 NH3·H2ONH3↑+H2O原理制备。也 可以利用往浓氨水中加入烧碱制备,原理:烧碱溶于水为放热反应,促进 NH3·H2 O 的分解, 增大 c(OH ) 使上述可逆反应向左移动,而产生 NH3。 二、金属与硝酸反应计算题的思维模型 1. 思维模型 2. 计算中的守恒思想的应用 (1) 原子守恒法: HNO3 与金属反应时,一部分 HNO3起酸的作用,以 NO- 3 的形式存在于溶液中; 一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的 HNO3 中 氮原子的物质的量。 (2) 得失电子守恒法: HNO3 与金属的反应属于氧化还原反应, HNO3 中氮原子得电子的物质的量 等于金属失电子的物质的量。 (3) 电荷守恒法: HNO3 过量时反应后溶液中 (不考虑 OH- )则有: c(NO- 3 ) = c(H+ )+ nc(Mn+ )(M n + 代表金属离子 )。 (4) 离子方程式计算法:金属与 H2SO4、HNO3 的混合酸反应时,由于硝酸盐中 NO- 3 在 H2SO4 提供 H +的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根 据完全反应的金属或 H+ 或 NO- 3 进行相关计算,且溶液中要符合电荷守恒。
查看更多