- 2021-08-23 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年甘肃省高台县第一中学高二上学期期中考试化学试题 (Word版)
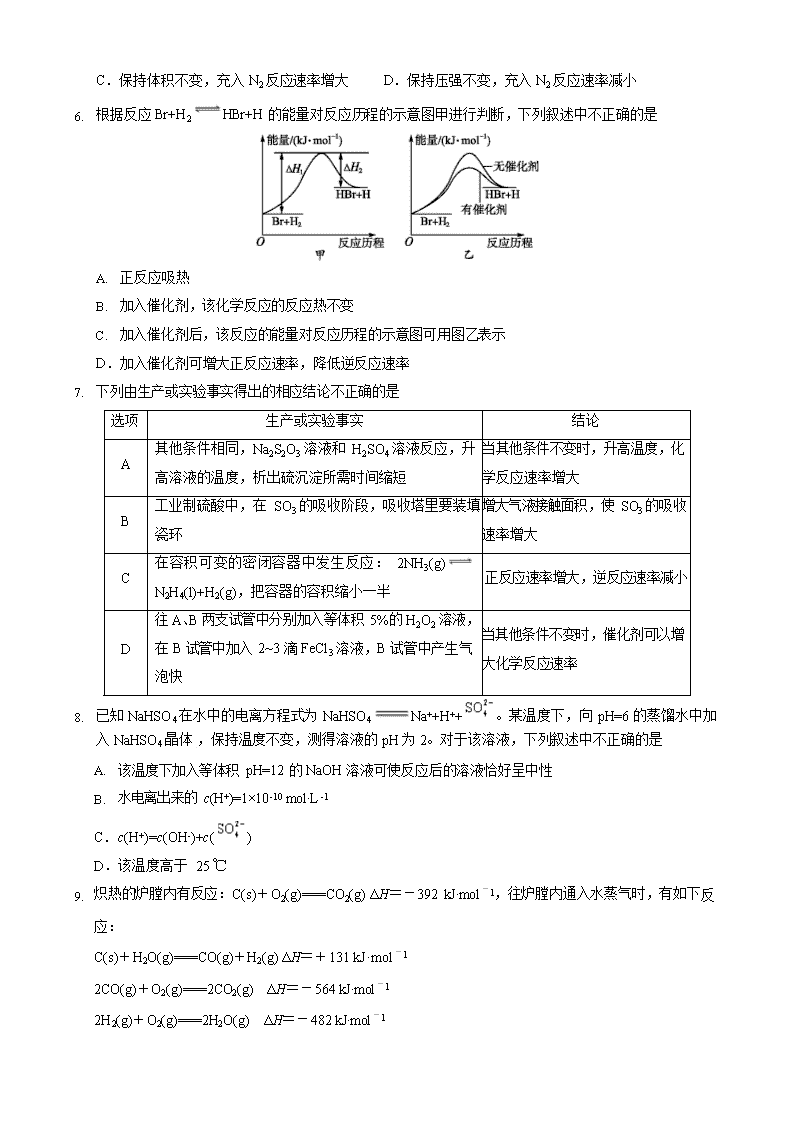
高台一中 2019-2020 学年上学期期中试卷 高二化学 (考试时间:90 分钟 试卷满分:100 分) 测试范围:人教选修 4 第 1~3 章。 可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 第Ⅰ卷 一、选择题:本题共 16 个小题,每小题 3 分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1. 下列措施不符合节能减排的是 A. 大力发展火力发电,解决电力紧张问题 B. 在屋顶安装太阳能热水器为居民提供生活用热水 C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏 D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气 2. 水的电离过程为 H2O H++OH-,在 25 ℃时水的离子积为 KW=1.0×10 -14,在 35 ℃时水的离子积为 KW=2.1×10 -14,则下列叙述正确的是 A.c(H+)随着温度的升高而降低 B.35 ℃时 c(H+)>c(OH-) C.35 ℃时的水比 25 ℃时的水电离程度 小 D.水的电离是个吸热过程 3. 下列事实不能证明醋酸(CH3COOH)是弱电解质的是 A.CH3COOH 具有挥发性 B.CH3COOH 溶液中含有 CH3COOH 分子 C.常温下 0.1 mol·L −1 CH3COOH 溶液的 pH=3 D.常温下pH=3 的 CH3COOH 溶液稀释至 100 倍,pH<5 4. 反应 4A(s)+3B(g) 2C(g)+D(g),经 2 min B 的浓度减少 0.6 mol·L -1。对此反应速率的正确表示是 A. 用 A 表示的反应速率是 0.8 mol·L -1·s -1 B. 分别用B、C、D 表示反应的速率,其比值是 3∶2∶1 C. 在 2 min 末时的反应速率,用反应物B 来表示是 0.3 mol·L -1·min -1 D. 在这 2 min 内用 B 和 C 表示的反应速率的值都是相同的 5. 在一密闭容器中发生反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),下列判断正确的是 A.升高反应温度对反应限度无影响 B.改变 H2 的浓度对正反应速率无影响 C.保持体积不变,充入 N2 反应速率增大 D.保持压强不变,充入 N2 反应速率减小 6. 根据反应 Br+H2 HBr+H 的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是 A. 正反应吸热 B. 加入催化剂,该化学反应的反应热不变 C. 加入催化剂后,该反应的能量对反应历程的示意图可用图乙表示 D.加入催化剂可增大正反应速率,降低逆反应速率 7. 下列由生产或实验事实得出的相应结论不正确的是 选项 生产或实验事实 结论 A 其他条件相同,Na2S2O3 溶液和 H2SO4 溶液反应,升 高溶液的温度,析出硫沉淀所需时间缩短 当其他条件不变时,升高温度,化 学反应速率增大 B 工业制硫酸中,在 SO3 的吸收阶段,吸收塔里要装填 瓷环 增大气液接触面积,使 SO3 的吸收 速率增大 C 在容积可变的密闭容器中发生反应: 2NH3(g) N2H4(l)+H2(g),把容器的容积缩小一半 正反应速率增大,逆反应速率减小 D 往 A、B 两支试管中分别加入等体积 5%的 H2O2 溶液, 在 B 试管中加入 2~3 滴 FeCl3 溶液,B 试管中产生气 泡快 当其他条件不变时,催化剂可以增 大化学反应速率 8. 已知 NaHSO4 在水中的电离方程式为 NaHSO4 Na++H++ 。某温度下,向 pH=6 的蒸馏水中加 入 NaHSO4 晶体 ,保持温度不变,测得溶液的 pH 为 2。对于该溶液,下列叙述中不正确的是 A. 该温度下加入等体积 pH=12 的 NaOH 溶液可使反应后的溶液恰好呈中性 B. 水电离出来的 c(H+)=1×10 -10 mol·L -1 C.c(H+)=c(OH-)+c( ) D.该温度高于 25 ℃ 9. 炽热的炉膛内有反应:C(s)+O2(g)===CO2(g) ΔH=-392 kJ·mol -1,往炉膛内通入水蒸气时,有如下反 应: C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol -1 2CO(g)+O2(g)===2CO2(g) ΔH=-564 kJ·mol -1 2H2(g)+O2(g)===2H2O(g) ΔH=-482 kJ·mol -1 4 由以上反应推断往炽热的炉膛内通入水蒸气时 A. 不能节约燃料,但能使炉膛火更旺 B.虽不能使炉膛火更旺,但可节约燃料 C.既可使炉膛火更旺,又能节约燃料 D.既不能使炉膛火更旺,又不能节约燃料 10. 已知H 2(g)+I2(g) 2HI(g) ΔH<0,有相同容积的定容密闭容器甲和乙,甲中加入 H2 和 I2 各 0.1 mol, 乙中加入 HI 0.2 mol,相同温度下分别达到平衡。欲使甲中 HI 的平衡浓度大于乙中 HI 的平衡浓度,应 采取的措施是 A. 甲、乙提高相同温度 B. 甲中加入 0.1 mol He,乙不改变 C.甲降低温度,乙不变 D.甲增加 0.1 mol H2,乙增加 0.1 mol I2 11. 用 CH4 催化还原 NOx,可以消除氮氧化物的污染。例如: ①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol -1 ②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol -1 下列说法不正确的是 A. 若用标准状况下 4.48 L CH4 还原 NO2 生成 N2 和水蒸气,放出的热量为 173.4 kJ B.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol -1 C.生成相同物质的量的 CO2,反应①②转移的电子数相同 D.反应②中当 4.48 L CH4 反应完全时转移的电子总数为 1.60 mol 12.下列有关电解质溶液的说法正确的是 A. 向 0.1 mol·L -1 CH3COOH 溶液中加入少量水,溶液中 c(H+) 减小 c(CH3COOH) c(CH3COO-) B. 将 CH3COONa 溶液从 20 ℃升温至 30 ℃,溶液中c(CH3COOH)·c(OH -)增大 c(NH+) C. 向盐酸中加入氨水至中性,溶液中 c(Cl-) >1 c(Cl-)D. 向 AgCl、AgBr 的饱和溶液中加入少量 AgNO3,溶液中 - 不变 c(Br ) 13. 已知碳酸、亚硫酸、次氯酸在 25 ℃时的电离常数如下: 电离常数 Ka1 Ka2 H2CO3 4.40×10 -7 5.61×10 -11 3 H2SO3 1.54×10 -2 1.02×10 -7 HClO 2.95×10 -8 则下列说法正确的是 A. Na2CO3 溶液中通入少量 SO2:2 CO2− +SO2 +H2O 2 HCO− + SO2− 3 3 3 B. NaHCO3 溶液中通入少量 SO2:2 HCO− +SO2 CO2+ SO2− +H2O 3 3 C. NaClO 溶液中通入少量 SO2:2ClO-+SO2 +H2O 2HClO+ SO2− D. 向氯水中分别加入等浓度的 NaHCO3 和 NaHSO3 溶液,均可提高氯水中HClO 的浓度 14. 在某一容积为 2 L 的密闭容器中,A、B、C、D 四种气体发生可逆反应,其物质的量 n(mol) 随时间 t(min) 的变化曲线如图所示。下列说法正确的是 A. 0~2 min,A 的化学反应速率 v(A)=0.2 mol·L -1·min -1 B.2 min 时,图像发生改变的原因只可能是增大压强 C.增加气体D 的浓度,A 的化学反应速率减小 D.其他条件不变,3 min 时体系的压强不再发生变化 15. 在一定温度下,将气体 X 和气体Y 各 0.16 mol 充入 10 L 恒容密闭容器中,发生反应 X(g)+Y(g) 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表 : t/min 2 4 7 9 n(Y)/mol 0.12 0.11 0.10 0.10 下列说法正确的是 A. 反应前 2 min 的平均速率 v(Z)=2.0×10 -3 mol·(L·min) -1 B. 其他条件不变,降低温度,反应达到新平衡前 v(逆)>v(正) C.该温度下此反应的平衡常数 K=1.44 D.其他条件不变,再充入 0.2 mol Z,平衡时X 的体积分数增大 16. 室温下,向 25 mL 0.1 mol·L -1 NaOH 溶液中逐滴加入 0.2 mol·L -1 CH3COOH 溶液,混合液的 pH 与滴加 CH3COOH 溶液体积的关系如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说 法错误的是 2 2 A. 在 A、B 间任一点,溶液中一定都有 c(Na+)+c(H+)=c(CH3COO-)+c(OH-) B.在 B 点:a>12.5,且有 c(Na+)=c(CH3COO-)>c(OH-)=c(H+) C.在 C 点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D.在 D 点:c(CH3COO-)+c(CH3COOH)=0.1 mol·L -1 第Ⅱ卷 二、非选择题:包括第 17 题~第 21 题五个大题,共 52 分。 17.(7 分)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热; b.先使煤与水蒸气反应得到氢气和一氧化碳,然后再使得到的氢气和一氧化碳在充足的空气中燃烧。这 两个过程的热化学方程式为 a.C(s)+O2(g)===CO2(g) ΔH=E1① b.C(s)+ H2O(g)===CO(g)+H2(g) ΔH=E2② H2(g)+ 1O2(g)===H2O(g) ΔH=E3③ CO(g)+1O2(g)===CO2(g) ΔH=E4④ (1) 上述四个热化学方程式中哪个反应的 ΔH>0? (填序号)。 (2) 等质量的煤分别通过以上两种不同的途径产生的可利用的总能量关系正确的是 ______(填字母)。 A.a 比 b 多 B.a 比 b 少 C.a 与 b 在理论上相同 (3) 根据能量守恒定律,E1、E2、E3、E4 之间的关系为 E1= 。 (4) 已知: ①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol -1 ②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ·mol -1 ③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3=+141 kJ·mol -1 则 TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的 ΔH= 。 18.(10 分)葡萄酒中常通入二氧化硫用做抗氧化剂。葡萄酒样品中抗氧化剂的残留量测定(已知: SO2+I2+2H2O H2SO4+2HI):准确量取 100.00 mL 葡萄酒样品,加酸蒸馏出抗氧化剂成分。取馏 ⅰSO2 ⅱCaO 3 2 4 3 分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为 0.0225 mol·L −1 标准 I2 溶液滴定至终点,消耗 标准 I2 溶液 16.02 mL。重复以上操作,消耗标准 I2 溶液 15.98 mL。 (1) 滴定时,将标准I2溶液装在 (填“酸式”或“碱式”)滴定管中。 (2) 滴定操作时,左手控制滴定管,右手 ,眼睛要注视 。 (3) 滴定时(I2和SO2反应)以淀粉为指示剂,终点时溶液由 色变为 色。 (4) 测定时,滴定管经蒸馏水洗涤后即加滴定剂标准I2溶液,导致测定结果 (填“偏高”“偏 低”或“无影响”)。 (5) 计算葡萄酒样品中抗氧化剂的残留量(单位:mg·L −1,以 SO2 计算,请给出计算过程)。 19.(10 分)氨是最重要的氮肥,是产量最大的化工产品之一,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol -1。在密闭容器中,使 2 mol N2 和 6 mol H2 混合发生下列反应: N2(g)+3H2(g) 2NH3(g)(正反应为放热反应) (1) 当反应达到平衡时,N 2 和 H2 的浓度比是 ;N2 和 H2 的转化率比是 。 (2) 升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 大”“变小”或“不变”) 。(填“变 (3) 当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。 (4) 若容器恒容、绝热,加热使容器内温度迅速升至原来的 2 倍,平衡将 (填“向左移动”“向右 移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的 2 倍。 20.(13 分)(1)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11,草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5 ①0.1 mol·L -1 Na2CO3 溶液的 pH 0.1 mol·L -1 Na2C2O4 溶液的 pH。(填“大于”“小于”或“等于”) ②等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是 。 ③若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是 。(填字母) a.c(H+)>c(HC O-)>c(HCO-)>c(CO2-) 2 4 3 3 b.c(HCO-)>c(HC O-)>c(C O2-)>c(CO2-) 3 2 4 2 4 3 c.c(H+)>c(HC O-)>c(C O2-)>c(CO2-) 2 4 2 4 3 d.c(H2CO3)>c(HCO-)>c(HC O-)>c(CO2-) (2)SO2 会对环境和人体健康带来极大的危害,工业上采取多种方法减少 SO2 的排放,回答下列方法 中的问题。 方法 1(双碱法):用 NaOH 吸收 SO2,并用 CaO 使 NaOH 再生 NaOH 溶液 Na2SO3 溶液 ①写出过程ⅰ的离子方程式: ; ②CaO 在水中存在如下转化: CaO(s)+H2O (l)===Ca(OH)2(s) Ca2+(aq)+2OH-(aq) 从平衡移动的角度,简述过程 ii 中 NaO H 再生的原理 。 方法 2:用氨水除去 SO2 ③已知 25 ℃,NH3·H 2O 的 Kb=1.8×10 -5,H2SO3 的 Ka1=1.3×10 -2,Ka2=6.2×10 -8。若氨水的浓 度为 2.0 mol·L -1,溶液中的 c(OH-)= mol·L -1。将 SO2 通入该氨水中,当 c(OH-)降 至 1.0×10 -7 mol·L -1 时,溶液中的 c(SO2-)/c(HSO-)= 。 3 3 21.(12 分)碳、氮及其化合物是同学们经常能接触到的重要物质,是科学研究的重要对象。 (1) H2NCOONH4 是工业合成尿素的中间产物,该反应的能量变化如图甲所示。用 CO2 和氨气合成 尿素的热化学方程式为 。 (2) 合理利用 CO2、CH4,抑制温室效应成为科学研究的新热点。一种以二氧化钛表面覆盖 Cu2Al2O4 为催化剂,可以将 CO2 和 CH4 直接转化成乙酸(ΔH<0)。在不同温度下催化剂的催化效率与乙酸 的生成速率分别如图乙所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是 。250 ℃和 400 ℃时乙酸的生成速率几乎相等,实际生产中应选 择的温度为 ℃。 (3)T ℃时,将等物质的量的 NO 和 CO 充入体积为 2 L 的密闭容器中发生反应 2NO+2CO 2CO2+N2。保持温度和体积不变,反应过程中 NO 的物质的量随时间的变化如图丙所示。 ①平衡时若保持温度不变,再向容器中充入 CO、N2 各 0.8 mol,平衡 将 (填“向左”“向右”或“不”)移动。 ②图中 a、b 分别表示在一定温度下,使用相同质量、不同表面积的催 化剂时,达到平衡过程中 n(NO)的变化曲线,其中表示催化剂表面积较 大的曲线是 (填“a”或“b”)。 ③15 min 时,若改变外界反应条件,导致 n(NO)发生如图所示的变化,则改变的条件可能是 (任答一条即可)。 2 2 2 2 高二化学·参考答案 1 2 3 4 5 6 7 8 A D A B D D C A 9 10 11 12 13 14 15 16 A C D D A D C C 7.(7 分) (1)②(1 分 ) (2)C(2 分 ) (3)E1=E2 +E3 +E4 (2 分 ) (4)-80 kJ·mol-1 (2 分 ) 18.(10 分) (1)酸式(1 分) (2)不断振荡锥形瓶(1 分) 锥形瓶内溶液颜色的变化(1 分) (3)无(1 分) 蓝 (1 分) (4)偏高(2 分) (5)V(I )=(16.02 mL+15.98 mL)/2=16.00 mL=1.6×10 −2 L, n(SO )=n(I )=1.6×10 −2 L×0.0225 mol·L −1 =3.6×10 −4 mol, m(SO )=3.6×10 −4 mol×64 g·mol −1 =2.304×10 −2 g, 样品中抗氧化剂的残留量为 2.304×10 −2 g/0.1 L=0.2304 g·L −1 ,即 230.4 mg·L −1 。(3 分) 19.(10 分) (1)1:3 (2 分 ) 1:1 (2 分 ) ? ? (2) 变 小 (1 分 ) 不 变 (1 分 ) (3)逆向 (1 分) (4)向左移动 (1 分) 小于 (2 分) 20.(13 分,除标明外,每空 2 分) (1)① 大 于 (1 分 ) ② 草 酸 ③ac (2)①2OH- +SO ===퐒퐎ퟐ− +H O 2 ? 2 ②퐒퐎ퟐ−与 Ca2+ 生成 CaSO 3 沉淀,平衡向正向移动,有 NaOH 生成 -3 ③6.0×10 0.62 21.(12 分) (2)250 ℃时,催化剂的催化效率最好,之后催化剂的催化效率急剧降低(2 分) 250 (1 分) (3)① 向 右 (2 分 ) ② b(2 分 ) ③增加 CO 的物质的量浓度、增大压强、减少生成物浓度(2 分)查看更多